不同稀释倍数和容器对蛋种鸡和肉种鸡精液品质的影响
秦国栋 史雪萍 张彩燕 李莉 吴雪松 王述柏
不同稀释倍数和容器对蛋种鸡和肉种鸡精液品质的影响
秦国栋 史雪萍 张彩燕 李莉 吴雪松 王述柏*
(青岛农业大学动物科技学院 山东 青岛 266109)
本试验旨在研究不同稀释倍数和容器对蛋种鸡和肉种鸡精液品质的影响。分别采集45周龄海兰褐父母代蛋种公鸡和AA+父母代肉种公鸡精液,采用生理盐水对精液按照不同稀释比例进行等温及时稀释,蛋种鸡和肉种鸡采集的精液均分6组,每组设3个重复,原精液:生理盐水比例分别为1:0、1:1、1:5、1:10、1:50、1:100。保存精液的容器分别采用塑料集精管和玻璃集精管,精液稀释后立即检测精子活力以及畸形率。结果表明,蛋种鸡、肉种鸡精液稀释倍数1:50和1:100组比较,精子活力和畸形率均无显著差异(P>0.05);相同稀释倍数下,塑料集精管和玻璃集精管比较,精子活力和畸形率亦均无显著差异(P>0.05);稀释倍数为1:0、1:1、1:5、1:10的精液,精液密度过大无法检测。结论:海兰褐壳父母代种鸡和AA+父母代肉种鸡的新鲜精液,便于进行精液品质镜检的适宜稀释倍数为原精液:稀释液≥1:50,精液短时间保存集精管采用玻璃及塑料材质均可。
种公鸡 精子活力 畸形率 稀释倍数 精液容器
精液品质检查是对种公鸡进行选种的重要环节,精子密度、活力和畸形率等指标是衡量精液品质的重要指标[1]。禽类精液具有射精量少、密度大、精子对环境敏感性强等特点,目前对禽类精液进行品质检查的方法有CASA计算机辅助精子分析仪法、Makler精子计数池法、吸光光度法和血细胞计数板法[2]。计算机辅助分析法,检测数据较为精确,但仪器价格昂贵且技术要求高,难以普及;Makler精子计数池法,存在因计数池深度太浅(10μm)影响精子的正常运动从而使精子所测活力比真实值低的问题[3]。而血细胞计数板的计数室高度为0.1mm,其高度不会影响精子尾部的鞭打,精子在其中可自由运动。显微镜镜检方法具有操作简单,节约成本优点,仍然是目前生产中常用的检查方法[4]。鸡精液的精子密度一般在(2~4)×109/mL[5]。因精子密度过大,原精液不进行稀释难以进行镜检,因此,适宜的稀释倍数是实施精液镜检的关键因素。迄今有关不同种类及品种家禽精液品质检查的适宜稀释倍数研究报道很少。本试验研究了不同精液稀释倍数和保存容器对种公鸡精液品质的影响,旨在为生产或科学试验中种公鸡精液品质检查工作的顺利开展提供科学依据。
1 材料与方法
1.1 试验动物 45周龄海兰褐父母代种公鸡8只和AA+父母代种公鸡8只。
1.2 仪器设备 OLPUS显微镜、恒温水浴锅、采精杯、10ml玻璃集精管、10mL塑料集精管、血球计数板、计数器、载玻片、盖玻片等。
1.3 试验设计 采用背腹式按摩法分别采集8只海兰褐父母代种公鸡和8只AA+父母代种公鸡的精液,两种公鸡的精液分别混匀,用移液枪取1 ml蛋种鸡精液分别加入塑料和玻璃集精管中,用移液枪取1 ml肉种鸡精液加入玻璃集精管,采用生理盐水作为稀释液,对精液按照不同稀释比例进行等温及时稀释,两种精液均分6组,每组设3个重复,原精液:生理盐水比例分别为1:0、1:1、1:5、1:10、1:50、1:100。采用OLPUS显微镜检查500个精子,计算精子活力和精子畸形率。自采精至稀释后镜检,间隔时间保持在5min。
1.4 精子活力的检测 采用OLPUS显微镜检查精子的运动状态,记录直线运动、非直线运动精子数(包括死精子,摆动旋转运动的精子)数,计算精子活力[6]。
1.5 精子畸形率测定 采用OLPUS显微镜检查精子形态,记录不同类型的精子数量,畸形精子的判定标准及精子畸形率的计算参见文献[6]。
1.6 数据处理 用Excel2016软件对试验数据进行初步处理,用SPSS20.0软件进行统计处理,进行独立样本T检验分析组间差异显著性,结果以平均值±标准误表示。
2 结果与分析
2.1 不同稀释倍数和保存容器对种鸡精子活力的影响 不同稀释倍数、保存容器对种鸡精子活力的影响见表1。原精液以及稀释倍数为1:1、1:5、1:10组的精液,由于精子密度过大看不清,难以检测计数精子活力。塑料集精管存放的蛋种鸡稀释精液,1:50和1:100组之间,精子活力无显著差异(P>0.05);玻璃集精管存放的肉种鸡和蛋种鸡稀释精液,1:50和1:100组之间,精子活力亦无显著差异(P>0.05);相同稀释倍数下,玻璃集精管存放的蛋种鸡精液的精子活力略高于塑料集精管(P>0.05)。
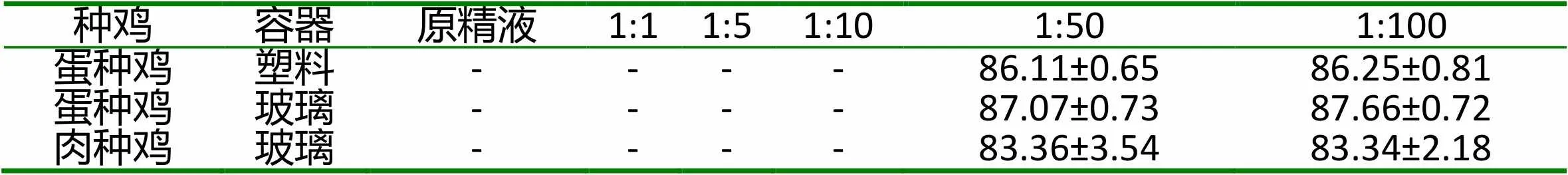
表1 不同稀释倍数和保存容器对种公鸡精子活力的影响(%)
注:“-” 为精子密度过大,难以检测精子活力。同行数据无肩标小写字母表示差异不显著(P>0.05)。
2.2 不同稀释倍数、保存容器对种公鸡精子畸形率的影响 不同稀释倍数、保存容器对种公鸡精子畸形率的影响见表2。原精液以及稀释倍数为1:1、1:5、1:10组的精液,由于精液密度过大,精子形态看不清楚,畸形率无法检测。塑料集精管、玻璃集精管存放的蛋种鸡稀释精液,1:50和1:100组之间精子畸形率均无显著差异(P>0.05);玻璃集精管存放的肉种鸡稀释精液精子畸形率1:50和1:100组之间亦无显著差异(P>0.05)。

表2 不同稀释倍数和保存容器对种公鸡精子畸形率的影响(%)
3 讨论
3.1 不同稀释倍数和保存容器对种公鸡精子活力的影响 池春梅试验发现生理盐水与精液按照1:1稀释效果最好,比原精液的受精率高3.57%[7],满都拉研究表明,稀释不同倍数的种公羊精液,精子活力有显著差异,稀释液在室温下保存,以稀释8倍的效果较好,精子存活时间达24h,精子活力高,稀释4倍与16倍的精液,保存结果亦良好[8]。祝盘大报道,羊精液稀释2~128倍,无论是在室温或低温下保存,精子生存时间与存活指数均较原精液为高,但稀释倍数过高,精子活力会受到影响,未经稀释的原精掖,在室温下保存2h,便不能用来输精[9]。彭秀丽(2001)采用1%NaCl做为稀释剂,鸡精液分别按稀释倍数1:1、1:1.5、1:2稀释,发现1:1稀释时种蛋受精率较高,精子活力较强[10]。本试验结果显示,公鸡原精液、1:1、1:5、1:10稀释倍数的精液,精子密度过大在显微镜下难以计数,在玻璃和塑料两种材质的集精管中稀释倍数为1:50、1:100的精液,稀释后立即检测精子活力,发现稀释倍数和容器不同,精子活力无显著差异。
3.2 不同稀释倍数和保存容器对种公鸡精子畸形率的影响 精子形态检测是评估精子功能最有价值的指标之一,形态是否正常与种蛋受精率有直接关系,畸形精子越少种蛋受精率越高[11]。本试验结果显示,海兰褐父母代种公鸡及AA+父母代肉种公鸡原精液、稀释倍数为1:1~10的精液,400倍显微镜下难以看清楚精子形态,原精液与生理盐水按1:50、1:100稀释倍数的稀释精液,镜检精子形态清晰便于观察,精液在玻璃和塑料两种材质的集精管中进行稀释后立即镜检,精子畸形率无显著差异。
4 小结
本试验结果表明,海兰褐父母代种公鸡和AA+父母代种公鸡进行精液品质检查的适宜稀释倍数为原精液:稀释液≥1:50;采用玻璃及塑料材质的集精管短期保存精液,精子活力和畸形率无显著差异。
[1] 朱利琴, 刘璐, 贺长青等. 分光光度计和手持精子密度仪测定鸡精子密度的比较[J]. 中国家禽, 2017, 39(23): 60-63.
[2] 李维, 龚俞, 李雪松等. 长期闲置对种公鸡精液品质与体型指数的影响[J]. 现代农业科技, 2018(10): 243+245.
[3] 陆金春, 岳茹倩, 冯瑞祥等. 精子计数池深度对精子活力影响的实验研究[J]. 中华男科学杂志, 2013, 19(9): 776-779.
[4] 王坤, 蒋隽, 易康乐等. 精子质量检测系统在鸡精子密度测定中的应用[J]. 黑龙江畜牧兽医, 2015(15): 106-108.
[5] 陈建平, 俞亚波, 顾玉萍. 提高鸡人工授精率的关键技术[J]. 湖北畜牧兽医, 2012(1): 22-24.
[6] 杨宁. 家禽生产学[M]. 北京: 中国农业出版社, 2002: 142-146.
[7] 池春梅, 蔡雅端. 蛋用种公鸡的精液品质及生理盐水稀释的效果观察[J]. 福建畜牧兽医, 2002(6): 40.
[8] 满都拉. 精液稀释倍数对精子活力及母羊受胎率的影响[J]. 当代畜牧, 2014(8): 65-66.
[9] 祝盘大. 精液稀释倍数对精子活力及母羊受胎率的影响[J]. 新疆农业科学, 1981(5): 39-40.
[10] 彭秀丽, 邓干臻, 范小浪. 公鸡精液不同稀释剂及稀释倍数对鸡蛋受精率的影响[J]. 华中农业大学学报, 2001(4): 372-373.
[11] 宋卫涛, 李慧芳, 徐文娟等. 苏邮1号蛋鸭精液品质评估[J]. 家畜生态学报, 2017, 38(5): 49-53.
(2019–03–29)
青岛农业大学创新立项(201710435011);山东省家禽产业创新团队建设项目(SDAIT-11-14)
S831.3
A
1007-1733(2019)08-0008-03

