垂体转移瘤的临床特点及治疗分析:2例病例报道及文献回顾
蔡恒,刘文静,冯天达,刘云会
(中国医科大学 1.附属盛京医院神经外科,沈阳 110004;2.附属第一医院干诊神经内科,沈阳 110001)
垂体转移瘤在临床上罕见,发病率仅占鞍区肿瘤的1.0%~3.6%[1],是指颅外肿瘤转移到垂体区域的一类肿瘤,常见的部位涵盖蝶鞍区和鞍上区,包括垂体实质组织、垂体柄、鞍隔膜以及周围硬脑膜、蛛网膜等结构。垂体转移瘤原发病灶组织类型多为乳腺癌、肺癌、肾细胞癌、前列腺癌等[2]。由于垂体转移瘤在临床症状以及影像学表现与常见的垂体腺瘤无显著差别,故临床诊断困难,治疗不规范。本文通过回顾性分析中国医科大学附属盛京医院神经外科2014年和2017年收治的2例垂体转移瘤患者的临床资料,探讨垂体转移瘤的临床特点以及治疗策略。
1 临床资料
1.1 病例1
患者,女,57岁,以“视物模糊1年、阵发性头痛1个月”入院。患者乳腺癌根治术后16年,经过完整、规范的放化疗。 1年前无明显诱因出现视物模糊,无头晕及恶心呕吐,患者未在意,未到医院做进一步检查治疗。1个月前患者自觉头痛,表现为阵发性,清晨时症状加重,口服止痛药物缓解。眼科检查发现有视野缺损,双颞侧偏盲。内分泌功能检查发现高泌乳素血症(表1)。垂体MRI成像(图1)显示:垂体左侧可见小圆形长T1信号结节,直径约7 mm,增强扫描可见弱强化改变,垂体柄显示良好,视交叉轻度受压。
通过神经内镜辅助下经单鼻孔-蝶窦入路成功完成肿瘤全切除。在手术过程中,肿瘤外观粉白色,质较韧,血供丰富,边界不清,与鞍底硬膜、垂体柄粘连紧,仔细分离后全切肿瘤组织。组织病理学分析(图2)显示,瘤细胞巢片状,大小一致。免疫组织化学证实乳腺癌相关标志物ER(+)、PR(+)、GCDFP-15(+);肿瘤增殖指标Ki-67(+20%)提示肿瘤高度增殖活性;CK(+)提示肿瘤为上皮来源;CgA(-)和Syn(局灶+)提示非神经内分泌肿瘤。
术后患者视野缺损较术前明显改善,内分泌功能检查发现血泌乳素较术前显著下降。术后随访1年,患者行垂体MRI增强扫描(图1)复查,未见肿瘤复发。
1.2 病例2
患者,男,53岁,以“头痛伴头晕1个月,右眼睑上抬不能4 d”入院。患者既往无肿瘤病史,于1个月前无明显诱因出现头痛,右额部剧烈持续胀痛,伴头晕、恶心、呕吐,呕吐物为胃内容物,呕吐非喷射性。夜间疼痛加剧,自服止痛药,头痛及恶心较前未见明显好转。20 d前出现视物重影,4 d前无明显诱因出现右眼睑不能上抬。眼科检查发现视野缺损,双颞侧偏盲,视力下降。内分泌功能检查发现高泌乳素血症,生长激素高于正常(表1)。垂体MRI成像(图3)显示:蝶鞍凹陷,鞍区软组织肿块影,呈等T1信号改变,垂体受压,垂体柄向左移,视交叉未见异常,病灶侵及海绵窦,包绕双侧颈内动脉,累及斜坡,斜坡骨质破坏。增强扫描肿块明显较均匀强化。另外左侧颞极脑外可见等T1信号肿块影,宽基底与脑膜相连,大小约为2.7 cm×2.0 cm,信号欠均匀,增强可见明显不均匀强化,其内可见弱强化灶,邻近脑膜强化。

表1 2例患者垂体相关激素指标

图1 病例1术前和术后鞍区MRI增强扫描结果

图2 2例患者手术切除肿物HE染色结果 ×100
采用左侧翼点入路大脑开颅,成功完成肿瘤全切除。在手术过程中,肿瘤外观粉红色,质软,血供丰富,其内可见陈旧凝血块。肿瘤边界不清,与鞍底硬膜、垂体柄粘连紧,仔细分离后全切肿瘤组织。随后切除左侧颞极硬膜外肿瘤组织,病变形态与垂体肿物一致。组织病理学分析(图2)显示,瘤细胞巢片状,细胞异型明显。免疫组织化学证实肝细胞癌标志物Hepatocyte(+),AFP(+),CEA(局 灶+);Syn(-)、GFAP(-)提示非神经内分泌肿瘤;其余标志物:CK(+),EMA(-),Vimentin(-),PSA(-)。肝脏超声提示:右叶见6.5 cm×5.7 cm实体性肿物,边界模糊,内呈不均质略高回声。右叶另见多发小结节,内呈略高回声。肝脏增强CT提示肝S8段占位,考虑肝癌伴坏死,周围多发卫星灶,肝右静脉受侵。
术后患者转入肿瘤科行进一步治疗。随访6个月,患者因肿瘤多发转移、恶病质等肿瘤并发症死亡。
2 结果
本组病例1原发病灶在乳腺,乳腺癌根治术后16年,规范进行放化疗,无其他部位转移;本次全切肿瘤,术后患者临床症状显著缓解;随访1年,患者无症状存活。病例2原发病灶在肝脏,属于肿瘤晚期,多发转移;本次由于病变病灶侵及海绵窦、双侧颈内动脉等颅内重要结构,肿瘤近全切除,患者术后出现一过性尿崩;术后根据病理结果对患者行放疗和化疗,但患者很快出现晚期肿瘤并发症;随访6个月,患者死亡。
3 讨论
颅内转移是肿瘤转移的途径之一,但恶性肿瘤转移到蝶鞍区和鞍上区非常罕见。目前报道的病例大多为尸检标本,临床诊断标本非常罕见。其原因一是可能由于垂体转移往往提示肿瘤多发转移,患者已进入终末阶段,随访缺失;二是垂体转移瘤在影像学和临床症状上与垂体良性肿瘤难以鉴别,易误诊。
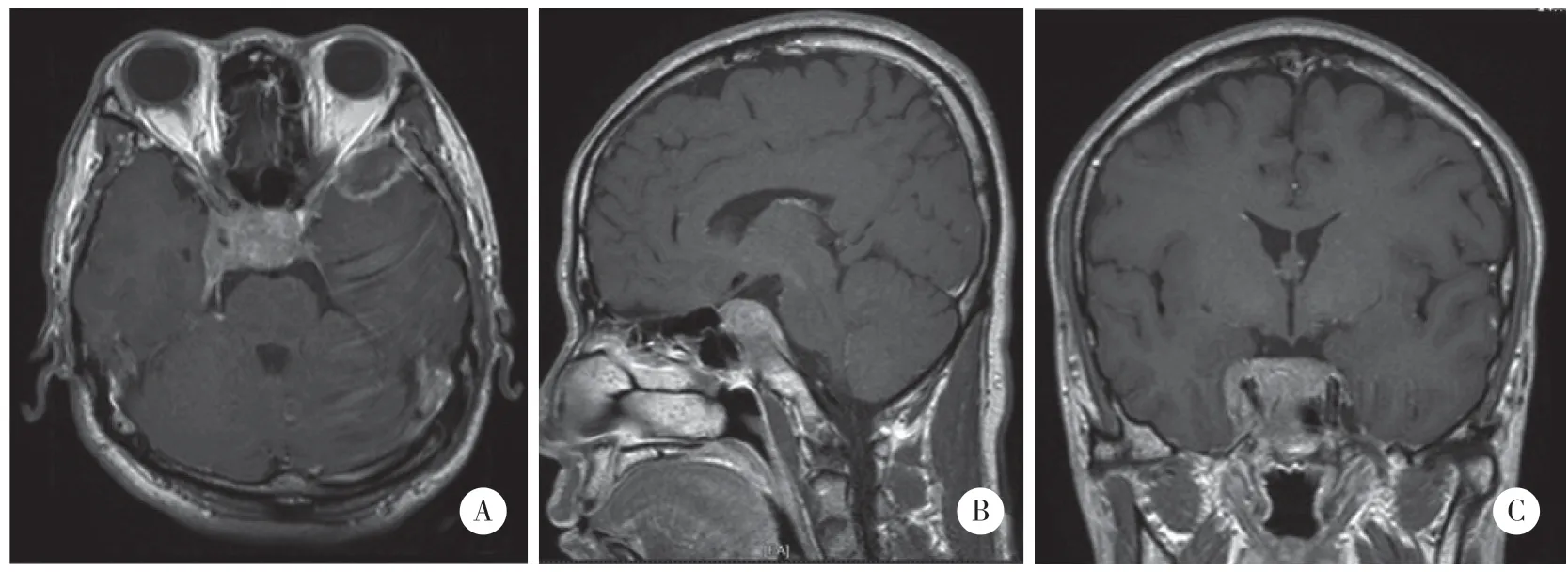
图3 病例2术前鞍区MRI增强扫描结果
1857年BENJAMIN首次在尸检病例中报道了1例黑色素瘤的垂体转移[3]。关于垂体转移瘤的原发肿瘤部位,目前报道的有乳腺癌[2]、肺小细胞癌[4]、肾细胞癌[5-6]、各类甲状腺癌[7-8]、肝细胞癌[9]等。其中乳腺癌和肺癌的垂体转移最常见[10]。在21世纪之前,共报道垂体转移瘤临床诊断病例30例[3,11-12]。随着诊断水平的提升和神经内镜技术的应用,国内外报道的垂体转移瘤病例在近10年明显增多。
笔者在PubMed上检索2008年1月至2018年8月报道的垂体转移瘤病例。采用关键词“垂体转移瘤”检索到118篇参考文献(除外综述、系统评价、数据分析类文献)。排除69篇来自动物研究或原发性垂体肿瘤的研究,本文对49篇文献进行文献复习。这些文献共报道78例完整的临床诊断病例。本文报道了1例乳腺癌垂体转移临床诊断病例(病例1)和1例肝细胞癌垂体转移临床诊断病例(病例2)。乳腺癌垂体转移瘤一般多伴发全身其他部位的多发转移,见于浸润性乳腺癌姑息治疗的患者,或者已发生全身转移的浸润性乳腺癌患者。但本组病例1在乳腺癌根治术后经过完整而规范的放化疗,随访16年才出现垂体转移,较为罕见;病例2由于属于晚期,伴多发转移,术后生存期6个月。以上结果提示恶性肿瘤规范治疗和随访的重要性。
垂体转移瘤患者很多临床无明显症状,最常见尿崩症,多由于肿瘤侵及垂体柄所致。垂体后叶由垂体门脉系统直接供血,而且垂体后叶与颅底硬膜接触广泛,故转移瘤常常侵袭垂体后叶和垂体柄。本组病例2出现的尿崩症也是一个显著的临床症状,这也提示转移瘤出现的经过血行转移至垂体后叶,是垂体转移的主要途径。其他主要临床症状包括视力下降和视野缺损、颅高压症状(包括头痛、恶心和呕吐)、垂体功能减退或紊乱、颅神经麻痹等。视力下降和视野缺损是由于肿瘤压迫视神经或视交叉所致,大多数转移瘤累及垂体后叶,由于其快速增长,导致头痛症状较良性垂体腺瘤患者常见。本组病例2表现为动眼神经麻痹,可能继发于肿瘤对海绵窦的侵入或继发于三脑室压迫引起的脑积水,进而引起对动眼神经的压迫。垂体转移瘤患者垂体相关激素水平多在正常范围。而本组2例患者都出现垂体功能紊乱,病例1表现为高泌乳素血症,病例2表现为生长激素高于正常。这些临床症状和化验指标容易误导医生诊断为常见的功能性垂体腺瘤,这也是垂体转移瘤的诊断难点之一。
关于乳腺癌垂体转移的临床诊断,需要结合患者病史以及分子病理诊断结果。原发肿瘤标志物是术后免疫组化的重点监测指标,如乳腺癌相关标志物ER(+)、PR(+)、GCDFP-15(+),肝细胞癌相关标记物AFP等。另外,肿瘤增殖指标Ki-67(+20%)提示肿瘤高度增殖活性和低分化原发肿瘤,也是反映患者预后的一个独立指标;CK(+)示肿瘤为上皮来源;CgA和Syn往往阴性,提示非神经内分泌肿瘤,往往用于排除垂体原发肿瘤诊断。
垂体转移瘤的治疗以外科手术治疗为主,结合立体定向放疗和化疗。通常垂体转移患者体内肿瘤已广泛转移,多见多个部位转移,尤其是骨转移[13]。本组病例2多发转移,包括骨、肺、肝和淋巴结等。很多患者一般情况差,往往选择姑息治疗,但外科手术全切肿瘤是良好预后的必需条件。由于垂体转移患者往往属于终末期患者,随访资料缺乏。BRANCH等[14]报道14例垂体转移瘤患者,平均生存时间为22个月。本组2例患者均进行随访,1例目前无病生存,1例随访6个月后死亡。
综上所述,垂体转移癌是颅内罕见病变,影像学表现多变且无典型特征,应结合患者病史、临床表现、分子病理学结果、术前其他系统筛查等综合分析,并请多学科会诊,以最大限度降低误诊率。同时应强调恶性肿瘤术后随访的重要性,以及肿瘤的个体化治疗。

