酶解法提取紫薯原花青素工艺优化
韩卓,李慧,马龙
(蚌埠学院 食品与生物工程学院,安徽 蚌埠 233030)
紫薯,又叫黑薯、紫心甘薯等,于20世纪90年代从日本引进[1],肉质呈紫色至深紫色。紫薯中含有的人体必需的赖氨酸和矿物质元素铜、锰、锌等含量较普通的甘薯高3~8倍,而硒元素含量高达20倍左右[2]。除含有普通甘薯所含的多糖、氨基酸、维生素等营养成分外,还富含原花青素、黄酮等生物活性成分,营养价值远高于普通甘薯,具有预防高血压、减轻肝机能障碍、预防心血管疾病、清除人体自由基、抗癌等多种保健功能[3-8]。目前对于紫薯的利用仍以鲜食为主,对紫薯生物活性成分的研究和深加工报道并不多。
原花青素(proanthocyanidins,PC) 是一种有着特殊结构的生物类黄酮混合物,主要存在于偏红色或紫色的植物中,是一种强效的天然自由基清除剂[9],广泛应用于食品、药品、保健品等领域。作为食品调料,广泛添加于饮料、酒等食品中,不仅具有防腐抑菌的功效,还可提升食品的营养保健功能[10]。目前市售的商品原花青素基本来源于葡萄籽提取物,而葡萄籽原花青素的稳定性相对较差。因此,本研究以紫薯块根为原料,采用酶解法提取再经响应面法进行优化,期望对紫薯原花青素的开发利用提供一定的参考价值。
1 材料与方法
1.1 材料与试剂
紫薯:市售,低温烘干后粉碎备用。
无水乙醇(分析纯):安徽安特食品股份有限公司;柠檬酸、盐酸(分析纯):国药集团化学试剂有限公司;氢氧化钠(分析纯):天津市永大化学试剂有限公司;正丁醇、甲醇(分析纯):天津市大茂化学试剂厂;硫酸铁氨(分析纯):上海展云化工有限公司;原花青素标准品(HPLC≥95%):上海金穗生物科技有限公司;纤维素酶(10000 U/g):上海原生态生物科技有限公司;中性蛋白酶(100000 U/g):上海凯尔生物科技有限公司;α-淀粉酶(40000 U/g):索莱宝公司。
1.2 仪器与设备
722可见分光光度计 上海菁华科技仪器有限公司;XFB-200高速中药粉碎机 吉首市中诚制药机械厂;电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;FA-14电子天平 上海海康电子仪器厂;PHS-25型酸度计 上海宵盛仪器制造有限公司;KQ-300E型超声波清洗器 昆山市超声仪器有限公司;H4-20KR离心机 湖南可成仪器设备有限公司。
1.3 试验方法
1.3.1 原花青素标准曲线的制作[11]
配制0.2 mg/mL的原花青素标准溶液,吸取0,2,4,6,8,10 mL分别置于10 mL容量瓶中,加甲醇稀释成浓度分别为0,0.02,0.04,0.06,0.08,0.10,0.12,0.14 mg/mL。吸取每个容量瓶中的溶液1~10 mL具塞试管中加入0.2 mL的2%硫酸铁氨溶液、6 mL的盐酸-正丁醇溶液,摇匀,放置沸水中水浴30 min,取出放入冷水中冷却10 min。然后用紫外分光光度计在546 nm处测其吸光度,以原花青素质量浓度(x)为横坐标,对应检测的吸光度值(y)为纵坐标,绘制原花青素标准曲线。
1.3.2 原花青素的提取工艺流程
新鲜的紫薯清洗切片,烘干粉碎过筛,准确称量1 g紫薯粉于锥形瓶中,加入一定体积纯水,加入一定量的酶,加柠檬酸调节pH后,置于超声波清洗机中提取功率400 W、一定温度下酶解提取一定时间,提取液4000 r/min离心15 min,滤液经旋转蒸发仪低温减压浓缩[12],用甲醇定容至25 mL,即得到样品提取液。
根据原花青素标准曲线回归方程计算出样品提取液中的原花青素浓度,计算原花青素的提取率,计算公式如下:
式中:C为紫薯花青素质量浓度,mg/mL;V为溶液体积,mL;M为样品质量,g;P为原花青素提取率。
1.3.3 单因素试验
分别考察不同酶种类(纤维素酶、α-淀粉酶、中性蛋白酶)及浓度(50,100,150,200,250 μg/mL)、酶解温度(25,35,45,55,65 ℃)、酶解时间(20,35,50,65,80 min)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、pH(4,5,6,7,8)对紫薯中原花青素提取率的影响。
在单因素试验结果分析基础上,基于Box-Behnken设计的响应曲面法对紫薯中原花青素提取工艺进行优化,选取3个因子pH(C)、酶解时间(A)、酶解温度(B)为自变量,以原花青素提取率(Y)为响应面值,并以1,0,-1分别代表自变量的高、中、低水平,响应面试验设计因素与水平见表1。

表1 响应面因子与水平表Table 1 Factors and levels of response surface methodology
2 结果与分析
2.1 原花青素标准曲线的绘制
以原花青素质量浓度(x)为横坐标,对应检测的吸光度值(y)为纵坐标,绘制原花青素标准曲线,结果见图1。

图1 原花青素含量标准曲线Fig.1 Standard curve of procyanidians content
由图1可知,原花青素标准曲线回归方程为y=3.4196x-0.0005,相关系数R2=0.9996,表明原花青素质量浓度在0~0.04 mg/mL范围内呈良好的线性关系。
2.2 单因素试验结果分析
2.2.1 不同酶类及用量对提取率的影响
不同酶类及用量对提取率的影响结果见图2。
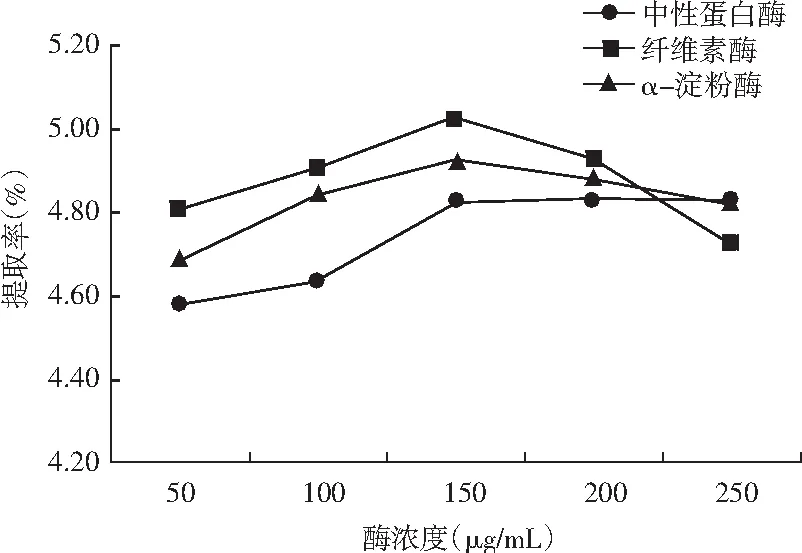
图2 不同酶类及用量对提取率的影响Fig.2 Effect of different enzyme types and dosage on extraction rate
由图2可知,3种酶类对紫薯原花青素提取率r 影响为纤维素酶>α-淀粉酶>中性蛋白酶,中性蛋白酶对原花青素提取率的影响最小,这与紫薯所含蛋白质成分较少有关,纤维素酶对原花青素提取率的影响最大,这是因为纤维素酶能够酶解植物细胞壁,有利于细胞内容物的溶出。随着纤维素酶浓度的增加,原花青素提取率也逐渐增大,当纤维素酶添加量达到150 μg/mL时,提取率达到5.025%,加酶量继续增加时原花青素提取率呈现下降趋势,表明紫薯细胞壁中纤维素酶酶解完全,过多的酶量反而会影响原花青素的溶出,故选择纤维素酶浓度为150 μg/mL做进一步优化。
2.2.2 酶解温度对提取率的影响
酶解温度对提取率的影响结果见图3。

图3 酶解温度对提取率的影响Fig.3 Effect of enzymatic hydrolysis temperature on extraction rate
由图3可知,酶解温度在30~40 ℃范围时,紫薯原花青素提取率随温度升高而呈上升趋势,当酶解温度达40 ℃时,提取率为5.035%;温度继续升高时提取率呈现下降趋势,可能是由于温度过高会影响酶的活性,此外原花青素热稳定性较差,导致提取率下降,故选择40 ℃做进一步优化。
2.2.3 酶解时间对提取率的影响
酶解时间对提取率的影响结果见图4。

图4 酶解时间对提取率的影响Fig.4 Effect of enzymatic hydrolysis time on extraction rate
由图4可知,酶解时间在20~65 min范围时,紫薯原花青素提取率随时间延长而呈上升趋势,当酶解时间达65 min时,提取率为5.027%;随着时间继续增加,提取率趋于稳定,说明紫薯细胞壁基本酶解完全,原花青素有效溶出,故选择65 min做进一步优化。
2.2.4 料液比对提取率的影响
料液比对提取率的影响结果见图5。
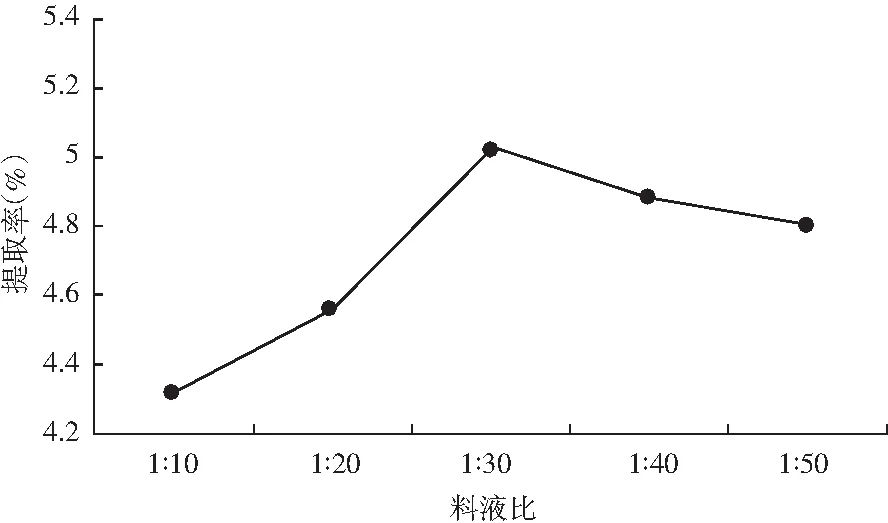
图5 料液比对提取率的影响Fig.5 Effect of ratio of solid to liquid on extraction rate
由图5可知,料液比在1∶10~1∶30范围时,紫薯原花青素提取率随料液比增加而升高,当料液比达到1∶30时,提取率达5.019%;随着料液比的增加,提取率呈现下降趋势,可能是因为当提取剂量过多时,反而会影响酶的催化作用,故选择1∶30做进一步优化。
2.2.5 pH对提取率的影响
pH对提取率的影响结果见图6。
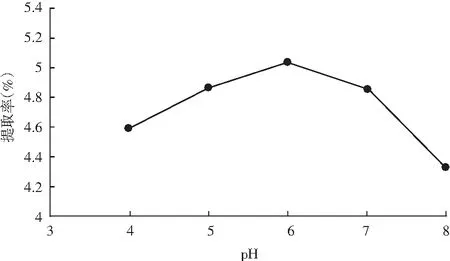
图6 pH对提取率的影响Fig.6 Effect of pH on extraction rate
由图6可知,pH在4~6范围时,紫薯原花青素随着pH增加而升高,当pH为6时,提取率达5.031%;随着pH增加,提取率呈现下降趋势,可能是因为过高的pH影响了纤维素酶的活性,使得细胞壁酶解不完全,导致提取率下降,故选择pH为6做进一步优化。
2.3 响应面试验结果
2.3.1 响应面试验设计因素水平和结果
响应面试验设计因素水平和结果见表2。
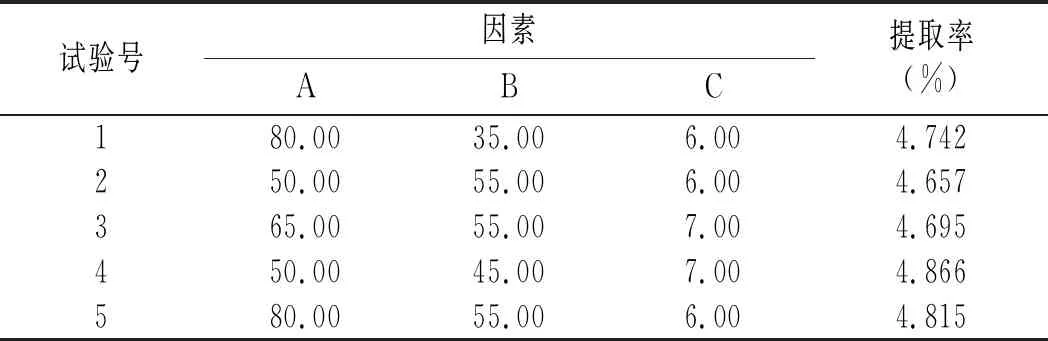
表2 响应面试验设计因素水平及结果Table 2 Factors and levels and results of response surface experimental design

续 表
通过Design-Expert 10.0.7软件对表2数据进行二次多项式拟合,得到原花青素提取率与酶解时间(A)、酶解温度(B)、pH(C)的二次多项回归方程:
Y=-4.45134+0.041727A+0.17658B+1.36348C+4.05000E-004AB-8.66667E-004AC-7.12500E-003BC-4.08667E-004A2-1.82200E-003B2-0.079450C2。
2.3.2 模型建立与方差分析
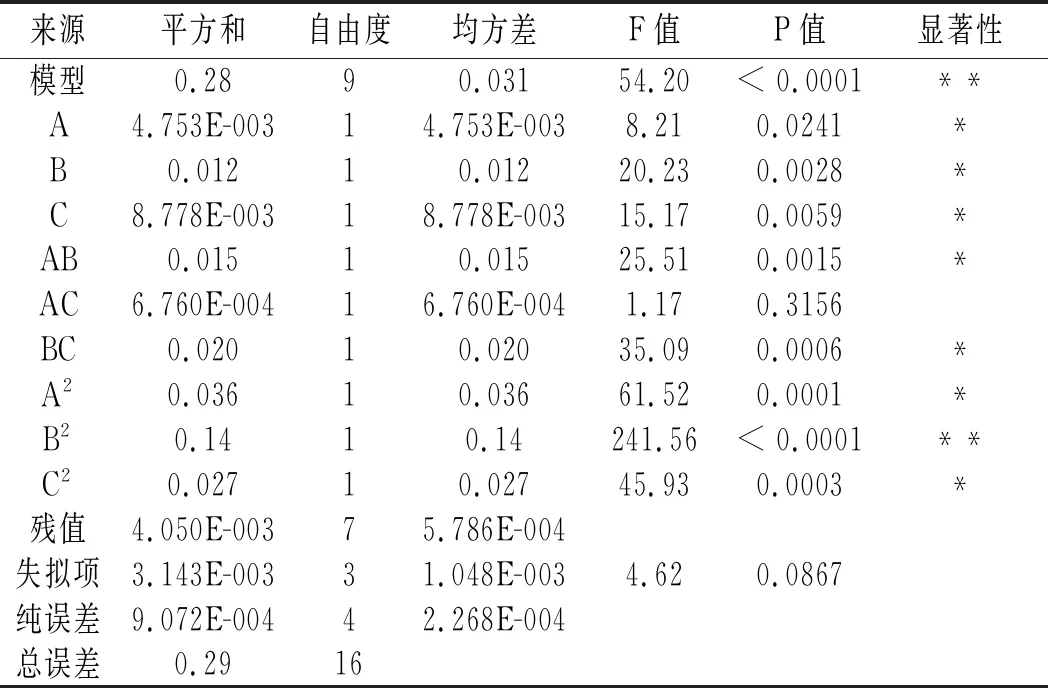
表3 回归模型方差分析Table 3 Variance analysis of regression model
注: “*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.0001)。
表3回归模型和方差分析结果显示,因素A、B、C、AB、BC、A2、C2对紫薯原花青素提取率的影响达到显著水平(P<0.005),因素B2对紫薯原花青素提取率的影响极显著(P<0.0001)。模型F值为54.20,P<0.0001,失拟项P值为0.0867>0.05,表明该模型显著性极高,失拟项不显著,说明预估值和实测值之间拟合度较好。模型的相关系数R2=0.9857、校正确定系数RAdj2=0.9677,表明该模型能够解释96.77%响应值的变化,因此该模型可用于对紫薯原花青素提取率的分析和预测。根据F值大小判定,3个因素对响应值影响的顺序为B(酶解温度)>C(pH)>A(酶解时间)。
2.3.3 响应面分析与优化
根据上述回归方程绘制响应面及等高线图,分析酶解温度、酶解时间和pH 3个因素对紫薯原花青素提取率的影响,响应面及等高线见图7。
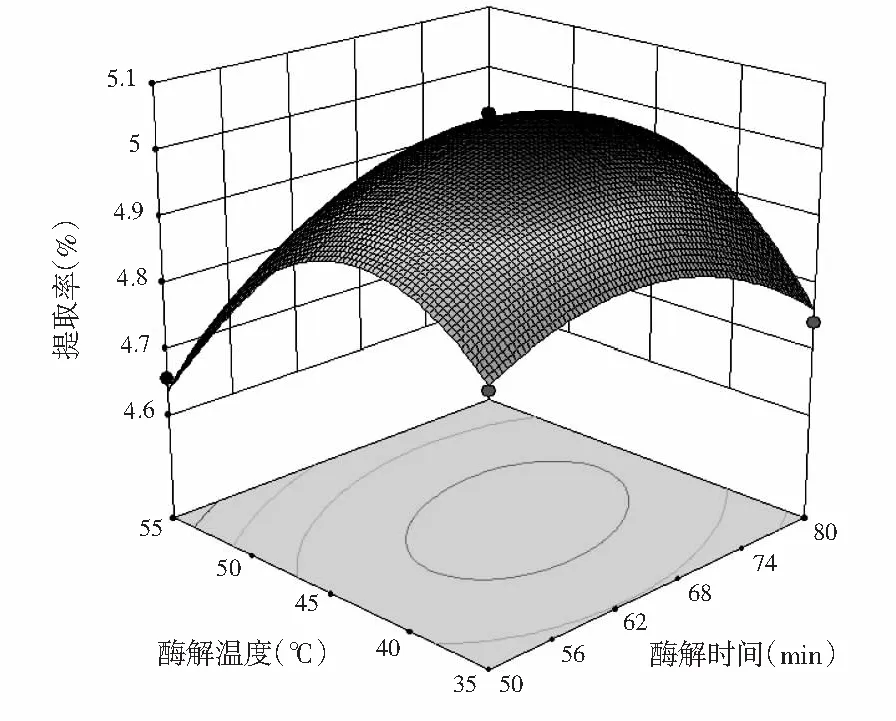
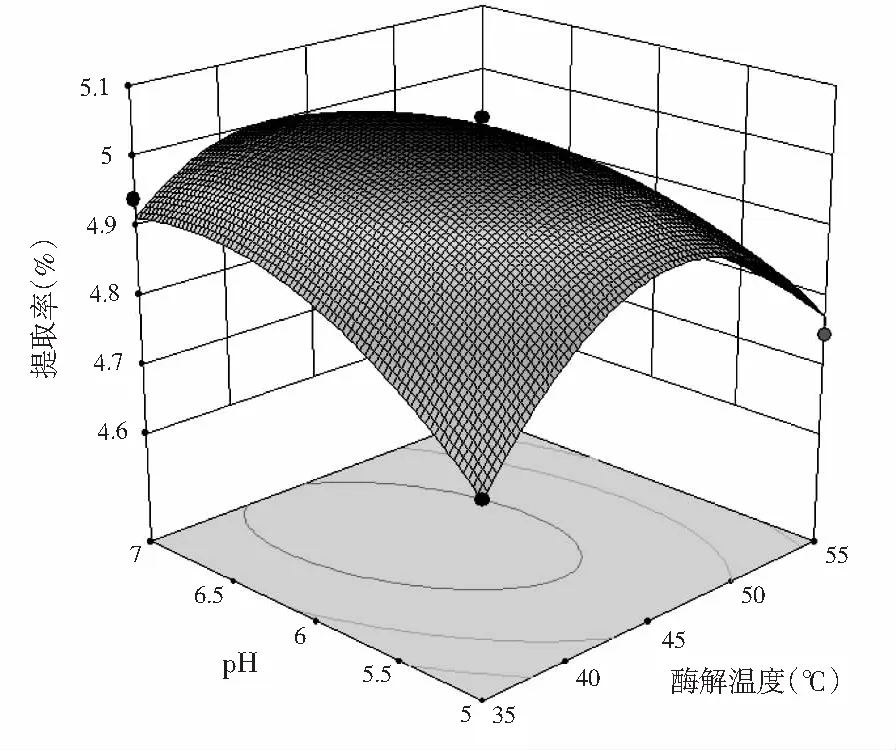

图7 酶解温度、酶解时间和pH交互作用对提取率影响的响应曲面图Fig.7 Response surface plots of the effects of interaction between enzymatic hydrolysis temperature, enzymatic hydrolysis time and pH on extraction rate of proanthocyanidins
由图7可知,酶解温度和pH对应的响应曲面陡峭,说明两者交互作用较强;酶解时间和pH对应的响应曲面较为平缓,说明这两因素交互作用较弱,这与表3显著性分析结果一致。在酶解温度和pH对应等高线图中,等高线沿酶解温度降低方向密集,增高方向稀疏,说明降低温度会显著影响紫薯原花青素的提取率。
2.3.4 验证试验结果
在单因素试验的基础上,采用响应面软件Design-Expert 10.0.7进行优化,最佳提取工艺条件为酶解时间65.957 min、酶解温度43.538 ℃、pH 6.269。根据实际操作情况做相应调整,确定最佳提取工艺条件为:酶解时间65 min、酶解温度43 ℃、pH 6.2,在此条件下进行验证,实际提取率为5.039%,与预测值接近,说明该模型建立可靠,可用于对紫薯原花青素提取条件的优化。
3 结论
本研究采用酶解法提取紫薯原花青素,纤维素酶的加入有利于紫薯细胞壁的破碎,促进胞内原花青素的溶出。在单因素试验结果基础上,通过Box-Behnken中心试验设计原理,以提取率为响应值,建立紫薯原花青素提取率的二次回归模型,确定最佳工艺条件为酶解时间65 min、酶解温度43 ℃、pH 6.2,在此条件下进行验证测得原花青素提取率为5.039%,与预测值接近,说明采用此工艺条件参数可靠,适合于提取紫薯中原花青素的工业化生产。

