双孢蘑菇蛋白的提取工艺优化及其功能性质
郑新雷,李灵诚,滕建文,韦保耀,黄 丽,夏 宁,覃柳迪
(广西大学轻工与食品工程学院,广西南宁 530004)
食用菌是一类营养丰富,可供人类食用的大型真菌的总称。双孢蘑菇(Agaricusbisporus)属伞菌科蘑菇属,是食用菌中的大宗品种,别名白蘑菇、圆蘑菇、西洋蘑菇,是一种在全球都广泛栽培的食用菌,产量占食用菌总量的70%[1]。我国双孢蘑菇主要用作鲜食,精深加工产品较少[2]。因此,需要进一步开发双孢蘑菇精深加工系列产品,开拓双孢蘑菇产品市场。
目前对双孢蘑菇的研究主要集中在双孢蘑菇的褐变抑制和多糖的活性研究上,大量的药理和临床研究表明双孢蘑菇多糖具有抗氧化、免疫调节、抗肿瘤、抗癌、降血糖、降血脂等生物活性[3-5]。但对蛋白的研究却较少。而双孢蘑菇干物质中蛋白含量约为32.88%~37.86%,其中含有大量具有生物活性的蛋白和肽类物质等[6-7]。而目前对双孢蘑菇蛋白的研究中,主要侧重于蛋白的提取与营养活性的研究[8]。双孢蘑菇蛋白提取方法有碱溶酸沉法、酶法、物理法。综合比较,酶法和物理法提取得到的双孢蘑菇中蛋白的回收率与纯度均较低[9]。在前人的研究基础上发现双孢蘑菇蛋白具有一定的抗氧化活性、抗菌性[9-10]。但是对双孢蘑菇蛋白功能性质缺乏研究。
因此,本研究以双孢蘑菇为原料,采用传统的碱溶酸沉方法提取双孢蘑菇蛋白,采用响应面法优化蛋白提取条件,并进行蛋白的氨基酸组成分析,得到具有较高营养价值的双孢蘑菇蛋白制品,同时对双孢蘑菇蛋白的功能性质进行了初步研究,为工业制备双孢蘑菇蛋白制品及其应用提供初步的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜双孢蘑菇(Agaricusbisporus) 购于南宁五里亭批发市场;MD44透析袋(8000~14000 Da)、牛血清白蛋白、Folin-Phenol 购于北京索莱宝科技有限公司;盐酸、氢氧化钠、乙醇、磷酸、碳酸钠、苯酚、硫酸、硫酸铜、硫酸钾、磷酸二氢钾、磷酸氢二钾 均为分析纯,国药集团化学试剂有限公司。
Beta 1-8Lsc plus真空冷冻干燥机 德国CHRIST仪器有限公司;EL20数显pH计 梅特勒-托利多仪器有限公司;TLE204E/02分析天平 梅特勒-托利多仪器有限公司;S25磁力搅拌机 德国 IKA 公司;UV-1601紫外可见分光光度计 日本岛津公司;ST16R高速冷冻离心机 美国热电公司;SKD-600凯氏定氮仪 上海沛欧分析仪器有限公司;L-8900高速氨基酸分析仪 日本HITACHI公司;T25高速均质机 德国IKA公司。
1.2 实验方法
1.2.1 双孢蘑菇蛋白的制备 将新鲜双孢蘑菇进行褐变抑制处理。每次取5 kg置于密闭空间中,燃烧3 g硫磺,熏蒸30 min,熏蒸完毕后置于阴凉处放置2~3 h以清除果实周边多余的SO2气体[11]。将双孢蘑菇与蒸馏水按照一定的料液比(W/V)进行打浆,利用2 mol/L NaOH或者2 mol/L HCl调节至一定的pH,在一定的温度下提取一定的时间。提取完成后,4 ℃、8000 r/min离心20 min后得到上清液和不溶物。上清液用2 mol/L的HCl调节pH为4.3,4 ℃静置一夜,8000 r/min离心20 min,用去离子水洗沉淀3次,接着用2 mol/L NaOH调节pH至7.0,使其充分溶解后,用去离子水在4 ℃下用透析袋透析24 h,冷冻干燥得到双孢蘑菇蛋白[12]。
1.2.2 单因素实验 采用1.2.1的方法提取双孢蘑菇蛋白,以双孢蘑菇蛋白的提取率为考察指标,分别对料液比(W/V)、pH、提取温度、提取时间4个影响提取率的因素进行考察。固定提取温度30 ℃,提取时间2.0 h,提取液pH10.0,考察不同料液比(W/V)(1∶1、1∶2、1∶3、1∶4、1∶5、1∶6)对蛋白提取率的影响;固定料液比(W/V)1∶3,提取温度30 ℃,提取时间2.0 h,考察不同pH(5、6、7、8、9、10、11)对蛋白提取率的影响;固定料液比(W/V)1∶3,提取温度30 ℃,提取液pH10.0,考察不同提取时间(1.0、1.5、2.0、2.5、3.0、3.5、4.0 h)对蛋白提取率的影响;固定料液比(W/V)1∶3,提取液pH10.0,提取时间2.0 h,考察不同提取温度(20、30、40、50、60 ℃)对蛋白提取率的影响。
1.2.3 响应面设计 在单因素的基础上,以提取时间、提取温度、pH为实验因素,以双孢蘑菇蛋白提取率为响应值,采用响应面分析软件Design-Expert 8.05建立三因素三水平的Central Composite模型,通过试验确定最优提取工艺。变量因素编码及水平见表1。

表1 响应面试验因素水平设计
1.2.4 蛋白含量及纯度测定 原料中蛋白质及纯度测定采用国标GB 5009.5-2016中“凯氏定氮法”测定;提取得到的上清液中蛋白的测量方法Lowry法测定[13]。采用Lowry法测定上清液蛋白含量,其标准曲线为y=0.2552x+0.0847,其R2值为0.9994。

1.2.5 氨基酸分析 使用氨基酸分析仪进行氨基酸分析测定。取一定量最佳工艺条件下制备的蛋白样品加入8 mL 6 mol/L的HCl 溶液中,置于10 mL具塞消解管中,密封。在110 ℃鼓风干燥箱中消解22 h,每隔一段时间混匀一下水解液。将消解后的样品溶液过滤并定容至50 mL棕色容量瓶中。准确吸取1.0 mL滤液移入到15 mL试管内,蒸发浓缩干燥,干燥后残留物用1~2 mL水溶解,再继续干燥至最后蒸干。用1.0~2.0 mL pH2.2柠檬酸钠缓冲溶液加入到干燥后试管内溶解,振荡混匀后,吸取溶液通过0.22 μm滤膜后,转移至仪器进样瓶,为样品测定液,供仪器测定用[14]。
1.2.6 双孢蘑菇蛋白的功能性研究
1.2.6.1 不同pH下双孢蘑菇蛋白的溶解度测定 称取100 mg最佳工艺条件下制备的蛋白样品加入10 mL的去离子水中,室温下磁力搅拌30 min。在搅拌过程中用2 mol/L HCl与2 mol/L NaOH溶液分别调溶液pH为2.0、3.0、4.0、4.5、5.0、6.0、7.0、8.0、9.0、10.0、11.0。搅拌30 min后于10000 r/min离心30 min,以牛血清白蛋白(BSA)为标准物,采用Lowry法测定上清液中的蛋白含量[15],其标准曲线为y=0.2552x+0.0847,其R2值为0.9994。每个样品测定三次。
蛋白溶解度(%)=(上清液中的蛋白质量/样品蛋白质量)×100
1.2.6.2 双孢蘑菇蛋白的起泡性 配制1%(W/V)最佳工艺条件下制备的双孢蘑菇蛋白溶液100 mL,用均质机5000 r/min均质2 min,快速移至100 mL的量筒,记录泡沫所占的体积,记为V0;将量筒于30 ℃水浴锅30 min,记录泡沫的残留体积(Vr)。同时以大豆分离蛋白做对照。V0用以评估蛋白溶液起泡能力大小,V0与Vr可用于计算泡沫稳定性[16]。
发泡能力(%)=(V0/V)×100
泡沫稳定性(%)=(Vr/V0)×100
其中,V:蛋白溶液的初始体积,本实验为100 mL。
1.2.6.3 双孢蘑菇蛋白的持水性 配制20 mL 1%(W/V)的最佳工艺条件下制备的双孢蘑菇蛋白溶液,吸取5 mL溶液,移入已称重的10 mL离心管中,5000 r/min离心30 min,小心地除去上清液,称量此时离心管的质量[17]。同时以大豆分离蛋白做对照。按以下公式计算出双孢蘑菇蛋白的持水能力(WHC):
WHC(%)=(m2-m1)/m×100
其中,m1:离心管的质量,g;m2:去除上清液后离心管的质量,g;m:离心管中蛋白的质量,g。
1.2.6.4 双孢蘑菇蛋白的持油性 称取0.5 g最佳工艺条件下制备的双孢蘑菇蛋白,加入5 mL食用油,混合均匀后,5000 r/min离心30 min,小心地除去上层油,称量此时离心管的质量[18]。同时以大豆分离蛋白做对照。按以下公式计算出双孢蘑菇蛋白的持油能力(OHC):
OHC(%)=(m2-m1)/m×100
其中,m1:离心管的质量,g;m2:去除上层油后离心管的质量,g;m:离心管中蛋白的质量,g。
1.2.6.5 双孢蘑菇蛋白的乳性与乳化稳定性测定 配制0.2 mol/L磷酸盐缓冲液,调节其pH为7.0,取一定量最佳工艺条件下制备的蛋白样品配制成质量浓度为0.1 g/L的蛋白溶液,将色拉油与待测溶液1∶1混合后于均质机中10000 r/min均质1 min,立即用微量取样器从底部取50 μL,用质量浓度为0.1 g/L SDS的相同缓冲液稀释成5 mL,混合后立即用分光光度计以0.1 g/L SDS为对照,在500 nm波长下测定吸光值A0。10 min后再取50 μL,用含0.1 g/L SDS的相同缓冲液稀释成5 mL,摇匀后立即用紫外分光光度计在500 nm波长下测定吸光值A10。同时以大豆分离蛋白做对照[19-20]。
其中,T=2.303;C:乳化液形成前蛋白水溶液中蛋白浓度(g/mL);ψ:乳化液中油的体积分数;D:稀释倍数。
1.3 数据处理
所有实验均重复三次,采用IBM SPSS Statistics 20进行数据处理,Oringin 8.6软件作图,Design-Expert 8.0.6软件进行方差分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对双孢蘑菇蛋白提取率的影响 从图1可以看出,料液比的增加会提高双孢蘑菇蛋白的提取率,当料液比为1∶3时,提取率显著(p<0.05)增加到56.09%,随后蛋白提取率增加缓慢。这可能是由于双孢蘑菇中含有纤维等大分子物质,随着溶剂体积的增加,原来聚集并可能缠绕在一起的大分子吸水溶胀后逐渐展开,将包裹在内部的蛋白暴露出来,使得蛋白溶出,当料液比增加到一定比例,两相体系接触程度最大化,因此提取率变化趋于平缓[21]。所以从经济和实际考虑,选择提取双孢蘑菇蛋白的最佳料液比为1∶3。在响应面设计时不再考虑料液比的因素。
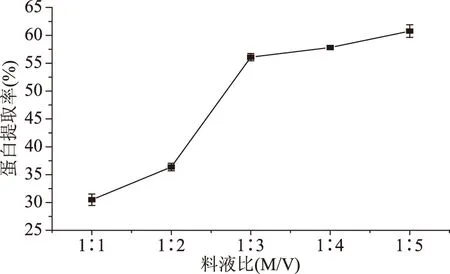
图1 料液比对双孢蘑菇蛋白提取率的影响
2.1.2 不同提取pH对双孢蘑菇蛋白提取率的影响 从图2可以看出,双孢蘑菇蛋白提取率先随着提取液pH的增加而增加,后趋于平缓并略有下降,在pH为10时,回收率最大为56.97%。一方面可能是因为随着pH的增加,使得蛋白分子间的氢键被打破,从而使得蛋白更好的溶出;另一方面可能是纤维的裂解导致蛋白溶出。但是碱性过强会使得蛋白变性,使得蛋白的溶解性下降,上清液中蛋白含量降低[12]。所以设定双孢蘑菇蛋白的最佳提取液pH为10.0。
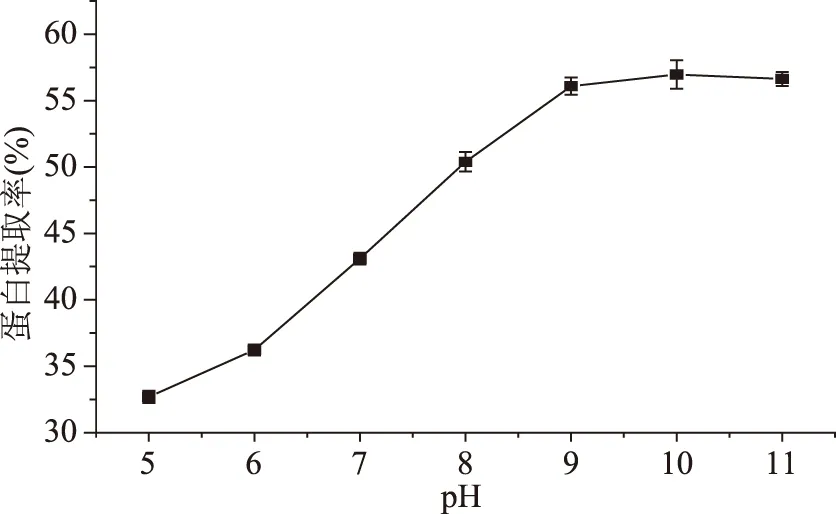
图2 pH对双孢蘑菇蛋白提取率的影响
2.1.3 提取时间对双孢蘑菇蛋白提取率的影响 从图3可以看出,随着提取时间的增加,双孢蘑菇蛋白的提取率先增加后减少,在提取时间为2.5 h时达到最大值56.21%。根据化学反应速度和化学平衡理论,蛋白在某种溶剂中的溶解过程并非离子化合物的电离,而是大分子化合物中某些基团与溶剂发生溶剂化作用而被逐渐溶胀、络合、分散、溶合,经历若干过程,速度缓慢,需要一定时间才能达到平衡状态[22]。因此提取时间过短,蛋白质从原料中溶解不完全。但随着提取时间的延长,蛋白质溶出量达到饱和,因此继续延长提取时间,蛋白提取率不再有明显的增加[23]。因此双孢蘑菇蛋白的最佳提取时间为2.5 h。
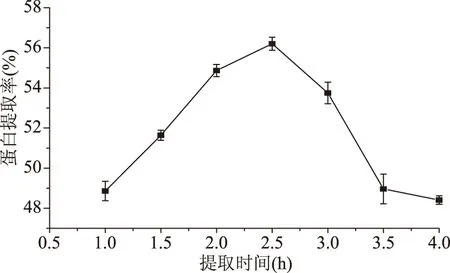
图3 提取时间对双孢蘑菇蛋白提取率的影响
2.1.4 提取温度对双孢蘑菇蛋白提取率的影响 从图4可以看出,随着提取温度的增加,双孢蘑菇蛋白的提取率先增大后减少,并在50 ℃时达到最大值58.10%。这可能是因为升高温度使蛋白分子空间构象改变,立体结构适当伸展,加强了水分子和蛋白分子之间的相互作用,蛋白溶解度增加,有利于蛋白的析出。而温度过高的话可能会导致蛋白的变性。升高温度,分子间运动加剧使维持蛋白空间构象和立体结构的弱作用力消失,一些非极性的基团暴露在分子表面,影响蛋白和水分子之间的相互作用,蛋白溶解度降低,从而导致提取率降低[24]。因此选择提取双孢蘑菇蛋白的最佳提取温度值为50 ℃。
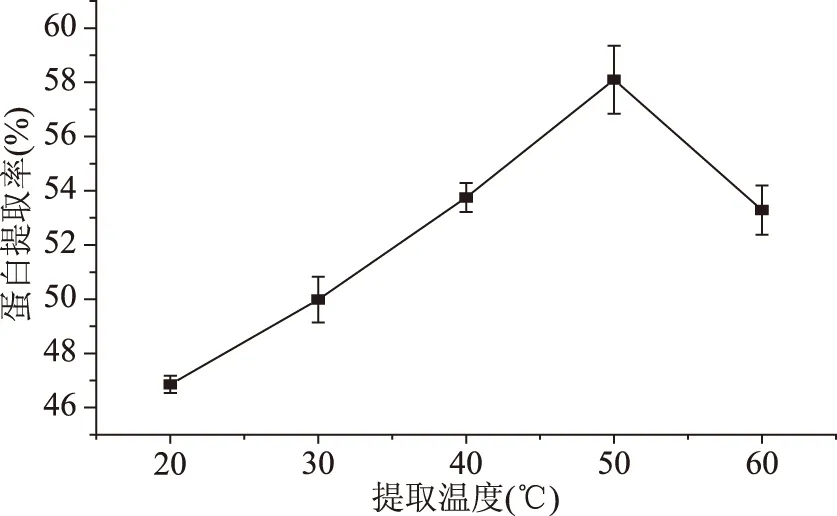
图4 提取温度对双孢蘑菇蛋白提取率的影响
2.2 响应面试验结果
2.2.1 回归模型的建立与显著性分析 蛋白提取率响应面实验结果如表2所示。

表2 蛋白提取率响应面实验结果
利用Design Expert软件对表2的实验数据进行拟合,得到提取率的二次多项回归模型为:
双孢蘑菇蛋白提取率Y=-263.75881+42.12188A+1.39756B+58.42250C-0.065000AB-1.71250AC-0.071500BC-1.71394A2-4.98313×10-3B2-7.32300C2,对模型进行方差分析和回归模型系数显著性分析,结果如表3所示:
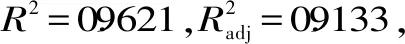

表3 蛋白提取率的方差分析与回归分析结果
利用Dinsign-expert 7.0软件做出交互作用3D曲面图。从图5可以看出,AB、AC响应面的坡度较陡,等高线密集成椭圆形,说明AB、AC两两交互作用对响应值的影响显著(p<0.01和p<0.05),而BC的曲面比较平缓,等高线稀疏,则说明其对响应值的影响不大。
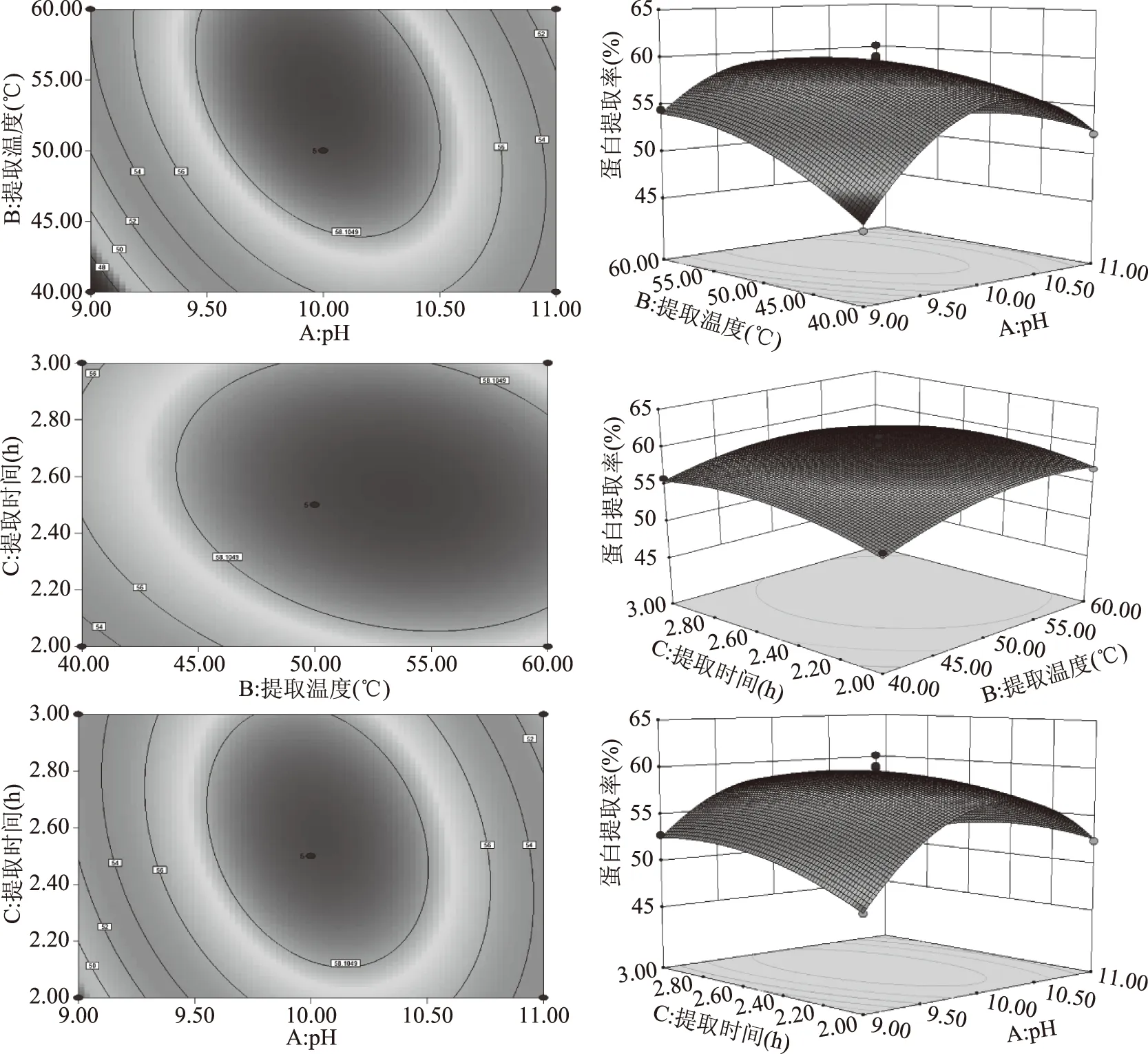
图5 两因素的交互作用图
2.2.2 响应面优化最佳条件的验证 对二次多项回归模型中的三个因素分别求导,以提取率最大值作为优化标准,得到最优水平组合为提取液pH为9.93,提取时间2.55 h,提取温度为57.18 ℃,理论提取率59.79%;根据实际情况选用pH为9.9,提取时间2.6 h,提取温度为57 ℃,作为实验条件进行验证,得到实际提取率:60.29%±0.19%,此时蛋白纯度为72.70%±0.38%。经SPSS软件显著性分析,实际蛋白提取率与理论值差异不显著(p>0.05),因此证明该模型能很好地预测实验结果。
2.3 双孢蘑菇蛋白氨基酸分析
蛋白中氨基酸种类齐全且符合FAO/WHO的氨基酸模式标准,则表示此蛋白营养价值较高,适合人体生理需求[25]。双孢蘑菇以及双孢蘑菇蛋白氨基酸的组成与含量见表4。双孢蘑菇以及双孢蘑菇蛋白氨基酸种类丰富,富含17种氨基酸,其中色氨酸未检测出是因为其在碱性条件下溶解。从表4可以看出,双孢蘑菇以及双孢蘑菇蛋白中谷氨酸含量均为最高,其次为天冬氨酸。这两种氨基酸属于主要的鲜味氨基酸,是食物中重要的鲜味物质,提供给双孢蘑菇独特的香味。
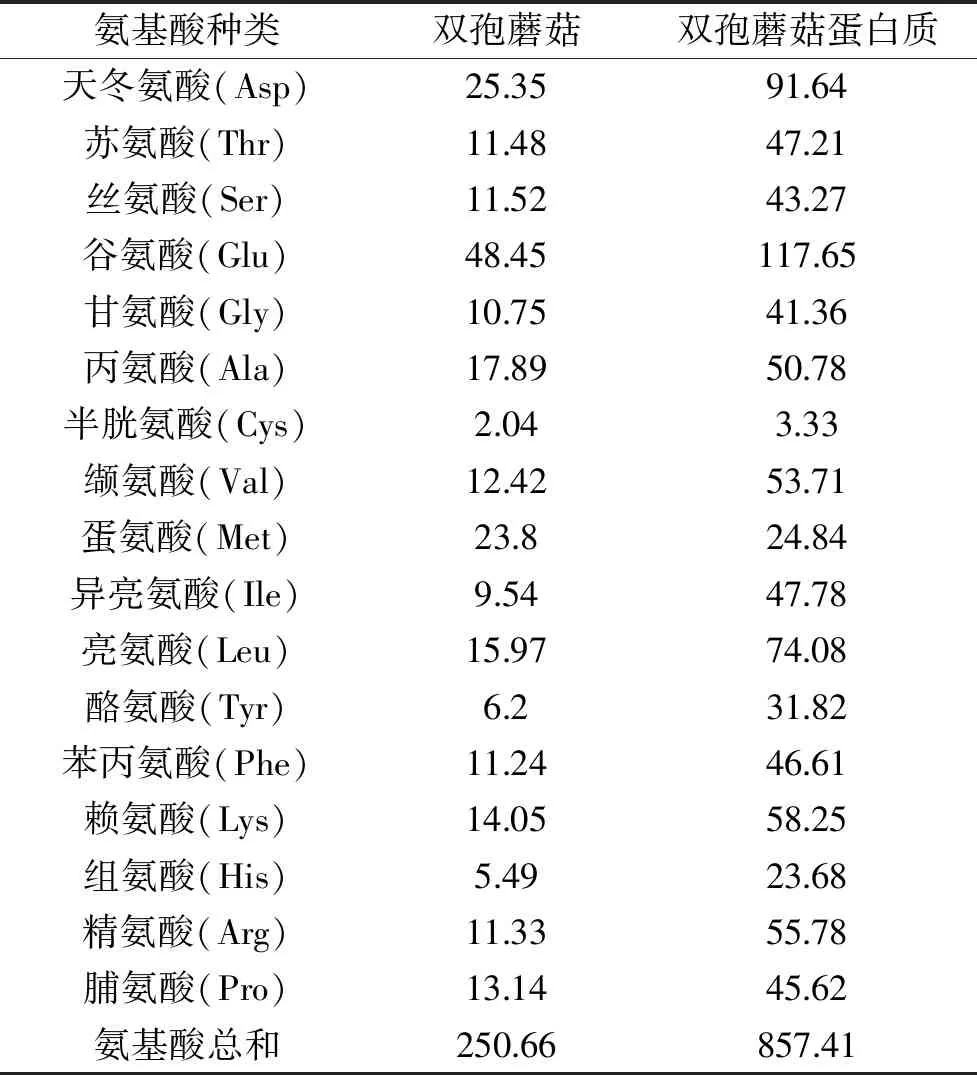
表4 双孢菇以及双孢菇蛋白质中氨基酸组成以及含量(mg/g)
在17种氨基酸中,双孢蘑蘑菇与双孢蘑菇蛋白中半胱氨酸、组氨酸含量较低,其中半半胱氨酸为第一限制性氨基酸,组氨酸为第二限制性氨基酸。
由表5可以看出,其必需氨基酸含量较高,占总氨基酸含量的45.20%,必需氨基酸和非必需氨基酸的比例为0.776,高于世界卫生组织规定值0.666,说明双孢蘑菇蛋白中氨基酸分布合理。双孢蘑菇蛋白必需氨基酸含量与FAO/WHO模式、鸡蛋蛋白氨基酸模式和FBN/IOM模式(美国食品营养研究会(Food and Nutrition Board,FNB)和美国全国科学院医学研究所(Institute of Medicine,IOM)根据1~3岁儿童必需氨基酸需要量提出的氨基酸评分模式)进行比较,由表5可以看出,整体而言,双孢蘑菇蛋白中必需氨基酸含量能够完全满足FBN/IOM模式,即能够满足1~3岁儿童所必需的氨基酸需要量。与FAO/WHO模式相比较而言,双孢蘑菇蛋白中蛋氨酸+半胱氨酸含量相对较低,除此之外,均能够满足FAO/WHO模式所要求的必需氨基酸含量。鸡蛋蛋白氨基酸模式中氨基酸含量要求较高,对于双孢蘑菇蛋白而言,其含量整体而言相对较低,可能需要进一步的补充才能够达到FAO/WHO模式的要求。
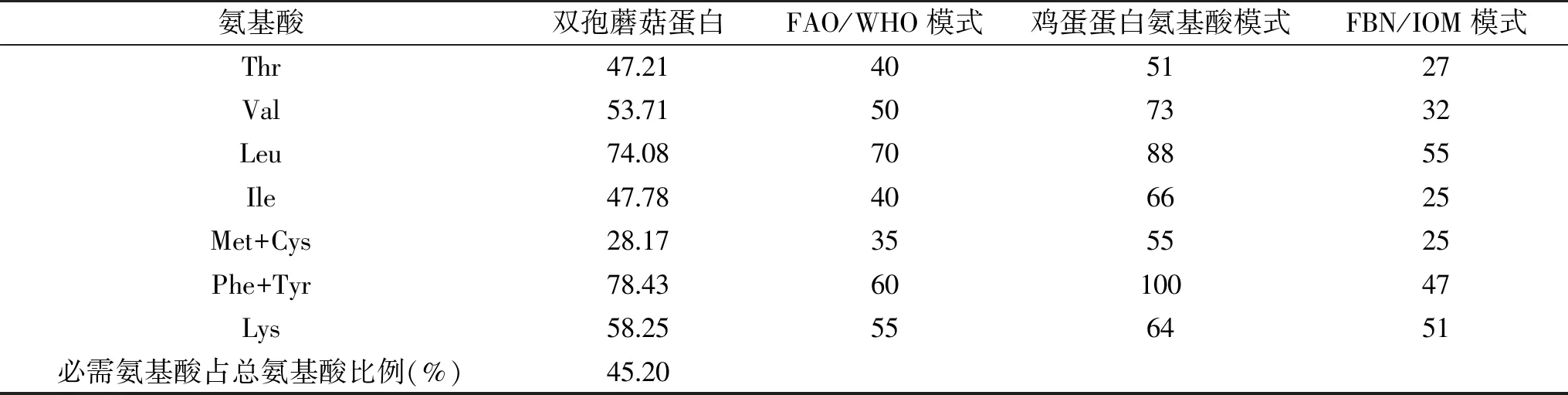
表5 双孢蘑菇蛋白必需氨基酸质量分数与FAO/WHO模式、鸡蛋蛋白氨基酸模式和FBN/IOM模式比较(mg/g protein)
2.4 双孢蘑菇蛋白功能性质研究
2.4.1 不同pH下双孢蘑菇蛋白的溶解度 蛋白的溶解性直接影响其功能性质及在食品中的应用。如图6所示,双孢蘑菇蛋白的溶解度曲线符合蛋白质的U型溶解规律,其在酸性条件下溶解度均低于35%,当pH达到等电点4时,溶解度最低为17.18%,这与前人在香菇柄中水溶性蛋白的等电点4.3及杏鲍菇分离蛋白的溶解度曲线相近,随着pH逐渐增加到11,蛋白的溶解度逐渐升高但是仍低于45.26%,推测可能是因为双孢蘑菇蛋白中含有较多的疏水性氨基酸与二硫键,从而使得其溶解度较低[26-27]。
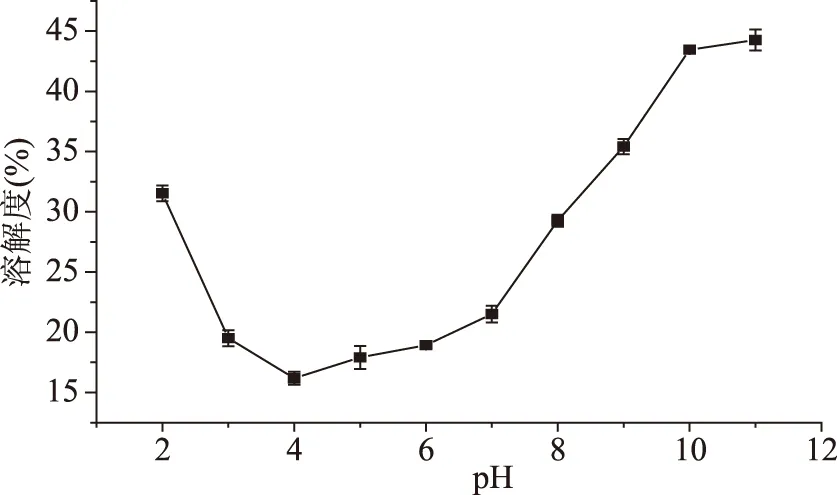
图6 不同pH下双孢蘑菇蛋白的溶解度曲线
2.4.2 双孢蘑菇蛋白功能性质 大豆蛋白是一种天然的优质植物蛋白,具有良好的营养价值以及多种功能特性,在食品领域中具有广泛的应用[28]。因此通过双孢蘑菇蛋白与大豆蛋白功能性比较初步判断双孢蘑菇蛋白的功能性质优劣。从表6可以看出,双孢蘑菇蛋白的持水性和持油性都较大豆分离蛋白高。持水性较大的原因可能是双孢蘑菇蛋白的极性氨基酸残基较多,与水分子的作用较强[27]。当蛋白的持水性在1.49~4.71 mL/g时,较适合用于如汤、肉汁等粘性食品及焙烤食品。由此可见,双孢蘑菇蛋白可作为粘性食品中的重要成分。
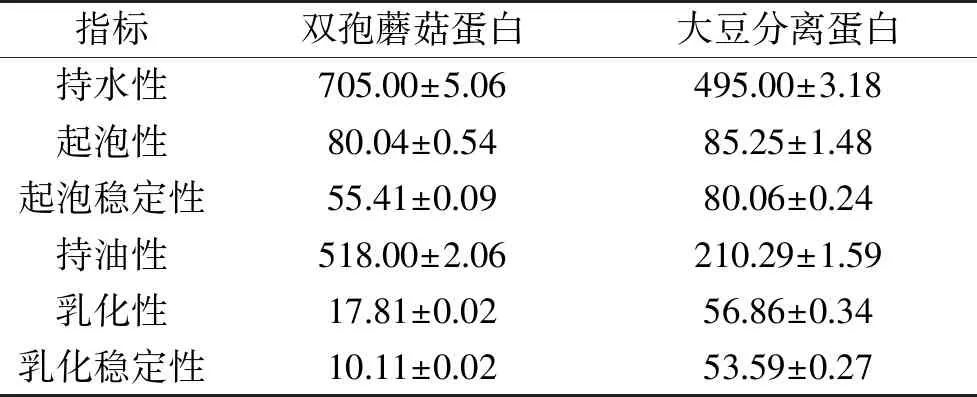
表6 双孢蘑菇蛋白功能性质(%)
持油性是蛋白的非极性侧链对油脂的结合,用来衡量蛋白的吸油能力,对于肉制品、奶制品以及饼干夹心等食品配方以及加工中,蛋白的持油性有着非常重要的作用[29]。双孢蘑菇蛋白的持油性高于大豆蛋白,这可能与双孢蘑菇蛋白的表观结构有关。
而双孢蘑菇蛋白的乳化性、乳化稳定性较低,这可能与双孢蘑菇蛋白的溶解性有关,蛋白在它的表面起作用之前必须先溶解和移动到界面。双孢蘑菇蛋白的起泡性略低于大豆分离蛋白,这也与双孢蘑菇蛋白的溶解性低于大豆分离蛋白有一定的关系,因为高溶解度的蛋白是作为起泡性和起泡稳定性的先决条件。
综合来看,双孢蘑菇蛋白的持水性和持油性较高,在食品加工中,可做为粘性食品、肉制品、奶制品以及饼干夹心中的主要成分。
3 结论
由响应面优化试验可知,双孢蘑菇最佳提取条件为料液比为1∶3 (g/mL),提取液pH为9.9,提取时间2.6 h,提取温度为57 ℃,得到蛋白提取率60.29%±0.19%,纯度为72.70%±0.38%。其氨基酸含量丰富,必需氨基酸含量与非必需氨基酸含量的比值为0.776,高于世界卫生组织规定值0.666,证明双孢蘑菇蛋白中氨基酸分布合理。双孢菇蛋白溶解度在pH为4时最低,为17.18%,pH为7.0时,其持水性为705.00%±5.06%,起泡性为80.04%±0.54%,气泡稳定性为55.41%±0.09%,持油性为518.00%±2.06%,乳化性为17.81%±0.02%,乳化稳定性为10.11%±0.02%,其持水性和持油性高于大豆分离蛋白,可作为肉制品、奶制品以及饼干夹心等食品配方以及加工中重要成分。
——记上海志磊食用菌种植专业合作社

