胰腺导管内乳头状黏液瘤治疗指南的更新及目前存在的争议
欧政林 李宜雄 纪连栋 刘国栋 杨杰 柯牧京
1中南大学湘雅医院胰腺胆道外科,长沙 410008;2中南大学湘雅医院超声影像科,长沙 410008
【提要】 随着影像学技术的不断进步,胰腺导管内乳头状黏液瘤(IPMN)的检出率得到了显著增加。在过去的20多年里,学者们通过对以往IPMN病例的总结分析,对其的认知程度也在不断地深入。到目前为止多个胰腺病学协会颁布了不同版本的治疗指南,在一定程度上规范了对该病的治疗,但由于该病具恶变潜能,整个病变贯穿了从良性到高度不典型增生、最终发展为浸润性癌的整个过程,其自然病史仍未完全了解,有待进一步研究。
一、定义及特征
胰腺导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm,IPMN)是指胰腺内具有外分泌功能导管的正常上皮组织被具有分泌黏液性、呈乳头状生长的肿瘤性组织所替代[1],该病具有恶变潜能,有可能进展为浸润性癌[2]。IPMN的典型特征是胰腺肿瘤性黏液分泌上皮分泌大量黏液,导致胰腺导管扩张或导管被黏液填充形成囊肿,导管壁部分增厚或形成乳头状突起,囊腔与周围的胰管相通;如病灶累及主胰管,行ERCP检查可见大量黏液从十二指肠乳头溢出[1,3]。
二、认知过程
1982年,日本的Ohashi等学者首次报告了4例胰腺癌,它们与以往的胰腺癌不同,产生大量黏液,同时合并有胰管系统的弥散性扩张。该类疾病在随后的10余年里有相关的报道,但是没有统一的命名,被人们称为黏蛋白分泌癌、黏液分泌亢进性肿瘤、Wirsung导管绒毛状腺瘤、弥漫性导管内乳头状腺癌、导管内囊腺瘤、黏液性胰管扩张症和导管内乳头状黏液性肿瘤等[4]。 直到1996年,世界卫生组织(WHO)将产生黏液的胰腺囊性肿瘤分为两种不同的疾病,即导管内乳头状黏液性肿瘤(intraductal papillary mucinous tumor,IPMT)和黏液性囊性肿瘤(mucinous cystic tumor,MCT)[5]。2000年,WHO将这两种肿瘤重新命名为了IPMN和黏液性囊腺瘤(mucinous cystic neoplasm, MCN)[6]。
在最开始学者认为能够产生黏液的胰腺囊性肿瘤是较为罕见的,且具有恶变的潜能,所以在治疗上一经发现就行手术切除[7]。 但随着影像学技术的提高,人们发现胰腺囊性肿瘤较为常见[8],2 832名非胰腺疾病的患者在门诊接受腹部CT检查,发现2.6%的患者患有胰腺囊性疾病[9]; 运用磁共振成像技术(MRI)对2 699名患者进行检查,发现达到19.6%的患者患有胰腺囊性疾病[10],并且发现该病的检出率随着年龄的增大而增加[9-10];对152名没有胰腺疾病病史的患者使用磁共振胆管造影(MRCP)检查后发现,胰腺囊性病变的患病率达到了44.7%[11]。在日本学者进行的一项尸体解剖研究报道中,有300例(300/2 300)标本发现有胰腺囊性病变,而且该疾病检出率随着年龄的增高而增加,通过病理学检查进一步发现,这些病变中有一半以上是非正常的上皮组织,其中乳头状不典型增生的比例达到了32.8%[12]。随着对IPMN认识的不断加深,人们发现并不是所有的IPMN都需手术治疗。Furukawa等[13]通过对12例胰腺黏液分泌亢进性肿瘤的手术标本进行分析,发现病变位于主胰管或分支胰管,扩张的胰管形成囊性病灶。Kobari等[14]回顾了手术切除的30例IPMT病例后提出了临床亚型的假说,即IPMT在临床上可以根据病变部位分为主胰管亚型和分支胰管亚型。Furukawa等[15]根据乳头状增生组织的组织学特征及MUC蛋白的免疫组织化学特征将IPMN分为胃型、肠型、嗜酸细胞型、胰胆管型。总结以往的病例发现,在主胰管型IPMN(MD-IPMN)的标本中病理学结果为高度不典型增生及浸润癌的比例高达61.6%,其中浸润癌的比例为41.3%,MD-IPMN具有较高的恶变潜能,需手术切除[16-24];然而在分支胰管型IPMN(BD-IPMN)标本中,高度不典型增生及浸润癌的比例为31.1%,浸润性癌占18.5%[25-31],它的恶性程度比MD-IPMN要低的多,且大多生长缓慢,治疗上可以予以非手术定期复查[32-33]。
三、治疗指南的制定及更新
早先由于对IPMN的不甚了解,对该类疾病的治疗仅凭借各自的经验,没有统一、规范的治疗指南。随着对IPMN疾病研究的深入,对它的治疗指南也相继颁布和更新。
2004年国际胰腺病学会(International Association of Pancreatology, IAP)在日本仙台达成了关于IPMN的治疗共识,并于2006年发表在《Pancreatology》上,这是第1篇关于IPMN的治疗指南。该指南提出对所有适合手术的患有MD-IPMN的患者应行手术切除;对于有症状的、具有高危特征(壁结节、主胰管扩张、囊液肿瘤细胞学检查阳性)或病灶>3 cm的BD-IPMN患者应采取手术切除;对于囊肿<3 cm,且无高危特征、无临床症状的BD-IPMN患者可暂不予以手术治疗。如病灶<1 cm则每年复查,病灶在1~2 cm之间则每隔6~12个月复查,病灶在2~3 cm之间则每隔3~6个月复查,复查期间如出现高危特征或有临床症状、病灶增大明显的则行手术切除[34]。
随着人们对IPMN的进一步认识,特别是在内镜超声(EUS)引导下细针穿刺检测术的应用普及,IAP于2010年对仙台指南予以修订,并于2012年发表在《Pancreatology》上。本次指南认为在MD-IPMN中,主胰管扩张≥10 mm应视为癌变的高危因素,患者只要能耐受,就应手术切除;主胰管扩张在5~9 mm之间的应视为癌变的“担忧因素”,首先应当进行评估是否需要手术(推荐处理措施同BD-IPMN)。同时,对于BD-IPMN的处理对策也做了相应的修订,对于存在高度癌变风险(囊灶位于胰头部引起梗阻性黄疸、影像学上囊灶内有强化的实性成分、主胰管扩张≥10 mm)或存在令人担忧的情况下(胰腺炎表现,囊灶≥3 cm、增厚或强化的囊壁、主胰管扩张5~9 mm、非强化壁结节、胰管内径的突然改变并有远端胰腺萎缩)行EUS检查表现有明确的壁结节、主胰管可疑受累、细胞学检查可疑或证实恶性肿瘤者则需行手术切除;同时也不再将病灶是否>3 cm定为手术切除的硬性指标,只是强烈建议在没有癌变的高危因素或令人担忧的因素下,对于<65岁且能够耐受手术的患者行手术切除。关于对未行手术病例的随访较之前也稍有调整,如病灶<1 cm则每2~3年复查CT/MRI;病灶在1~2 cm则每年复查CT/MRI,持续两年,复查期间如病灶无明显变化则可延长复查间期;病灶2~3 cm则3~6个月行EUS检查,病灶如无变化则可EUS、MRI交替检查并适当延长复查间期;如病灶>3 cm未行手术的患者则每隔3~6个月EUS、MRI交替检查[35]。
2011年10月欧洲胃肠病学会形成胰腺囊性疾病诊疗共识,并于2013年发表在《Digestive and Liver Disease》上。欧洲学者认为MD-IPMN及混合型IPMN都具有高度的恶变潜能,所有患者只要能够耐受手术均应手术治疗;在对于BD-IPMN的治疗上,则将影像学检查上表现有壁结节、主胰管扩张、病灶每年增长速率>2 mm、有临床症状(如典型腹痛、胰腺炎、新发的糖尿病、黄疸)、血清学CA19-9检测值异常视为恶变的风险因素,他们认为只要患者能够耐受手术且存在任何一种恶变的风险因素均应行手术治疗;在没有恶变风险因素时,他们认为病灶的大小与其恶变的能力可能是有关联的,但是目前并没有严格的界值来判定。在对于该种BD-IPMN的手术适应证把握上,他们认为只要病灶大小没达到4 cm及以上都可以暂不手术,定期观察。在随访的问题上,欧洲专家建议行MRI或EUS检查,第1年里每6个月检查1次;第2至第5年,每1年检查1次;5年以后,每隔6个月检查1次;在随访期间如果病灶增大但是仍未达到切除标准的,则每隔6个月检查1次[36]。
2015年美国胃肠病学协会制定并发布了关于无临床症状的胰腺囊性疾病的治疗指南。该指南仅包含对影像学偶然检查发现的、无临床症状的BD-IPMN的处理。美国专家认为,病变如果具有两个或以上的恶变高危特征(如病灶≥3 cm、主胰管扩张、含有实性成分),需进一步行EUS引导下细针穿刺检查;如果病灶<3 cm且影像学检查病灶性质无实性成分、胰管无扩张,只需在第1年及其后每隔2年行MRI随访,病灶大小及病灶性质如无改变,只需随访5年;如在随访过程中病灶出现了明显的改变(病灶增大≥3 cm、胰管扩张、病灶进展为有实性成分),需再进一步行EUS引导下细针穿刺检查。就手术而言,美国的专家相对较为保守,他们认为只有在病灶同时具有实性成分且胰管有扩张,和(或)EUS引导下细针穿刺检查阳性的情况下,患者才应行手术治疗[37]。
中华医学会外科学分会胰腺外科学组也在2015年制定颁布了中国的胰腺囊性疾病的治疗指南。其中关于IPMN的部分,建议因MD-IPMN具有较高的恶变概率,均应手术治疗;对于BD-IPMN,他们认为肿瘤直径≤3 cm的情况下可暂时随访观察,但如具有以下恶变的高危因素时则需积极手术处理:引起相关临床症状;肿瘤直径>3 cm;存在壁结节;主胰管扩张>10 mm;胰液细胞学检查发现高度异型细胞;病灶增长速率≥2 mm/年;实验室检查CA19-9水平高于正常值。如主胰管扩张5~9 mm的患者合并其他危险因素,根据情况亦可积极手术治疗。 关于无恶变高危因素病例的随访,专家组建议每12个月检查1次。对于存在其他严重并发症的高危、高龄患者,若仅存在肿瘤直径>3 cm这一项高危因素,则可暂时予以观察,但其随访频率则应相对增加[38]。
美国胃肠病协会制定的无症状的胰腺囊性疾病治疗指南一经发布,其中关于监测、随访的问题在胰腺病学领域引发了巨大的争议。2016年国际胰腺学会在日本仙台召开了第20届会议,会议期间与会专家根据近年来发表的文献再次对IPMN的治疗策略进行了讨论,并专门召开就BD-IPMN监测随访的专题研讨会,同时讨论了壁结节的大小对病灶恶性程度的预测关系,最终对2012年发布的IPMN福冈指南进行了修订,并于2017年发表在《Pancreatology》上。该版本中专家对于MD-IPMN的治疗仍然沿用了福冈指南中的建议。对于BD-IPMN的治疗较之前稍微做出了修正:对存在高度癌变风险(囊灶位于胰头部引起梗阻性黄疸、影像学上有≥5 mm的强化壁结节、主胰管扩张≥10 mm)或存在任何一种“令人担忧情况”(胰腺炎表现、囊灶≥3 cm、<5 mm的强化壁结节、存在增厚或强化的囊壁、主胰管扩张5~9 mm、胰管直径突然改变且胰腺远端萎缩、胰腺周围淋巴结增大、血清中CA19-9检测值高于正常、病灶2年内增大≥5 mm)行EUS检查表现有明确的≥5 mm壁结节、主胰管存在受累或可疑受累、细胞学检查见可疑或证实恶性者则需行手术切除;对年龄<65岁,病灶>2 cm即使无高度癌变风险及“令人担忧情况”的患者强烈建议手术切除;对未行手术病例的监测、随访较之前也有所调整,如病灶<1 cm则在发现病灶的半年后行CT或MRI,无变化则每2年复查;病灶在1~2 cm之间则在发现病灶后的第1年里每半年行CT或MRI检查,如无变化则在接下来的第2、3年间每年复查1次,之后复查间期则延长至2年;病灶在2~3 cm之间则3~6个月行EUS检查,病灶如无变化则可行EUS、MRI交替检查,并延长复查间期至1年;如病灶>3 cm未行手术的患者则每隔3~6个月EUS、MRI交替检查(图1)[39]。
2016 年欧洲胃肠病学会、欧洲胰腺囊性肿瘤学组等相关专家对2013年颁布的欧洲胰腺囊性肿瘤的治疗指南也进行了更新,最终于2018年发表在《Gut》杂志上,该指南与以往最大不同是应用了循证的方法。在关于IPMN的部分中,欧洲的专家认为肿瘤相关性黄疸、影像学上存在≥5 mm增强的附壁结节或实性成分、细胞学检测阳性、主胰管扩张≥10 mm为恶变的高危因素,应视为手术的绝对适应证;存在主胰管扩张直径为5.0~9.9 mm、囊性病灶生长率≥5 mm/年、血清学检测CA19-9≥37 U/ml、伴有临床症状(新发糖尿病或急性胰腺炎)、存在增强<5 mm的附壁结节和(或)囊性病灶直径≥ 40 mm为能够增加高度异型增生或癌变的风险因素,应视为手术的相对适应证。关于治疗方面,他们认为当患者存在有手术的绝对适应证时,应行手术治疗;当患者没有合并其他严重的致死性疾病且有一项或以上的手术相对适应证时,应行手术治疗;当患者合并其他严重的致死性疾病且有两项或以上的手术相对适应证时,应行手术治疗;对于合并其他的致死性疾病或生存期较短的且只有一项手术相对适应证的患者,则不建议手术,予以定期复查监测。关于随访、监测的问题,对于存在手术相对适应证但不建议手术的患者,则行每半年为一间期的检查评估,包括临床的评估、血清CA19-9的检测、MRI和(或)EUS的检查;对没有手术适应证的患者也建议常规复查,诊断后的第1年里,半年为1周期,第2年开始则每一年为检查周期,检查包括行临床学评估、血清学CA19-9的检测、MRI和(或)EUS的检查[40]。
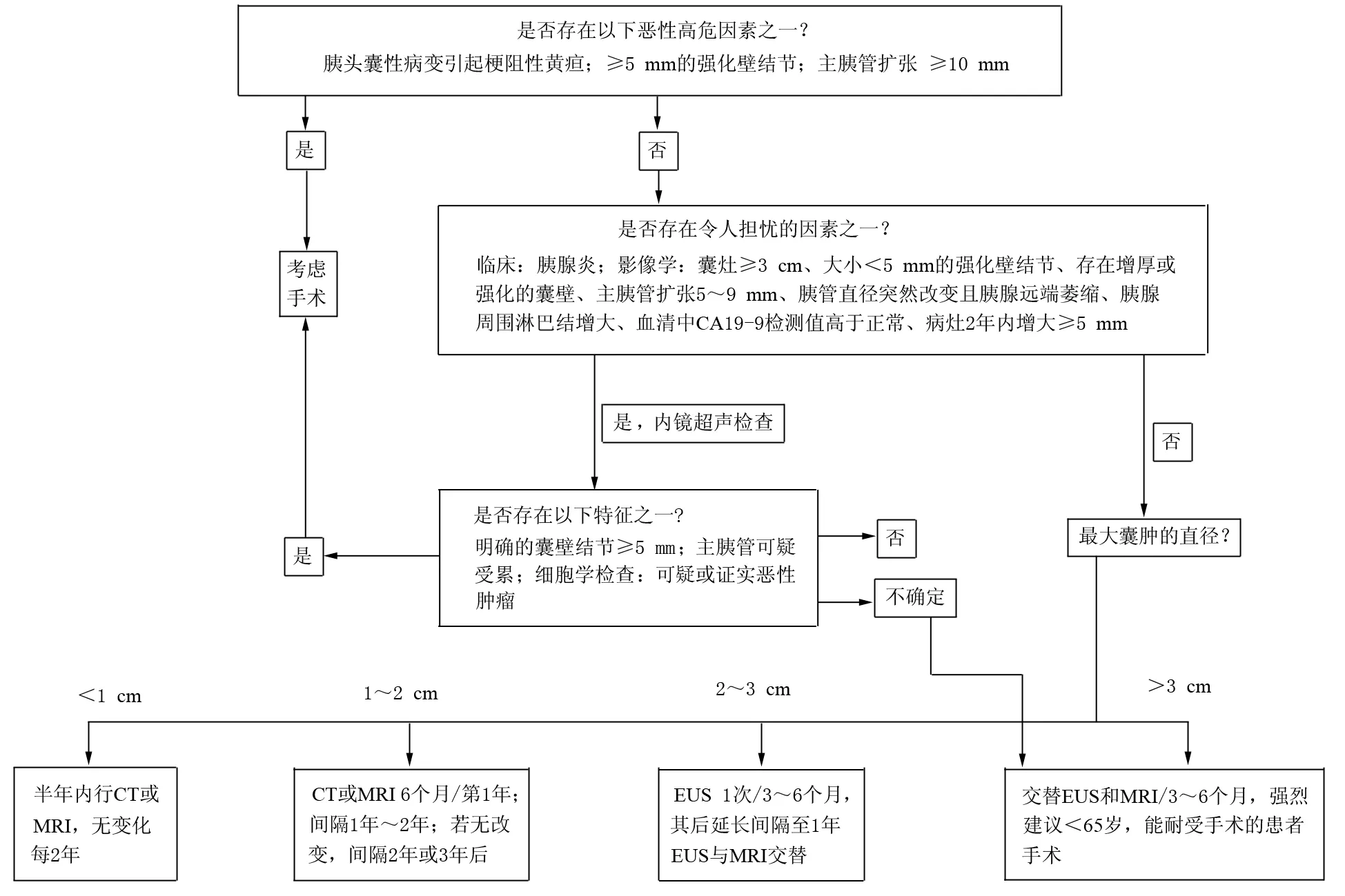
图1 2017年IPMN仙台治疗指南
四、目前的争议
在过去的20多年里,学者们通过对IPMN病例的总结分析,对它的认知程度在不断地加深,虽然到目前为止多个胰腺病学协会已经颁布了多个版本的治疗指南,但是由于IPMN具有相对较高的恶变潜能,整个病变贯穿了从良性到高度不典型增生,最终发展为浸润性癌的整个过程[41]; 目前人们对它详细的自然病史仍不甚了解,仍不能十分准确地在术前分辨该病的良、恶性质,所以学者对该病的手术时机及随访监测上仍抱有不同的意见。
由于大家一致认为MD-IPMN具有极高的恶变能力,所以对于其治疗原则基本达成共识:当主胰管扩张≥10 mm时,需积极手术;主胰管扩张在5.0~9.9 mm时首先应根据情况来评估是否需要手术,而不是立即手术[35,38-39]。 但是也有学者提出了不同的声音,他们发现即使主胰管扩张在5.0~9.9 mm之间,病灶为高度不典型增生或癌变的概率也达到了30%~90%,由于手术治疗的主要目的是在病灶进展到高度不典型增生、浸润性癌前就应当切除病灶,所以他们主张当MD-IPMN主胰管扩张≥5 mm时也应当行手术治疗[42-47]。
相对 MD-IPMN而言,对于BD-IPMN的治疗一直都存有争议。早在20世纪90年代,Furukawa等[13]就发现在病变来源于分支胰管的胰腺黏液分泌亢进性肿瘤中,存在病理检查结果仅为普通上皮组织或增生上皮组织的病变;Kobari等[14]发现在手术切除的BD-IPMN中,有70%的病理报告是良性病变。随着越来越多BD-IPMN病例研究报道的发表,人们发现该病的平均诊断年龄为65岁[48],且在没有“高度恶变风险”及“令人担忧”的因素下每年进展为高度不典型增生或浸润性癌的比例低于4%[33],该比例与胰腺手术的主要并发症的死亡率接近,所以主张此类患者不需要行手术治疗,仅需定期复查[32-33,48]。 但是也有学者认为即使是小的、无症状且在影像学检查中没有“可疑的特征”的BD-IPMN仍然具有恶变的风险,依旧是危险的[30-31,49-52]。虽然目前有报道,这些病灶在5年的观察期内恶变的概率很低,不需立即手术,仅予以定期监测是安全的[53],但是这个观察期如果延长至10年或更长的时间,其恶变概率是否会随着时间的延长而增加?目前仍不得而知[54]。Fritz等[30]回顾了在海德堡大学医院8年时间里手术切除的512例IPMN病例发现,根据指南判定为不需立即手术的141例BD-IPMN患者病理结果为高度不典型增生或浸润性癌的比例达到了18%。因此即使是小的且无临床症状的BD-IPMN仍然有进展为高度不典型增生或浸润性癌的风险[30-31,49-52],应该在区域性的胰腺外科中心接受手术治疗,可以通过采用胰腺病灶局部切除的方式来降低手术造成的并发症发生率及死亡率[30]。
五、小结
随着影像学检查技术地不断进步,临床医师对IPMN的认知、诊断水平也得到了提高。由于该病具有潜在的恶变风险,因此及时正确地根据病变的临床特征,特别是影像学的特征以及与细胞学特征来做出正确的处理,对于改善患者的预后尤为重要。虽然IPMN的治疗指南在一定程度上对该疾病提供了规范化、系统化的治疗措施,但是迄今为止IPMN并未被人们完全认识,关于对其治疗仍有争议,其自然病史也仍有待人们进一步地了解。
利益冲突所有作者均声明不存在利益冲突

