SO2通入FeCl3溶液的实证探索
吴正帅 蒋永胜
甘肃省兰州市教育科学研究所(730046) 甘肃省兰州市第三十四中学(730050)
1 问题的提出
通常认为,FeCl3溶液中通入SO2只发生氧化还原反应,反应的化学方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,反应后溶液呈浅绿色。笔者进行实验,发现事实并非如此。取5 mL 0.05 mol/L FeCl3溶液于试管中,通入SO2气体后,观察到溶液很快由黄色变为红棕色;继续通入SO2气体,溶液颜色变化不大。为什么溶液会变为红棕色,所得到的红棕色物质又是什么呢?
2 实验探究
2.1 实验1
红棕色溶液与Fe(OH)3胶体的性质对比实验过程见表1。
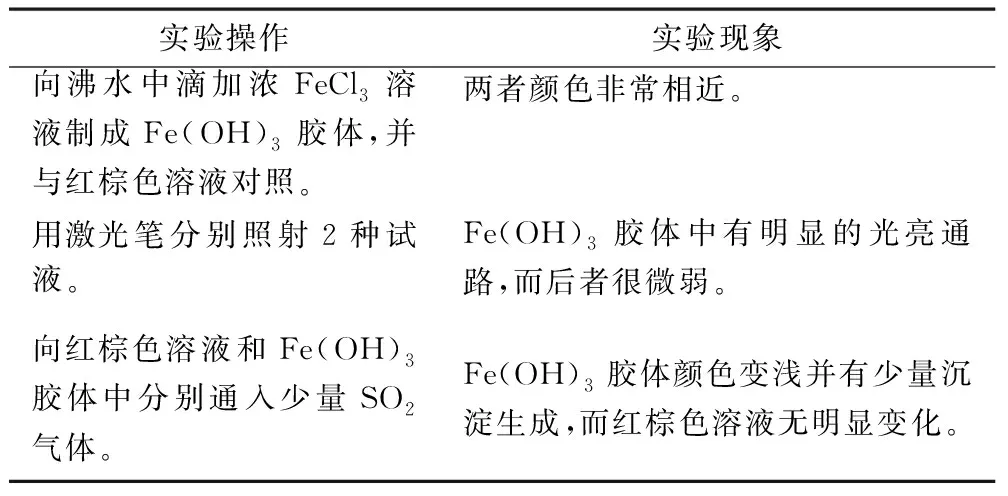
表1 红棕色溶液与Fe(OH)3胶体的性质对比
实验1结论:
向Fe(OH)3胶体中通入少量SO2气体,胶体颜色变浅并有少量沉淀生成,这是由于SO2气体和水反应生成电解质H2SO3,致使胶体发生了聚沉。向红棕色溶液中通入少量SO2气体,无明显变化。根据丁达尔现象知道红棕色物质不是Fe(OH)3胶体。
Fe(OH)3胶体是在加热促进Fe3+水解的条件下生成的。FeCl3溶液显酸性,向其中通入酸性气体SO2,会抑制Fe3+的水解,不利于胶体形成。
2.2 实验2
FeCl3溶液与SO2的反应实验过程见表2。

表2 FeCl3溶液与SO2的反应
实验2结论:
室温条件下,反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+需要较长的时间才能进行完全。
2.3 实验3
强酸性条件下,FeCl3溶液与SO2的反应实验过程见表3。

表3 强酸性条件FeCl3溶液与SO2的反应
实验3结论:
增强溶液的酸性可避免发生实验异常现象,一定程度上能抑制副反应的进行。
3 理论探究
假设一:红棕色物质可能是Fe3+与SO2形成的配合物。假设二:红棕色可能是多种有色物质混合而成的。
3.1 假设一
通过对红棕色物质进行实验探究和分析,红棕色物质可能是Fe3+与SO2形成的配合物。
3.1.1 理论分析
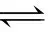
Fe3+和SO2既可以发生配位反应生成棕红色的Fe(SO2)63+,又能发生氧化还原反应生成Fe2+、SO42-和H+。从反应动力学角度看,配位反应速率快;从反应热力学角度看,配合物稳定性差,发生氧化还原反应的趋势大。向FeCl3溶液中通入SO2,开始时溶液出现棕红色,可能的原因是配位反应速率大于氧化还原反应的速率,主要发生配位反应。放置相当长的一段的间,红棕色逐渐变浅直至浅绿色,可能的原因是氧化还原反应的趋势大于配位反应的趋势,在此过程中缓慢发生了氧化反应,使配位反应的程度不断减弱。因此,Fe3+和SO2的反应现象是热力学和动力学共同作用的结果。
3.2 假设二
红粽色可能是由多种有色物质混合而成的。
3.2.1 理论分析
通过对比实验的方法,对SO2气体与FeCl3溶液反应时,溶液颜色先变深(红棕色),一段时间后再变浅(浅绿色),分析可能的原因:红粽色可能是由多种有色物质混合而成。
3.2.2 理论假设

(4)2Fe3++SO2+2H2O=2Fe2++ SO42-+4H+

反应(4)若要完全进行,需较长时间。在此期间,反应产物Fe2+与反应体系中的SO32-发生反应(5),红棕色就是FeSO3(墨绿色)和FeCl3(黄色)的混合色。随着反应的进行,H2SO3分子逐渐减少,SO32-随之减少,反应(5)中的平衡向左移动,于是FeSO3逐渐减少并最终消失;与此同时Fe3+也逐渐减少,直至完全转化为Fe2+。最后,混合溶液的颜色就变成了Fe2+的颜色(浅绿色)。

