射波刀治疗小细胞肺癌脑转移的疗效分析
赵军华,邱鸣寒,袁智勇
(1天津医科大学肿瘤医院放疗科射波刀中心,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心,天津300060;2天津市人民医院肿瘤内科,天津300121)
肺癌是最常见的恶性肿瘤之一,其中小细胞肺癌(small cell lung cancer,SCLC)约占 15%~20%。颅内是SCLC的主要转移部位。局限期SCLC的脑转移发生率约为49%,广泛期则高达65%[1]。脑预防照射(Prophylactic cranial irradiation,PCI)可降低局限期 SCLC 脑转移(brain metastases,BM)的发生率,延长其生存[2],已成为其标准的治疗方法。尽管如此,但PCI后仍会有16.8%~33.3%的患者出现脑转移,脑转移1年的发生率为11.9%~14.6%[2-3],发生脑转移后,全脑放疗(whole brain radiotherapy,WBRT)仍为目前的标准治疗方法,其治疗的缓解率为50%~80%[3]。但在WBRT后的患者中,仍有很高的风险会发生颅内进展。因此如何优化SCLC脑转移的控制手段,仍是SCLC治疗的探索重点。立体定向外科(Stereotactic radiosurgery,SRS)单独治疗各组织来源≤4个的BM病灶能取得与联合WBRT治疗相近的生存率[4]。SRS在SCLC脑转移的治疗中也有研究[5-9],可治疗PCI后的新发脑转移病灶[8],可作为WBRT失败后的挽救性治疗[5-7],或与WBRT联合治疗[5]提高颅内控制率,也可作为单独治疗[9],但研究相对少,且对于SRS作为初始治疗还是WBRT失败后的挽救性治疗的探讨尚未得出一致的结论。因此,本研究收集了天津医科大学肿瘤医院射波刀中心2006年7月-2015年12月治疗的28例SCLC脑转移患者的资料,旨在探讨射波刀治疗SCLC脑转移的疗效。
1 资料与方法
1.1 患者临床资料及治疗情况 收集从2006年7月-2015年12月期间,临床及随访资料完整的SRS治疗的SCLC脑转移患者28例,其中男性患者19例,女性患者9例,中位年龄为57岁,中位卡氏评分为80分,中位脑转移瘤数目为2个,中位脑转移瘤直径为2 cm。治疗前所有患者均行化疗或胸部放疗,原发肺部肿瘤得到控制。患者的基本资料及治疗资料,见表1。

表1 患者的基本临床资料及治疗资料General conditions and radiotherapy planning data of patients
1.2 SRS情况 治疗机器是第三代射波刀(CyberKnife),为6MV的X线,拥有靶区定位追踪系统及呼吸追踪系统等监测系统,颅内肿瘤治疗时采用6D颅骨追踪进行治疗,所有患者脑转移病灶均由强化MRI(层厚为1.5 mm)确定,靶区勾画参照头MRICT融合图像在射波刀医师工作站进行,肿瘤靶区体积(gross tumor volume,GTV)为影像学能界定的恶性病变,将GTV在X轴、Y轴、Z轴三个方向上外放1.25~1.5mm为计划靶区体积(planningtargetvolume,PTV),同时勾画出眼球、晶状体、视神经、视交叉、丘脑等正常组织(图1)。
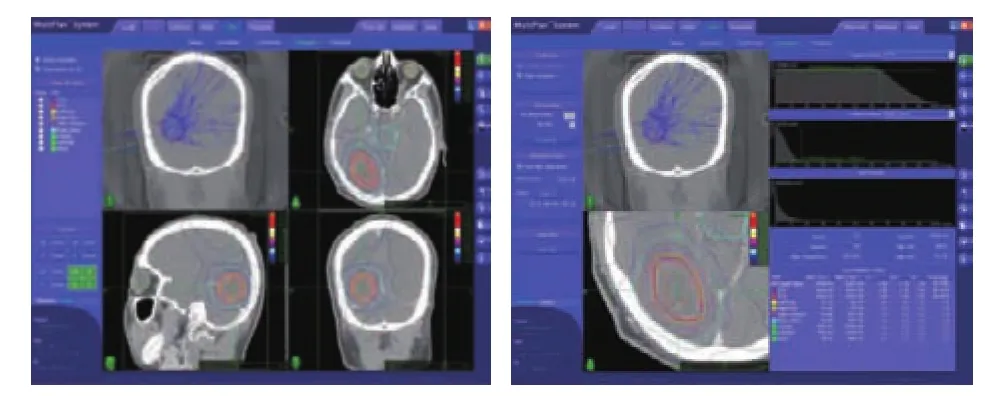
图1 靶区勾画示意Fig 1 Target area outline
1.3 随访情况 随访截至2017年1月1日,首次随访为治疗后1.5个月,此后每3个月随访1次,1年以后根据患者实际情况进行复查,最长不超过半年复查1次,若有明显不适症状,随时复查。每次复查均由强化MRI评价脑部肿瘤变化情况。
1.4 统计学方法 用SPSS 22.0软件进行分析,用Kaplan-Meier法进行生存分析,同时分析影响总生存时间(Overall survival,OS)、颅内局部控制率(Local control,LC)及颅内无远处转移生存(Distant metastases free survival,DMFS)的因素,并使用 Logrank检验,P<0.05为差异有统计学意义。治疗前评价预后分级用Diagnosis-Specific Graded Prognostic Assessment(DS-GPA)[10]评分系统。脑部肿瘤治疗评价根据RANO疗效评价标准。毒副反应依据CTCAE 4.0来评价。
2 结果
2.1 OS情况 中位随访期为13个月,中位生存期为12个月(2~90个月),随访终末,6例(21%)患者存活,22例(79%)患者死亡,其中10例(45%)属于颅内进展死亡,12例(55%)属于颅外疾病进展死亡。6个月、1年、2年的OS分别为89.3%、50.0%、22.2%(图2)。单因素分析显示颅内肿瘤数目与生存相关(P=0.012,χ2=6.364),多因素 Cox回归分析示颅内肿瘤数目为影响生存期的独立预后因素(P=0.023,95%CI 0.104~0.849)(表 2)。

表2 单因素分析影响生存、局控、颅内远处转移的因素Univariate analyses of factors associated with overall survival,local control and Distant metastases of brain
2.2 局部控制率(LC)及无颅内远处转移生存(DMFS)情况 在治疗后1.5个月时,通过影像学随访,4例(14%)达到CR,20例(71%)达到PR,2例(7%)达到SD,2例(7%)达到PD。6个月、1年、2年的LC分别为96.3%、85.4%、76.8%(图3)。随访终末,4例(14%)出现颅内原位复发。6个月、1年、2年的DMFS分别为73.9%、66.1%、38.2%(图4)。13例出现颅内远处转移(46%)。在所有出现颅内进展的15例患者中,其中4例再次行SRS治疗,1例继续化疗,其余10例对症处理或未治疗。单因素分析显示年龄和颅内肿瘤最大径与局控相关,无相关因素与DMFS相关(表2)。
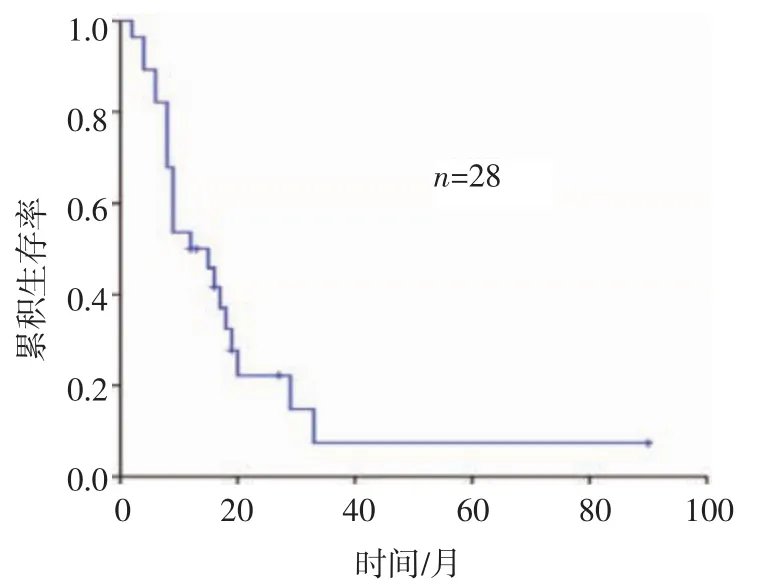
图2 生存曲线Fig 2 Survival curve

图3 局部控制曲线Fig 3 Local control rate curve

图4 无颅内远处转移生存曲线Fig 4 distant metastasis free survival curve
2.3 毒副反应发生情况 经治疗,患者治疗前的不适症状均有所缓解。在立体定向放射外科治疗期间或治疗后1.5个月内,共3例患者出现了1~2级急性毒副反应,包含为2例头痛、恶心、呕吐,1例肢体活动不利,其发生率为10%,未见3级及3级以上急性毒副反应。随访终末,共7例患者出现了晚期毒副反应,其中4例出现了1~2级的晚期毒副反应,包含1例头痛及3例放射性脑坏死(均由影像学确定)(表3),3例出现3级晚期毒副反应,为3例放射性脑坏死(表3),应用贝伐单抗及甘露醇对症治疗,通过影像学随访,患者颅内水肿范围均较前缩小,临床症状如头痛、呕吐、乏力等有所缓解。1~2级毒副反应发生率为14%,3级毒副反应发生率为10%。
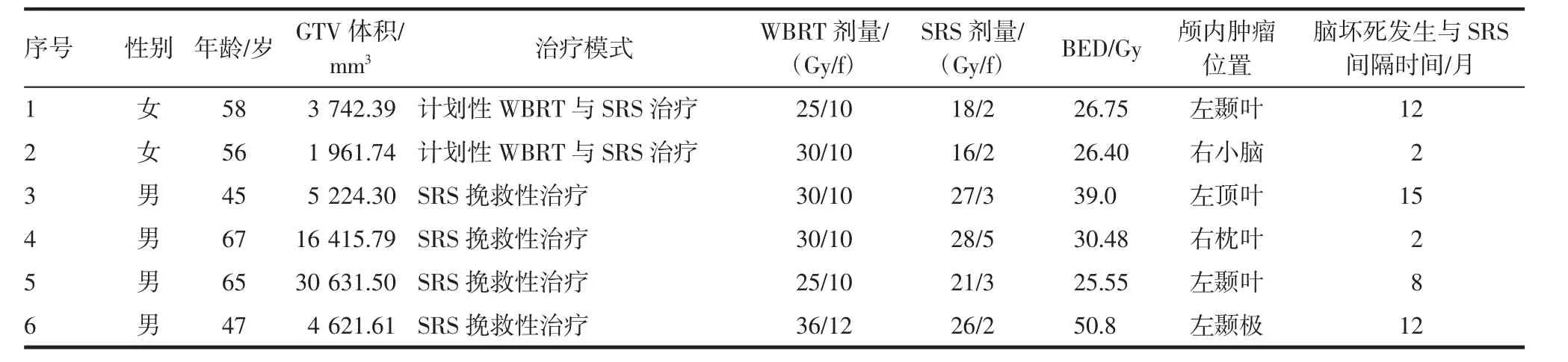
表3 放射性脑坏死发生情况Tab 3 Radioactive brain necrosis
3 讨论
在SCLC的病程中,约有30%~80%的患者会发生脑转移[1],约40%的患者在诊断SCLC的1年内出现中枢神经系转移,颅内转移的出现在很大程度上会影响小细胞肺癌患者的生存期及生活质量[2]。由于化疗及手术的局限性,使得放疗成为了治疗SCLC脑转移的主要方法。PCI可降低化疗完全缓解的局限期及部分缓解的广泛期SCLC患者脑转移的发生,并提高总生存期,成为其标准的治疗方法[2]。随着影像技术的进步,头MRI的应用使SCLC脑转移的检出率从以前的10%提高到24%[11],使得PCI的临床应用价值受到挑战。Ozawa等[12]对124例头MRI检查排除脑转移的局限期SCLC患者进行了分析,显示PCI组和无PCI组脑转移的发生率(P=0.313)及中位生存期(P=0.256)均无明显差异。Takahashi等[13]的临床试验也表明,PCI对于MRI证实无脑转移的广泛期SCLC患者并不是不可缺少的,只要定期头MRI随访即可。近期,Mamesaya[14]的研究进一步证实,对于MRI证实的无脑转移的局限期小细胞肺癌患者来说,即使前期放化疗效果良好,PCI也不能延长其生存期。这引起了笔者对于PCI临床应用的进一步思考。因为SCLC脑转移通常为多发,因此WBRT仍然为出现脑转移后的标准治疗,SCLC脑转移WBRT后局部及区域失败率仍很高,此时,再次WBRT将会引起严重的中枢神经系统并发症[15],而SRS作为挽救治疗的有效性及安全性值得笔者关注[5-7]。
此前文献报道SRS治疗SCLC脑转移的中位OS为3~10个月[5-9],而本研究的中位OS略高,为12个月,原因可能包括:(1)本研究中脑转移瘤直径小(最大径<3 cm的占89%),数目少(单发的占68%),这是影响 OS 的重要因素[7-8];(2)本研究中颅外无活性病灶者较多(61%),有利于延长OS[5];(3)DS-GPA评分[10]是最常用的与BM生存相关的评分系统,GPA为0分的预后最差,4分预后最好,本研究中所有患者的DS-GPA分数均≥1分,其中≥2.5分的为16例(57%),可能与延长OS相关。单因素分析显示,颅内转移瘤数目对OS有明显影响,结果同Nakazaki等[7]的研究一致;而以下因素都对OS无明显影响:年龄、性别、KPS评分等,结果与Olson等[6]一致。因此临床上选择寡转移且病灶直径小,DS-GPA评分高的SCLC脑转移患者,给予积极的SRS治疗颅内病灶,可能会获得相对较好的预后。
关于SCLC脑转移治疗的局控率及相关毒性反应一直受到广泛关注。WBRT治疗SCLC脑转移的缓解率达50%~80%[3],但是会产生与放射性脑病相关的并发症,多见于高龄患者,包括认知及情绪障碍等,或表现为神经系统障碍,发生在预处理期或治疗后[16]。研究表明,WBRT后出现的认知功能下降与海马区损伤相关,因此,WBRT时采取海马避免照射(hippocampal avoiding WBRT,HA-WBRT)会减少神经干细胞的损伤[17],从而减少认知功能的下降,已被成功应用于多种组织来源的脑转移瘤的治疗中。然而,Kirakli等[18]的研究发现SCLC患者中更容易出现海马区的脑转移瘤,发生率约为32%,尤其在≤65岁的患者中发生率更高,因此对于SCLC患者来说,海马区的低剂量照射有可能会增加海马区新发转移瘤的风险,HA-WBRT的应用还需进一步大样本的研究。相较于WBRT而言,随着近年来SRS的广泛应用,研究显示其治疗SCLC脑转移的局控率为57%~95%,与WBRT相近,且治疗后的放射性损伤相对较少[5-7]。本研究的局控率同以前的研究大致相同,单因素分析发现,年龄及颅内肿瘤的最大径可能会影响局控率。而本研究SRS治疗后的不良反应少,也同其他研究结论一致,提示了SRS的安全性。
值得提出的是,本研究中在发生放射性脑坏死的6例患者中,其中4例(67%)为WBRT失败后的挽救性治疗(BED分别为39.0Gy、30.48 Gy、25.55 Gy、50.8 Gy),2例(33%) 为 WBRT+SRS联合治疗(BED分别为26.75Gy、26.40 Gy),可以发现,联合治疗发生脑坏死的概率较低,而有研究表明放射性脑坏死的发生与BED相关[19],进一步分析显示,联合治疗的中位BED(27.2Gy)低于挽救性治疗的中位BED(32.55Gy),这可能是脑坏死发生率较低的原因,提示联合治疗模式可能会降低脑坏死的发生率。另外,Wegner等[5]的研究发现,4周内WBRT+SRS联合治疗模式与其余治疗模式相比,前者可提高OS(P=0.040),但作者提到由于联合治疗样本量小(仅6例),该结论的推广仍需进一步验证。而本研究中,单因素分析联合治疗模式与挽救性治疗模式对OS无明显影响(P=0.895),与上述研究结论相反,可能与联合治疗样本量也较少(仅13例)有关,但仍然提示尽管计划性治疗BED较低,但并不会降低患者OS。因此对于颅外肿瘤负荷低的SCLC脑转移患者,在WBRT治疗后残留的颅内病灶,SRS及时加量治疗有可能获得较高的颅内控制而且延长生存,并降低了病灶复发进展后挽救治疗的损伤毒性。
目前,在SRS治疗SCLC脑转移的应用中,SRS多作为WBRT失败后的挽救性治疗[6-7],其有效性及安全性得以证实,而本研究单因素分析发现SRS+WBRT联合性治疗模式与SRS作为挽救性治疗相比,对OS无明显影响(P=0.895),提示联合治疗的有效性。另外,Robin等[9]的研究表明SRS单独治疗与WBRT+SRS联合治疗相比,可以取得较好的生存期(中位生存期为10.8个月vs7.1个月,P<0.001),提示对于一些患者来说,单独SRS治疗可取得较长的生存期,但是还需要前瞻性的研究来进一步证实。
本研究有以下局限性,第一,本研究为回顾性研究;第二,本研究的样本量较小。本研究分析了SRS治疗SCLC脑转移的临床疗效,提示SRS作为WBRT失败后的挽救性治疗或与WBRT联合治疗均安全有效,同时,WBRT+SRS联合治疗模式不会降低患者的生存期,并且放射性脑坏死的发生率低,可能为较理想的治疗模式,但是关于SRS在SCLC脑转移中具体的治疗模式选择还需进一步大样本的数据研究。

