基于高通量测序对塔克拉玛干沙漠南缘2种多年生植物根际细菌及真菌群落结构的研究
高欢欢 曾凡江 赵秀芳 朱心宁 郭自春 张波 丁泽华

摘要 本研究利用高通量测序法(Miseq测序平台)对塔克拉玛干沙漠南缘2种多年生植物根际土壤微生物进行初步研究。结果表明,骆驼刺根际土壤中细菌分为16门、33纲、67目、129科、320属,柽柳根际土壤中细菌分为14门、30纲、66目、125科、335属;骆驼刺根际土壤中真菌分为8门、13纲、36目、58科、104属,柽柳根际土壤中真菌分为8门、13纲、34目、59科.92属。2种植物根际微生物群落结构种间存在差异,真菌差异大于细菌且丰度高。
关键词 根际微生物;高通量测序;多样性Miseq测序平台;塔克拉玛干沙漠
中图分类号 S154.36
文献标识码 A
文章编号 1007-5739(2019)08-0161-03
根际这一概念最早在1904年由德国科学家Hitner提出,是指根和土壤及其中间的一切物质。根际微生物在根际生态中占据重要地位,它能自由穿梭于根际中的“自由空间”,链接植物一土壤,参与养分运输与能量转换"。沙漠是典型的干旱生态系统,降雨稀少、沙漠化严重、土壤养分贫瘠是其主要特点叫,但是在世界各地沙漠的土壤中都发现了丰富的微生物,可培养数量达1.6x107个/gH。随着分子生物学的发展,高通量技术在土壤微生物多样性研究中广泛应用,更多种类的微生物区系已经在荒漠生态系统被发现,同时也为根际微生物生态学的研究奠定了技术基础。
塔克拉玛干沙漠南缘是典型的干旱生态系统,也是我国土地沙漠化最严重的地区之一。荒漠植被是维系干旱区生态系统安全的基础,加速自然植被的修复与重建依赖于主要植物生态学特性的深入了解。骆驼刺和柽柳作为这一地区的主要物种,在塔克拉玛干沙漠南缘形成优势群落,在防风固沙、维护脆弱过渡带生态中起到重要作用8駱驼刺作为豆科多年生木质化草本,具有较高含量的蛋白质,是家畜优良的饲料四。此外,骆驼刺植株可以分泌刺糖和油脂,具有良好的药用价值"0,柽柳根系寄生着有沙漠人参之称的管花肉苁蓉叫,2种植物都有很高的经济价值。但是由于过渡区开垦和药材采集过程中人类的过度砍伐和挖掘,2种植物受到了严重破坏。以往研究中主要关注水分、养分、盐分对其植被修复的影响12-14,未能探究根际微生态过程中能量与物质的转换机制。因此,探索根际微生物群落结构可为深人研究根系微生态中植物微生物一土壤协同作用机制奠定理论基础1。
本研究中基于第二代16SrRNA高通量测序技术,初步探讨了骆驼刺和柽柳根际士壤中细菌、真菌的群落结构多样性及其差异,为今后进一步揭示根际微生态过程中养分循环和能量转换提供参考和理论基础。
1材料与方法
1.1研究区概况
本研究依托策勒荒漠草地生态系统国家野外科学观测研究站开展。研究区位于策勒绿洲前沿。策勒位于昆仑山北麓,塔克拉玛干沙漠南缘,地处东经80*03'24"~82°10'34",北纬35917'55"~3930'00"。年平均合气温11.9C,极端最高气温41.9C,极端最低气温-23.9C年均降水量35.1mm,主要集中在5月和7月.蒸发量高达2595.3mm,干燥度20.8,无霜期平均约为209d,属于暖温带极端千旱区。年平均风速1.9m/s,沙尘暴和降尘是这一区域的主要生态灾害。策勒绿洲有9条季节性河流,均属于降水、积雪融水和冰川融水综合补给性河流。当昆仑山的融雪水超出河流容量时,就会出现夏季(7-8月)洪水。骆驼刺和柽柳是沙漠绿洲过渡带最重要的2种多年生植物。
1.2研究方法
1.2.1根际土壤取样。在沙漠绿洲过渡带骆驼刺和柽柳天然群落中各选取3个10mx10m的样方,每个样方中选取3~5株长势良好的植株进行挖掘,挖掘深度为1m。用抖土法抖落根上附着的土壤,用无菌刷刷取根上附着的土壤作为根际土将土壤样品放入无菌袋中储存在4C冰箱中。将3个样方获取的部分根际土混合均匀,过0.2mm筛,-70C冷冻以备DNA的提取。其余根际土风干后过0.2mm筛,用于土壤理化性质的鉴定。
1.2.2土壤理化性质检测。土壤含水量用铝盒法测定;土壤总有机碳含量用总有机碳分析仪检测(德国Elementar公司);土壤总氮含量用自动凯氏定氮仪检测(丹麦福斯公司);土壤速效磷用0.5mol/L碳酸氢钠浸提,用钼锑抗比色法测定;将土壤与蒸馏水按1:5质量比混匀用pH计和电导仪(上海精密科学仪器有限公司)测定pH值和电导率。
1.2.3DNA提取与扩增。土壤总DNA用Ezup柱式土壤DNA抽提试剂盒按说明提取。提取后用去RNA酶进行去RNA处理。
利用Qubit2.0DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应应加人的DNA量。利用Miseq焦磷酸测序平台对2种植物根际土壤细菌、真菌群落结构组成进行鉴定间。细菌PCR所用的引物已经融合了Miseq测序平台的V3-V4通用引物(融合341F引物为CCTACACGACGCTCTTCCGATCTN(barcode)CCTACGGGNGGCWGCAG;融合805R引物为GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC)。真菌PCR所用的引物同样已经融合了Miseq测序平台的真菌通用引物(融合MSQ一NS1引物为CCTACACGACGCTCTTCCGATCTN(barcode)GTAGTCATATGCTTGTCTC;融合MSQ-Fung引物为GACTGGAGTTCCTTGGCACCCGAGAATTCCAATTCCCCGTTACCCGTTG)。PCR扩增体系及反应条件参见文献。
1.2.4测序数据处理及微生物群落组成鉴定。数据预处理,采用Flash软件融合双末端序列,而后通过各样品barcode使数据回归样品,并对各样本序列做质量控制(QC)。QC之后序列长度大部分分布在400~600bp之间,平均长度均在440bp以,上,各样本序列数均在500以上,满足基本分析要求。质控后的序列长度为去除barcode、两端primer、以及部分低质量序列的统计结果。将多条序列按其序列间的距离对它们进行聚类,后根据序列之间的相似性作为域值分成操作分类单元(OTU),通常域值的序列相似性定为0.97,操作分类单元被认为可能接近于属。
采用软件RDPclassifier进行物种分类。RDPclassifier是基于伯杰分类,采用NaiveBayesianassignment算法对每条序列在属水平上计算其分配到此序列中的概率值。伯杰分类分为5层,它们依次为门、纲、目、科、属。
1.2.5微生物群落多样性分析。利用QIIME(Version1.50)软件计算样品的Alpha多样性值,计算Alpha多样性指标,包括丰富度指数、,Shannon指数ACE指数、Chaol指数Coverage等。丰富度指数用于衡量单个样本中物种种类个数,实际通过操作分类单元(OTU)的个数来计算。
2结果与分析
2.12种植物根际土壤理化性质对比
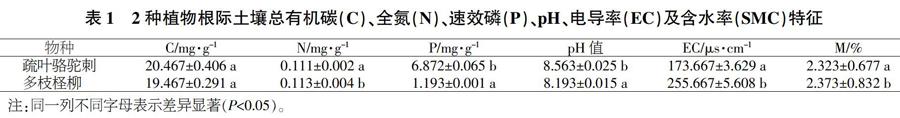
如表1所示,2种植物根际土壤总有机碳含量差异不显著(P>0.05)。駱驼刺根际土壤速效磷和pH值显著高于柽柳根际土壤(P<0.05),总氮含量、电导率及水分含量显著低于柽柳根际土壤。
2.22种植物根际土壤细菌群落结构及多样性比较
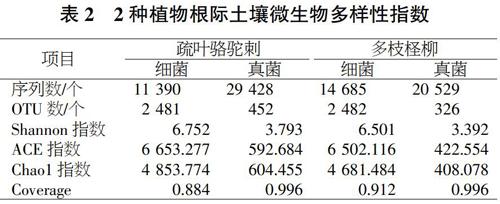
2个样本序列共聚类到26075个序列,其中骆驼剌根际土含11390个序列、柽柳根际土含14685个序列。质量控制处理后序列,基于97%的序列相似性,骆驼刺根际土获得2481个OTU,柽柳根际土获得2482个OTU。多样性指数结果如表2所示。骆驼刺根际土Shannon、ACE、Chaol指数均大于柽柳根际土,分别为6.752、6653.227、4853.774。Coverage小于柽柳根际土,为0.884。
经鉴定骆驼刺根际土壤中细菌分为16门、33纲、67目、129科、320属;柽柳根际土壤中细菌分为14门、30纲、66目、125科、335属。二者在门、纲、目、科分类级别上有相同的优势菌,为变形菌门(Proteobacteria)、a一变形菌纲(Alphaprote-obacteria)、根瘤菌目(Rhizobiales).红螺菌科(Rhodospirillac一eae);属级别优势菌不同,骆驼刺根际土壤中属级别优势菌为一个红螺菌科(Rhodospirillaceae)未被培养鉴定的菌属,柽柳根际士壤中为Steroidobacter。2种植物根际土中细菌丰度均超过1%的有12个属(图1),其中已被鉴定的属有Escherichia-Shigella、CandidatusMicrothrix、Sphingomonas、Fl一exibacterAzospira、Pelagibius、Planctomyces、Nitratireductor;其余未被培养鉴定,分别为uncultured_Rhodospirillaceae、unc-ultured_Nitrospinaceae、uncultured、Anaerolineaceae、uncultur-ed__Xanthobacteraceae。
2种植物根际土壤中有15个属的细菌丰度差异超过1%(图2)。骆驼刺根际土壤中含量较高的有7个属,其中已被鉴定的属有Pseudomonas、Ornithinibacter、Nitrosococcus、Blastocatella;其余未被培养鉴定,分别为uncultured_Gemm-atimonadaceae、uncultured_Rhodospirillaceae、Iachnospiraceae_Incertae_Sedis。柽柳根际土壤中含量较高的有8个属,其中已被鉴定的属为Amycolicicoccus、CandidatusXiphinemato-bacter、Rhizomicrobium、Planctomyces、Steroidobacter、Phenylo-bacterium;其余未被鉴定,分别为uncultured_Erythrobacterac-eae、uncultured_Flammeovirgaceae。骆驼刺根际土特有细菌有5个属(骆驼刺根际士中相对丰度大于0.1%,柽柳根际土中未出现),其中已被鉴定的属有Rhodanobacter、Inquilinus、Polaromonas、Pseudaminobacter,uncultured_Peptococcaceae未被培养鉴定。柽柳根际土特有细菌有2个属(柽柳根际土中相对丰度大于0.1%,骆驼刺根际土中未出现),分别为Reichenbachiella和千维杆菌科(Fib-robacteracea)一个未被培养鉴定的属。
2.32种植物根际土壤真菌群落结构及多样性比较
如表2所示,2种植物根际土壤真菌丰度及多样性值都小于细菌,2个样本真菌序列共聚类到49957个序列,其中骆驼刺根际土含29428个序列、452个OTU,柽柳根际土含20529个序列、326个OTU。与细菌多样性特征一样骆驼刺根际土Shannon、ACE、Chaol指数均大于柽柳根际土,分别为3.793、592.684.604.455。
骆驼刺根际土壤中真菌分为8门、13纲36目、58科、104属,各分类级别上优势菌分别为子囊菌门(Ascomyco-ta)、子囊菌纲(Sordariomycetes)、肉座菌目(Hypocreales)、赤壳科(Nectriaceae)、从赤壳属(Nectria);柽柳根际土壤中真菌分为8门、13纲、34目、59科.92属,各分类级别上优势菌分别为子囊菌(Ascomycota)、子囊菌纲(Sordariomycet-es)、散囊菌目(Eurotiales)、发菌科(Trichocomaceae)、青霉菌属(Penicillium)。2种植物根际土中真菌丰度均超过1%的有7个属(图3),分别为Acremonium、Nais、Nectria、Geosmithia、Orbilia、Pleospora、Geopyxis。
2种植物根际土壤中有26个属的真菌丰度差异超过1%(图4)。骆驼刺根际土壤中含量较高的有13个属,分别为Bionectria、Absidia、Beauveria、Phyllosticta、Volutella、Rhiz-ophagus、ThanatephorusActinomucor、GeopyxisMattirolomyces、Geomyces、Knufia、Nectria;柽柳根际土中含量较高的有12个属,分别为Penicillium、Cephalotheca、Phoma、PsathyrellaPlu-teus、UlosporaArachnomyces、MicroascusNais、Penidiella、Ma-durellaCochlonema。骆驼刺根际土特有真菌有6个属,分别为Mattirolomyces、Metarhizium、Stephanospora、Oxrporus、Col-letotrichum和被孢霉科(Mortierellaceae)一个未被培养鉴定的属;柽柳根际土特有真菌有6个属,分别为Corollospora、Taifanglania、XylariaCatenu-lostroma、Grosmannia、Diatrype。
3结论
(1)2种植物根际微生物群落结构在植物种间存在差异,真菌差异大于细菌,丰度高。
(2)极端环境微生物及新发现菌属较多,新发现菌属分离和功能鉴定在今后的研究工作中仍需要开展。
(3)特殊功能型微生物差异与养分等因素具体相关性和解释率需要进一步研究。
4参考文献
[1] ROVIRA A D.Plant root exudates{J].Botanical Review, 1969 ,35(1):35-57.[2] NOY -MEIR I.Desert ecosystems :environment and producers [J].AnnualReview of Ecology and Systematics, 1975,4:25-41.
[3] SKUJINS J.Microbial ecology of desert soils[J].Advances in MicrobialEcology , 1984,7:49-91.
[4] AMANN RI,LUDWIG W ,SCHLEIFER KH.Phylogenetic identification
and in situ detection of individual microbial cells without cultivation[J].Microbiol.Rev., 1995,59:143-169.
[5] BECERRA A,BARTOLONI N, COFRE N,et al.Arbuscular mycorrhizal
fungi in saline soils: Vertical distribution at different soil depth [J].Brazilian Journal of Microbiology , 2014 ,45(2):585-594.
[6]LIU J,SUI Y, YU Z,et al.Soil carbon content drives the biogeographical
distribution of fungal communities in the black soil zone of northestChina[].Soil Biology & Biochemistry,2015, 83(1):29-39.
[7] SHAMIR I, STEINBERGER Y.Vertical distribution and activity of soil
microbial population in a sandy desert ecosystem[J].Microbial Ecology,2007 , 53(2): 340- -347.
[8]朱軍涛,李向义,张希明,等.灌溉对疏叶骆驼刺幼苗光合生理指标及渗透物质的影响[J].中国沙漠,2009,29(4):697-702.
[9]曾凡江,张希明,李小明.骆驼刺植被及其资源保护与开发的意义[J].干旱区地理,2002,25(3):286-288.
[10]李君山,刘勇民,蔡少青.维吾尔医用骆驼剌类药材的资源、商品流通及民间应用研究[J].中国民族医药杂志,1996,2(2):39-40.
[11]张媛,屠鹏飞.柽柳属药用植物研究进展[D].中草药,2008,39(6):947-951.
[12]曾杰,曾凡江,郭海峰,等.策勒绿洲外围2种植物幼苗对NaCl的生理响应[J].千旱区研究,2008,25(5):673-678.
[13]郭海峰,曾凡江,SKARNDT,等.洪水灌溉对策勒绿洲优势植物及生境的影响[J].科学通报,2008(53):140-146.
[14]张利刚,曾凡江,袁娜,等.不同水分条件下疏叶骆驼刺(Alhagi
sparsifolia)生长季根系分株构型特征[J].中国沙漠,2013,33(3):717-723.
[15] BERG G,GRUBE M , SCHLOTER M,et al.Unraveling the plant micro-
biome : Looking back and future perspectives[J].Front Microbiol , 2014,5:1-6.
[16] CHAKRAVORTY S, HELB D, BURDAY M,et al.A detailed analysis of
16S ribosomal RNA gene segments for the diagnosis of pathogenicbacteria[J].Journal of Microbiological Methods ,2007 , 69(2):330-339.[17] WAKELINS A,COLLOFF MJ,HARVEY P R, et al.The effects of stubble
retention and nitrogen application on soil microbial community struc -ture and functional gene abundance under irrigated maize [J].FEMSMicrobiol.Ecol., 2007 , 59(3):661-670.

