14660例可疑医疗器械不良事件报告分析
曾茜,叶月华,杨翠连,何基琛,汤祖青,欧秋琦,庞婷
1. 广西医科大学 公共卫生学院,广西 南宁 530021;2. 广西壮族自治区医疗器械检测中心 业务科,广西 南宁 530021;3. 柳州市人民医院 质控科,广西 柳州 545006;4. 广西壮族自治区人民医院 骨科,广西 南宁 530021
引言
医疗器械广泛应用于疾病的预防、诊断、治疗、康复和保健中,随着时代科技的快速发展和人们需求的日益增高,医疗器械的数量大幅增加,医疗器械不良事件报告的数量也随之升高。对医疗器械不良事件进行监测和风险评价,能有效控制潜在的风险,保证用械安全[1]。2016 年,广西壮族自治区药品不良反应监测中心共收到可疑医疗器械不良事件报告14660 例,通过对医疗器械不良事件的基本情况、临床表现形式、涉及品种等内容进行分析,了解我区医疗器械不良事件监测的整体情况,进一步加强医疗器械不良事件监测工作,为更安全、有效地使用医疗器械提供参考。
1 资料与方法
1.1 资料来源
2016年1月1日至2016年12月31日广西壮族自治区药品不良反应监测中心收集到的14660 例可疑医疗器械不良事件报告。
1.2 分析方法
采用描述性研究分析方法,结合国家食品药品监督管理局制定的《医疗器械分类目录》[2],对可疑医疗器械不良事件涉及的器械进行分类,对报告数量、来源、使用场所、不良事件主要表现等进行统计和分析。
2 结果
2.1 基本情况
14660 例可疑医疗器械不良事件报告来自广西壮族自治区14 个地市,其中使用单位12666 例,占86.40%;经营企业1870 例,占12.76%;生产企业124 例,占0.85%。报告来源情况,见图1。
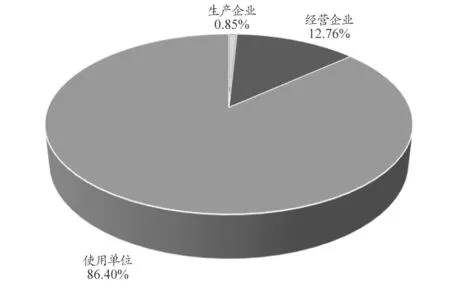
图1 14660例可疑医疗器械不良事件报告来源情况
2.2 患者情况
14660 例可疑医疗器械不良事件报告中,男性6469 例报告,占44.13%;女性8191 例报告,占55.87%。不良事件发生主要集中在21~40 岁的年龄段,占35.06%;0~10 岁年龄段的发生情况也很高。报告性别年龄统计表,见表1。
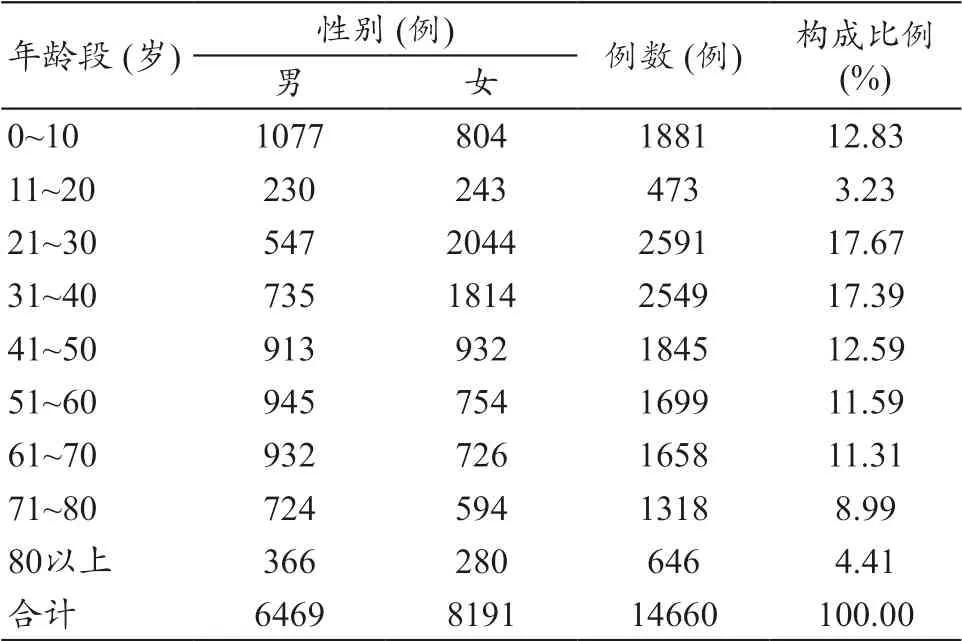
表1 14660例可疑医疗器械不良事件报告性别年龄统计表
2.3 报告人职业
14660 例医疗器械不良事件报告中,护士报告5451 例,占37.18%;医师报告5001 例,占34.11%;技师报告820 例,占5.59%;工程师报告517 例,占3.53%;个人或其他报告2871 例,占19.58%。报告人职业构成情况,见图2。
2.4 医疗器械情况
2.4.1 使用场所及操作人员类别
14660 例可疑医疗器械不良事件报告使用场所为医疗机构有12661 例,占86.36%;家庭1716 例,占11.71%;其他283 例,占1.93%。报告使用场所情况,见图3。操作人员为专业人员有12711 例,占86.71%;患者自己操作的有1388 例,占9.47%;非专业人员操作的有131 例,占0.89%;其他为197 例,占1.34%;未填写有233 例,占1.59%。
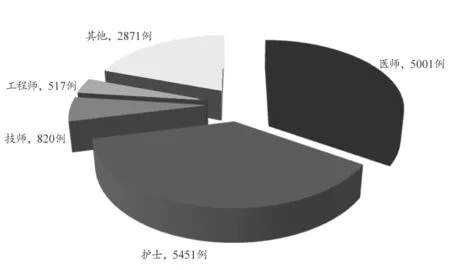
图2 14660例可疑医疗器械不良事件报告人职业构成情况
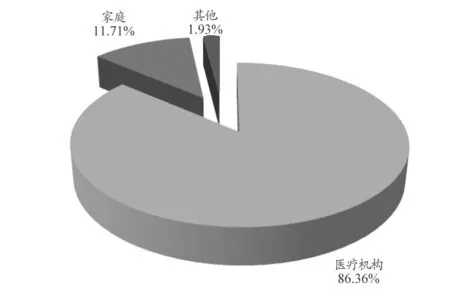
图3 14660例可疑医疗器械不良事件使用场所情况
2.4.2 医疗器械类别
在14660 例可疑医疗器械报告中,涉及Ⅲ类医疗器械7182 例,占48.99%;Ⅱ类医疗器械5710 例,占38.95%;Ⅰ类医疗器械1768 例,占12.06%。不良事件类别情况,见图4。
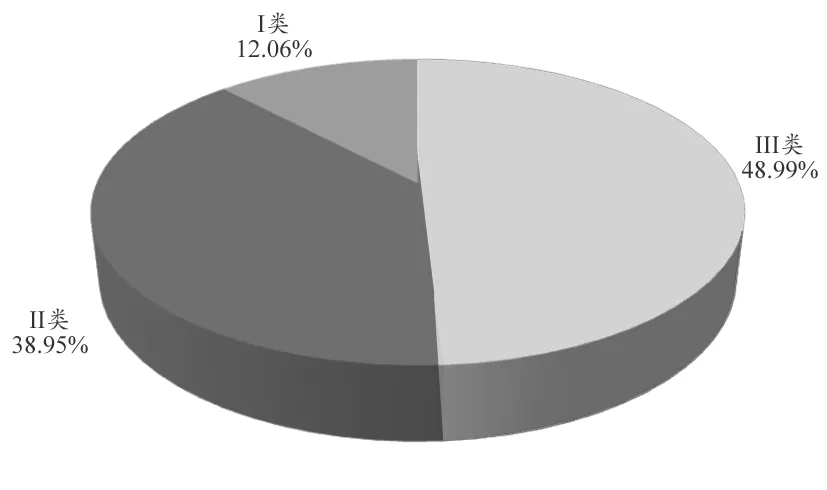
图4 14660例可疑医疗器械不良事件类别情况
2.5 报告情况
2.5.1 报告缺失情况
通过对14660 例可疑医疗器械不良事件报告信息缺失情况统计,结果显示报告地区、报告单位、注册证号、产品名称、生产企业名称、报告类型、事件初步处理情况、报告来源填写比较完整。联系地址、预期治疗的疾病与作用、事件发生日期、操作人员类别、初步原因分析、主要伤害、事件报告状态基本填写完整(>95%)。但存在产品名称填写不规范、发生原因描述不规范等情况,部分报告事件陈述缺乏对事件过程及对患者影响方面的填写;部分信息漏填、误填、错填,如患者电话、商品名称、产品编号、产品批号、生产企业电话和有效期等缺失项较多。报告信息缺失统计表,见表2。
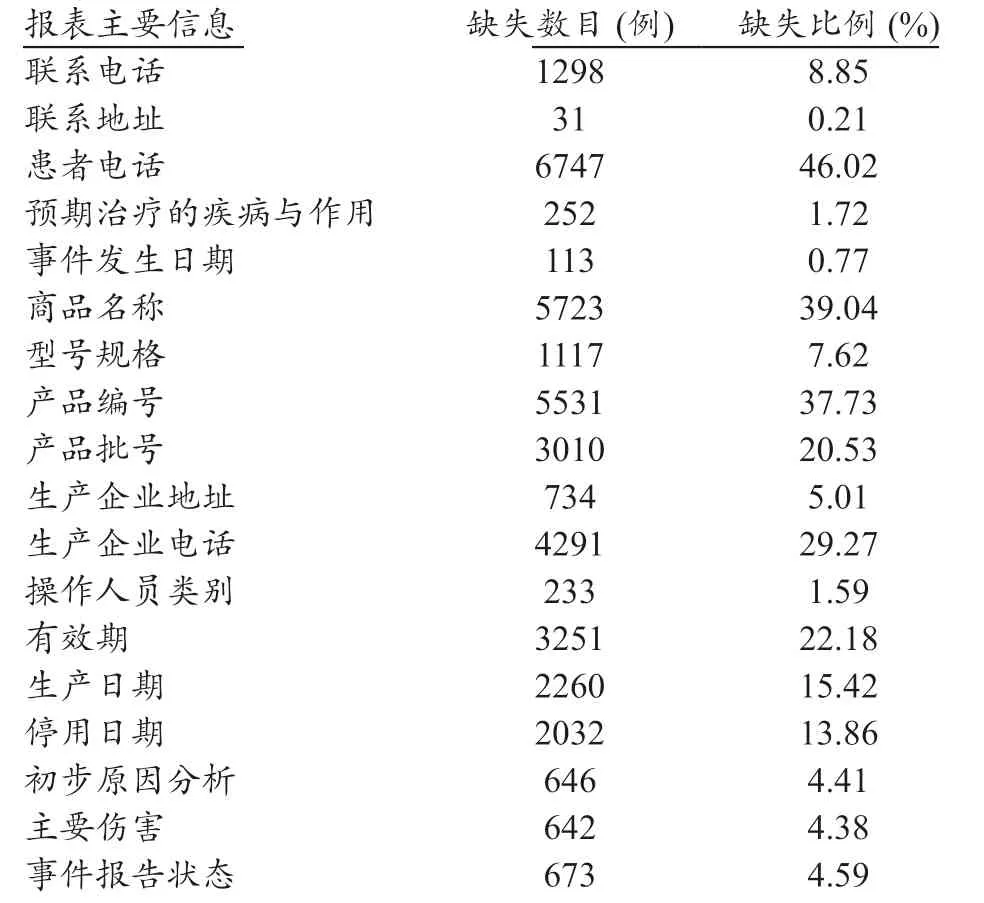
表2 14660例可疑医疗器械不良事件报告信息缺失统计表
2.5.2 报告前十位的医疗器械
14660 例可疑医疗器械不良事件报告前十位的医疗器械产品中,Ⅲ类医疗器械占68.41%,Ⅱ类医疗器械占21.66%,Ⅰ类医疗器械占9.93%。排前十位的报告主要涉及Ⅱ类、Ⅲ类医疗器械产品,见表3。从全区上报的不良事件报告中得出,报告类型为严重的有14658 例,占99.99%;死亡的有2 例,占0.01%。
3 讨论
3.1 一般情况分析
从报告来源看出,使用单位为报告的主要来源,占86.40%;生产企业上报最少,仅占0.85%。说明医疗器械使用单位上报意识较强,而生产企业上报相对缺乏主动积极性,对医疗器械不良事件监测工作的重要性和必要性认知不足。
从报告人职业、使用场所及操作人员类别看出,报告人职业主要为护士和医师,86.36%报告的使用场所为医疗机构,86.71%报告的操作人员为专业人员。这主要与医疗机构上报数量多和医疗器械使用主要在医疗机构有关。
从医疗器械类别来看,涉及Ⅲ类医疗器械的报告最多,占报告总数的48.99%,这体现了Ⅲ类医疗器械的高风险性,必须严格加以监测控制,保证其日后使用的安全性、有效性[2]。
3.2 报告缺失情况分析
在14660 例报告中,部分内容填写不够规范,存在漏填、误填、错填的情况,如产品名称不规范、注册证号填错、联系电话漏填等。报告信息内容不够简化清晰,缺失项较多,部分内容重复掺杂,还缺少事件后果的统计。应完善报告信息项目,开展专门的报告填写培训,提高各上报单位相关人员的有效报告能力,进一步提升报告质量和产品可追溯性,为医疗器械监管提供更真实全面、更科学的依据和建议[3]。
3.3 医疗器械不良事件报告分析
在14660 例报告中,数量排名较靠前的有宫内节育器、一次性使用输液器、静脉留置针等,这些产品大多为Ⅲ类医疗器械,临床使用频率高,用量大,潜在风险也比较大[4-7]。按照新修订的《医疗器械监督管理条例》(国令第680 号),对于具有高风险的医疗器械需采取特别措施严格控制,实现其安全管理和质量管理,突出溯源管理[8-9]。应针对相关品种加大监测力度和风险分析,开展专门的培训,采取更有效的管控措施减少不良事件的发生。
3.4 加强监测工作的培训宣传力度
针对我区医疗器械不良事件监测工作的整体情况,应加强对生产企业、经营企业开展分类别、侧重品种类型的培训,发放不良事件监测知识手册,制作专题宣传栏,提高其上报意识,遵循可疑即报原则,明确其责任主体地位[10-11]。
3.5 加强不良事件分析、评价和网络监测能力
开展医疗器械不良事件监测工作可以有效预防和减少不良事件的发生。应引入PDCA 循环质量管理机制,加强对监测报告的分析评价,建立健全监测数据库,通过定期对收集到的数据进行统计分析,从中发现有效的预警信号,为医疗器械上市后的安全性再评价提供有效支持,并为安全用械提供依据[12-14]。应完善医疗器械不良事件监测网络及报告制度,构建高素质监测的专业队伍,提高监测人员对医疗器械不良事件风险的认识,以便今后更好地开展实际监测工作[15-16]。

表3 可疑不良事件数量前十位的医疗器械统计表

