弱电解质在水溶液中存在电离平衡的实验探究新设计
陈云 林军

摘要: 依据弱电解质在水溶液中存在电离平衡的原理,运用LED灯、有源一体蜂鸣机、有关玻璃仪器以及手持技术改进传统实验。采用LED灯和有源一体蜂鸣机设计溶液导电性实验,利用CO2传感器和pH传感器探究碳酸钙与醋酸、盐酸反应,从溶液pH、 CO2浓度的变化速率和平衡移动三个角度同时说明醋酸溶于水后CH3COOH分子部分电离出CH3COO-和H+, CH3COOH在水溶液中的电离过程是一个可逆过程,醋酸溶于水后存在电离平衡。
关键词: 弱电解质溶液; 电离平衡; 实验探究
文章编号: 10056629(2019)7006804中图分类号: G633.8文献标识码: B
1 问题的提出
苏教版《化学反应原理》专题3“溶液中的离子反应”第一单元“弱电解质的电离平衡”中设计了如下的活动与探究: (1)测量物质的量浓度均为0.10mol/L的醋酸和盐酸的pH。用pH试纸分别测定溶液的pH,然后与标准比色卡比较,观察发现同浓度的醋酸和盐酸,醋酸的pH大于盐酸;(2)在两只锥形瓶中分别加入等体积、物质的量浓度均为1mol/L的醋酸和盐酸,在两个气球中分别加入经砂纸打磨过的表面积相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察、比较气球鼓起的快慢等现象。实验现象表明套在盐酸与镁条反应的锥形瓶口的气球鼓起较快,最终与醋酸的气球鼓起大小相同。
学生在对实验现象分析过程中可能会有以下疑惑: 除了pH和反应速率比较,是否有其他实验可以证明醋酸在水溶液中的电离情况呢?氢离子浓度不同,溶液的pH必然不同,与镁条反应速率也必然不同,这些都是可以直接推测出来的现象,是否有一些值得学生深度思考的实验设计呢?如何理解醋酸在水溶液中是部分电离,即醋酸的电离是一个可逆的过程呢?是否可以用实验证明?
传统实验一般利用瓶瓶罐罐探究,可以从宏观角度帮助学生理解一些问题,但是往往存在一些不足。新课程标准鼓励教师开发利用新技术、新方法辅助教学,进而帮助学生理解学习过程中的疑难性问题。
2 弱电解质在水溶液中存在电离平衡的实验探究
2.1 实验原理
醋酸是一种弱电解质,溶于水后,在水分子的作用下,CH3COOH分子电离成H+和CH3COO-;同时,一部分CH3COO-和H+又结合成CH3COOH分子。因此,CH3COOH在水溶液中的电离过程是一个可逆过程。因此,醋酸在水溶液中存在电离平衡,其电离过程可表示为: CH3COOHCH3COO-+H+。
本实验从两个角度设计实验分析醋酸在水溶液中存在电离平衡:
(1) 为验证相同浓度的醋酸、盐酸的电离程度不同影响溶液中离子的浓度,设计溶液导电性实验,通过LED灯的明亮程度和个数以及有源一体蜂鸣机的声音大小证明离子浓度不同。
(2) 为验证醋酸在水溶液中的电离是一个可逆的过程,设计利用pH传感器和CO2传感器,测定在一个密闭容器中,碳酸钙分别与醋酸、盐酸反应过程中CO2浓度变化以及溶液中氢离子浓度变化。通过真实数据清晰地从宏观和微观两个角度作具体说明。
2.2 实验药品与仪器
实验仪器: 计算机、Logger Pro 3(软件)、数据采集器、pH传感器、CO2传感器、78磁力加热搅拌器(江苏六鑫科教仪器设备有限公司)、天平、免焊式电路板、9V碳性电池、LED灯、有源一体蜂鸣机、导线、铁丝、滴管、磁力搅拌子、三颈烧瓶、铁夹、50mL烧杯实验药品: 碳酸钙、0.05mol/L CH3COOH溶液、0.05mol/L HCl溶液、0.1mol/L CH3COOH溶液、0.1mol/L HCl溶液
2.3 实验装置及操作要点
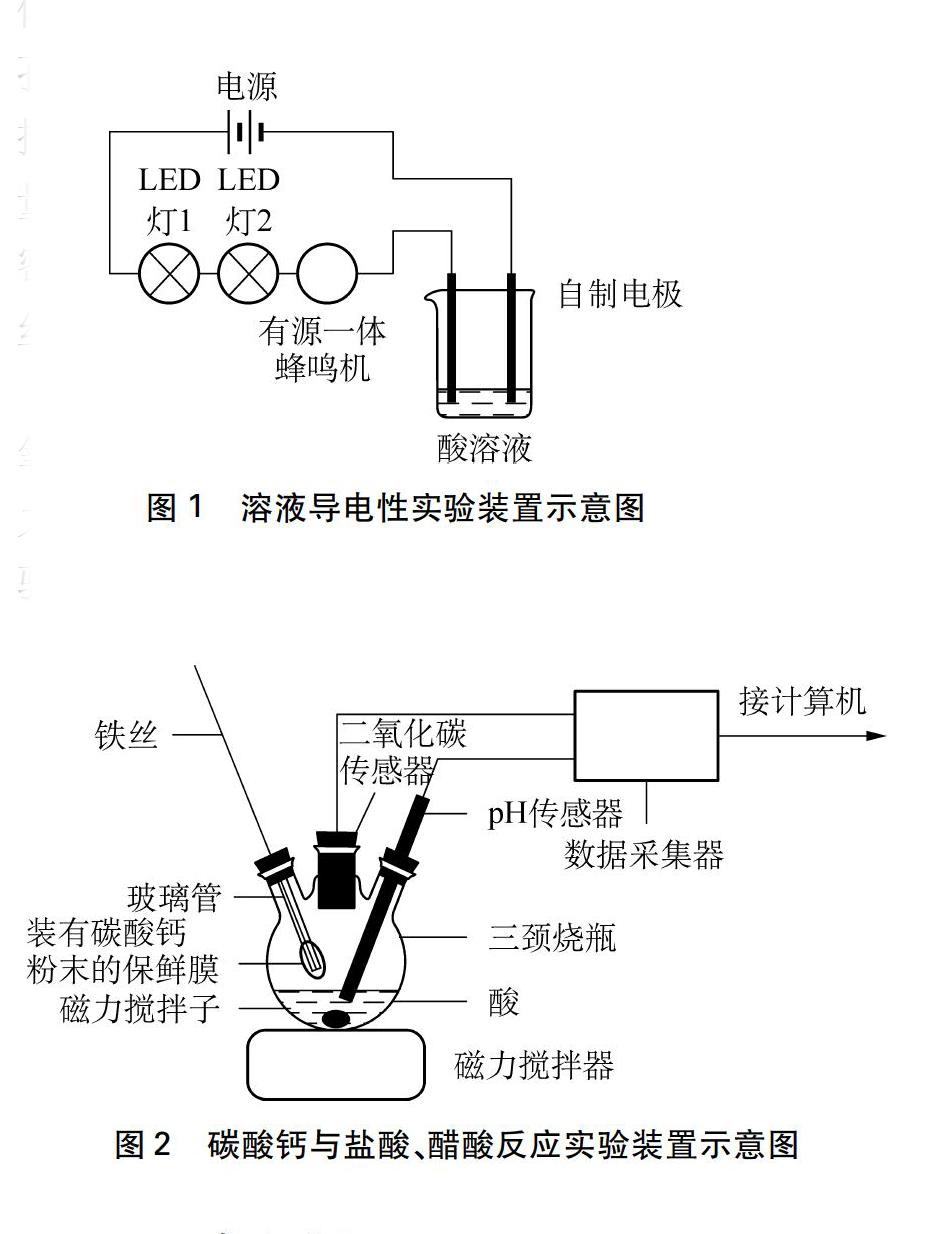
(1) 溶液导电性实验装置: 实验以白色展板为背景,用免焊式电路板将9V碳性电池、LED灯、有源一体蜂鸣机连接并与溶液串联,将导线穿过滴管制作成电极,比较溶液的导电性强弱。当有电流通过时,LED灯会亮起来,有源一体蜂鸣机会发出声音,若电流过小则没有声音。电路中的电流大小不同,观察到LED灯亮的数目和明亮程度不同,有源一体蜂鸣机发出声音的大小不同,以此来判断电解质溶液导电性的强弱。实验装置如图1。
(2) 碳酸钙与盐酸、醋酸反应实验中添加固体装置的制作: 将橡皮塞依据导管外径大小打孔,注意打到橡皮塞的一半处,不打通。将玻璃管插入孔中,再将铁丝穿过玻璃管。可称量一定质量的固体置于纸槽中,再倒入玻璃管中,用保鲜膜密封,注意不能将保鲜膜弄破。实验开始时,用铁丝戳破保鲜膜,固体进入溶液发生反应。
三颈烧瓶三个口分别插入添加固体装置、二氧化碳传感器以及pH传感器,瓶内放入一颗磁力搅拌子,在三颈烧瓶下方放置磁力搅拌器。实验装置如图2。
2.4 实验过程
2.4.1 实验探究1
分别取25mL 0.1mol/L HCl溶液和25mL 0.1mol/L CH3COOH溶液于两只50mL烧杯中,先将电极伸入HCl溶液中,觀察、记录实验现象;取出电极,用蒸馏水冲洗干净并擦干,再将电极伸入CH3COOH溶液中,观察、记录实验现象。
2.4.2 实验探究2
用USB数据线将计算机与数字采集器连接起来,将pH传感器、CO2传感器连接到数据采集器上。取50mL 0.05mol/L HCl溶液于三颈烧瓶中,放入磁力搅拌子,用天平称量0.5g的碳酸钙固体粉末(过量)装入添加固体装置中,用保鲜膜封好,并按照图2搭好实验装置。打开磁力搅拌器,点击数据采集,再将添加固体装置的保鲜膜戳破,使碳酸钙固体全部加入到HCl溶液中。观察曲线变化情况。取50mL 0.05mol/L CH3COOH溶液重复以上操作。
数据图像纵轴选择pH和CO2浓度(ppm),横轴选择时间(s),开启仪器采集数据,观察溶液pH和CO2浓度随时间变化情况。实验结果如图3、图4所示。
① 0.05mol/L HCl溶液(pH)
② 0.05mol/L CH3COOH溶液(pH)
③ 0.05mol/L HCl溶液(CO2)
④ 0.05mol/L CH3COOH溶液(CO2)
2.5 结果与讨论
(1) 实验探究1观察到,电极伸入醋酸溶液中LED灯部分明亮,有源一体蜂鸣机不响;电极伸入盐酸溶液中LED灯明亮的个数比醋酸多,且有源一体蜂鸣机响。说明相同浓度的盐酸与醋酸溶液,HCl电离出的H+浓度大于醋酸电离出的H+浓度,HCl的电离程度大于CH3COOH。已知HCl是完全电离,则醋酸是部分电离出H+和CH3COO-。
(2) 由图3曲线①和②初始pH数值可以看出0.05mol/L CH3COOH溶液的pH大于0.05mol/L HCl溶液,依据HCl完全电离出H+,说明CH3COOH溶于水后部分电离出H+和CH3COO-。
由图4曲线③和④可以看出随着反应的进行,密闭容器中CO2的浓度逐渐上升,密闭容器中碳酸钙与盐酸反应生成的CO2浓度上升速率大于醋酸溶液。浓度是化学反应速率的影响因素之一,溶液中H+浓度越大,与碳酸钙反应速率越快。实验数据说明醋酸溶液中H+浓度小于盐酸中H+浓度,进一步证明了CH3COOH溶于水后部分电离出H+和CH3COO-。
由图3曲线①和图4曲线③可以看出,随着碳酸钙与盐酸反应的进行,溶液中H+浓度逐渐减小,生成CO2速率逐渐降低,当H+反应完全,密闭容器中CO2浓度基本不再发生变化。说明H+消耗完全后,不再生成CO2。
由图3曲线②和图4曲线④可以看出,碳酸钙与醋酸溶液反应,初始一段时间CO2浓度上升较快。随着反应的进行,溶液中H+浓度减小且基本不再发生变化,而CO2浓度虽然上升较慢,但是仍然在不断生成。反应初始时速率较快主要是由于初始时与碳酸钙反应的是醋酸溶液中原有的H+;随着碳酸钙与醋酸反应的进行反应速率逐渐降低,是由于溶液中H+浓度逐渐减小;经过一段时间后,溶液中H+浓度不再发生变化,而CO2仍然在持续产生,依据勒夏特列原理,溶液中H+逐渐减少,平衡向抑制H+逐渐减少的方向移动,即平衡向CH3COOH分子电离出H+的方向移动,不断补充由于H+消耗而减小的浓度,从而保证反应不断持续进行,且pH基本保持不变。从平衡移动的角度说明CH3COOH溶于水后部分电离出H+和CH3COO-,并且存在电离平衡。
2.6 结论
本实验借助LED灯和有源一体蜂鸣机来判断溶液导电性的强弱;利用有关玻璃仪器以及手持技术,通过观察在密闭容器内CO2浓度、溶液pH随着时间的变化曲线,从pH、 CO2浓度的变化速率和平衡移动三个角度同时说明醋酸溶于水后CH3COOH分子部分电离出CH3COO-和H+,即醋酸溶于水后存在电离平衡。
3 反思与启示
在具体的教学实践中,很多概念和规律都很抽象,常规教学手段有时很难突破教学难点。弱电解质溶于水存在电离平衡是化学反应原理中较为抽象的知识点之一。有趣的实验现象、新技术的运用不仅可以活跃课堂气氛,还能化抽象为直观,易使学生理解所学内容,突破教学难点,从而优化课堂教学效果。
溶液导电性实验的设计,利用生活中可以找到的物品来改进实验,将化学和手工制作结合在一起,无形中体现了实验的生活化,拉近了学生与实验之间的距离,提高了学生学习化学的兴趣[1]。借助LED灯和有源一体蜂鸣机来判断电解质导电性的强弱,既增加了趣味性,又体现了将抽象知识具体化的思想,便于学生记忆和掌握。溶液导电实验应用在初、高中化学教学中,既能作为演示实验也能作为学生实验。数字化实验利用双传感器进行实验探究,将无法用肉眼清晰观察到的现象转化为可视化的数据展示出来,以表征溶液中微粒的浓度变化,进而研究醋酸在水中的电离过程,该方法更直观、更精确、更数字化。图像分析过程中发现,该实验设计可以同时从三个不同角度验证弱电解质的电离平衡,充分体现了该实验装置的内涵及其价值。
本实验两个装置不仅可以用于弱电解质的电离平衡的教学中,还可以运用于其他方面。如溶液导电性实验装置还可以设计成电解质与非电解质判断实验、氨气溶于水的性质实验等;如数字化实验碳酸钙与盐酸反应可以改成化学反应速率模块的实验,从溶液中反应物H+浓度的下降速率和密闭容器中CO2浓度的上升速率两个角度说明化学反应速率的概念。一个装置多种用途,充分体现了本实验设计的功能性价值。
实验过程中发现有以下几方面可作进一步设想。
(1) 真实情境实验设计。化学新课程标准中不断提到教师在选择教学素材时最好选用与生产、生活相关的案例进行分析。设计弱电解质的电离平衡时,在素材选择上陷入了困境,很难找到一个学生熟悉的生活中的问题进行探究。是否可以从生活、生产实践中找一个真实案例进行实验设计研究呢?
(2) 改进实验装置的应用。本实验设计中的两个实验在我校化学组教师教学中引起了较好的反响,充分说明实验改进后能很好地帮助教师在突破教学难点时起到积极的作用,意义不再是改进后的实验装置本身,而是其应用价值。本实驗设计除了本文中提到的相关应用,是否还可以运用于其他实验教学中呢?
(3) 平衡移动的实验设计。数字化实验设计中平衡移动理论是建立在学生已经学习了化学平衡的知识基础上进行分析的[2],但是移动的方向是CH3COOH电离出H+和CH3COO-的方向,逆向的设计呢?能否再作进一步改进?因此后续工作还有很多,需要不断探究。
参考文献:
[1]马善恒, 夏建华, 姚如富. 运用数字化实验探究氯水中化学平衡的存在[J]. 化学教学, 2017, (7): 71~73.
[2]李妍. 浅谈手持技术在“弱电解质的电离平衡”教学中的功能[J]. 中学化学教学参考, 2016, (1): 69.

