中草药日本鸢尾内生真菌的分离及其初步鉴定
李盼 武才琪 王庆林

〔摘要〕 目的 分析日本鸢尾(Iris japonica)内生真菌的类群分布。方法 通过菌落形态特征、显微镜下的孢子观察及基于ITS序列分析的分子生物学鉴定分析日本鸢尾各部位内生真菌的类群组成。结果 从日本鸢尾的根茎叶中共分离得到5种内生真菌。根中分离得到的内生真菌为橘青霉(Penicillium citrinum)、尖孢镰刀菌(Fusarium oxysporum),茎中为小新壳梭孢菌(Neofusicoccum parvum),葉中为橘青霉(Penicillium citrinum)、肉色隔孢伏革菌(Peniophora incarnata)、首都叶点霉(Phyllosticta capitalensis)。结论 自日本鸢尾分离获得5种内生真菌,其分布具有一定的组织特异性,可为药用植物内生真菌的开发和利用提供一定基础。
〔关键词〕 日本鸢尾;内生真菌;分离;鉴定
〔中图分类号〕R284;R372 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.02.011
内生真菌是指一类生活在植物组织内部而不使宿主植物产生明显病害症状的真菌[1-2]。植物内生真菌以其丰富的多样性和复杂性,作为微生物资源宝库之一,具有巨大的潜能,而且具有生物活性化合物的比例明显比土壤来源的微生物高[3],因此,植物内生真菌的分离、鉴定、生物活性物质、次级代谢产物活性的研究近年来已经成为国内外学者研究的热点[4-7]。日本鸢尾(Iris japonica Thunb)是天门冬目鸢尾科的草本植物,又名蝴蝶花、白花射干,原产地是中国、日本和韩国,其性寒、味苦,具有清热解毒、消痰、利咽的功能,在临床上对治疗咽喉炎有很好的疗效,特别用于治疗喉头痉挛水肿效果尤好,此外,与其他中药配伍对感冒、气管炎、慢性胃炎、肝炎都有一定疗效,因此,该植物具有较好的应用前景[8]。目前对日本鸢尾中的内生真菌研究尚未见报道。通过选择健康的日本鸢尾植物组织作为内生真菌分离的材料,对日本鸢尾的根、茎、叶等部位的内生真菌进行系统的分离和类群鉴定分析,以期不断地丰富内生真菌资源,为开发利用药用植物内生真菌提供基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 日本鸢尾采自湖南师范大学医学院院内中药园,经本院药用植物教研室赵冰清教授鉴定后,采集其根、茎、叶,将样本存放在冰盒中运送回实验室中,保证其处于低温干燥的环境中。5 h内对采集样本进行处理,进行内生真菌的初步分离[9]。
1.1.2 培养基 马铃薯葡萄糖琼脂(PDA)培养基。
1.1.3 主要仪器与设备 BSG-4生物安全柜(造鑫企业有限公司);SHP-250生化培养箱(上海精宏实验设备有限公司);LD2X-50FA立式压力蒸汽灭菌器(上海申安医疗器械厂);101-2AB电热鼓风干燥箱(天津市泰斯特仪器有限公司);ZD-85气浴恒温振荡器(江苏金坛市医疗仪器厂);SIGMA 3K3OH冷冻高速离心机(德国SIGMA公司);G:BOXF3电泳凝胶成像分析仪(基因有限公司);ABI2720 PCR仪(美国ABI公司);超净工作台(苏州净化设备公司);国之源纯水器(湖南科尔顿水务有限公司);琼脂糖凝胶电泳仪(北京市六一仪器厂);普通光学显微镜(日本Olympus公司);倒置荧光相差显微镜(日本Olympus公司)。
1.1.4 试剂 HP真菌DNA小量抽提试剂盒(OMEGA公司);核酸染色剂(北京索莱宝科技有限公司);RNase A(MP生物医学公司);2×Taq预混PCR反应体系(北京康润生物科技有限公司);琼脂糖(BioFroxx公司);5×TBE、通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′(上海生工生物工程公司);500 bpDNA Ladder(天根生化科技有限公司);分析纯次氯酸钠、无水乙醇、β-巯基乙醇、三氯甲烷、异丙醇(上海国药集团化学试剂有限公司)。
1.2 方法
1.2.1 日本鸢尾内生真菌的分离 日本鸢尾的根、茎、叶先用自来水洗去表面泥渍,最后用无菌水冲洗一遍,再放入培养皿内铺平晾干后在超净工作台内进行严格的表面消毒[10]:75%乙醇1 min、次氯酸钠溶液(3%~5%有效氯)3 min、75%乙醇0.5 min,后用无菌水冲洗4遍,采用两种对照试验来进行消毒效果检测[11-12]:一是漂洗液检测法,把最后一遍冲洗水涂布在PDA培养基上,放置于28 ℃恒温培养箱中培养7 d;二是组织印迹法,将已经灭菌的根茎叶分别压入PDA培养基中,使样品与培养基紧密接触20 min,接着移去灭菌植物样品,将培养基同样放置在28 ℃恒温培养箱中培养7 d。对消毒好的样品晾干,在超净工作台中用无菌剪刀将根茎叶分别剪成大小约0.5 cm×0.5 cm的小组织块,均匀的平铺在PDA平板中,同时做好标记,28 ℃恒温培养1~2周,待菌落长出后根据菌落特征的不同再来进行分离,最后将完全纯化的内生真菌保存于4 ℃冰箱备用。
1.2.2 内生真菌的形态学鉴定 通过传统的形态学鉴定方法,参照相关真菌书籍对分离得到的内生真菌进行鉴定[13-14]:主要从菌落的大小、颜色、质地等肉眼特征和孢子的颜色、形状、产孢结构类型、孢子大小等显微特征进行初步判断和分类。
1.2.3 内生真菌的分子生物学鉴定 将分离培养好的内生真菌接种到含有50 mL PDB的锥形瓶中,每种接种4瓶。26 ℃,180 r/min振荡培养2~7 d,待其发酵浑浊后离心取其沉淀,将沉淀放入50 ℃烘箱中过夜干燥备用。称取10~50 mg的干燥沉淀至事先已灭菌的研钵中,加入液氮充分研磨后转入1.5 mL的离心管。按照真菌DNA提取试剂盒说明书提取真菌DNA。将所提DNA放置于-20 ℃条件下备用。利用真菌ITS1与ITS4通用引物(委托上海生工生物工程公司合成)对提取的DNA产物进行PCR扩增[14],反应体系20 μL∶7 μL ddH2O、10 μL 2×Taq PCR StarMix with Loading Dye、1 μL正向引物、1 μL反向引物、1 μL DNA模板。PCR扩增反应条件:预变性94 ℃,3 min;变性94 ℃,30 s;退火55 ℃,30 s;延伸72 ℃,1 min。共30个循环后,72 ℃再延伸7 min,4 ℃保存。将扩增好的PCR产物进行琼脂糖凝胶电泳,在凝胶成像仪下500 bp处有明显条带出现。最后委托湖南省擎科生物技术有限公司进行测序,测序后将真菌ITS序列在NCBI数据库中进行BLAST(http://blast.ncbi.nim.nih.gov/Blast.cgi)比对,来获得所提内生真菌的分子生物学鉴定信息。
2 结果
2.1 消毒效果的检测
把最后一遍冲洗水涂布在PDA培养基上,放置于28 ℃恒温培养箱中培养7 d,无菌落长出。同时将已经灭菌的根茎叶压入PDA培养基中,使样品与培养基紧密接触20 min,移去灭菌植物样品,同样放置在28 ℃恒温培养箱中培养7 d也未观察到真菌生长。以上结果充分证明,经过严格的表面消毒程序后,附着在植物表面的菌类已经被彻底消除,分离得到的菌株来自于植物体内部,属于内生真菌。
2.2 日本鸢尾内生真菌的分布和分子生物学鉴定结果
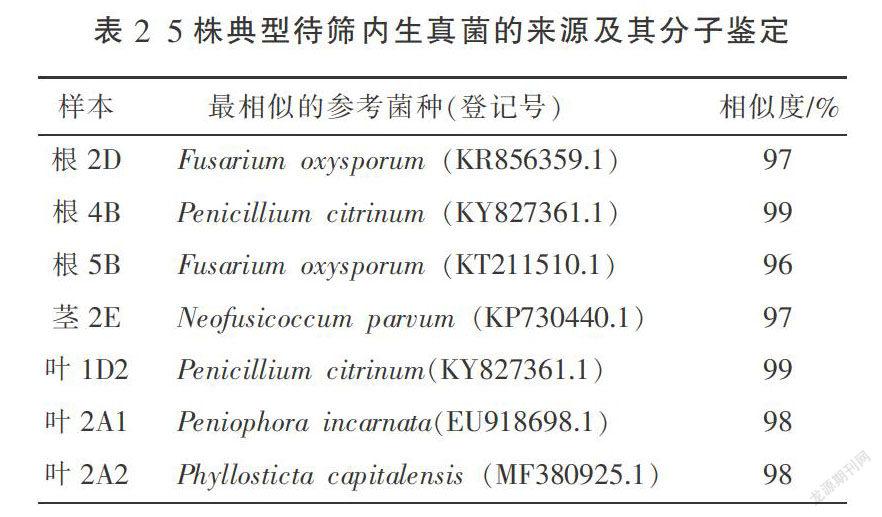
从日本鸢尾的根、茎、叶中共分离纯化出5种20株内生真菌,分别为橘青霉、尖孢镰刀菌、肉色隔孢伏革菌、首都叶点酶(有性形为球座菌属(Guignardia))和小新壳梭孢菌。菌落特征和显微特征描述见表1,分子鉴定结果见表2。通过基于测序结果将内生真菌ITS序列在NCBI数据库中进行BLAST比对后,收集同源性比较高的比对序列,通过邻接法构建系统发育树,其同源性分别是:R1为100%;R2为100%;R3为84%,R4为87%;R5为64%。R1代表根4B和叶1D2的ITS序列,R2代表根2D和根5B的的ITS序列,R3代表叶2A1的ITS序列,R4代表茎2E的ITS序列,R5代表叶2A2的ITS序列。结果表明其同源性都大于50%,根据系统进化树原理[16],ITS同源性支持形态学上R1、R2、R3、R4和R5菌株分别鉴定为橘青霉、尖孢镰刀菌、肉色隔孢伏革菌、小新壳梭孢菌和首都叶点酶。因为植物内生真菌在培养过程中受外在条件的影响易发生变异,因此,需综合考虑来对其进行分类鉴定。
3 讨论
通过形态学以及分子生物学鉴定方法的研究表明:日本鸢尾的根、茎、叶中都存在一定量的内生真菌,并且在植物的组织部位上及内生真菌的属别上均体现出一定的专一性,这可能是由于内生真菌受宿主植物不同组织部位微环境差异的影响,如光照强度、湿度、气温变化等的影响[17],同时不同组织中也含有共同的菌群,表明内生真菌在组织分布上既具有差异性又具有共同性。研究表明内生真菌自身也能产生各种类型的生物活性物质,而且很多内生真菌可能也带有植物体的酶系,具有与宿主相同或类似生理活性的次级代谢产物,与宿主长期地共同进化并产生协同作用[18]。姚裕群等人对越南槐中内生真菌的多样性、抑菌活性及其次生代谢产物研究发现其抗菌资源丰富,多个菌株显示了与宿主相似的强抑菌活性,对白色念珠菌、大肠杆菌和金黄色葡萄球菌等人体病原菌具有明显的抑制作用[6],有学者从药用植物鸦胆子的根、茎、叶和果实中共分离出83株内生真菌,且拟茎点霉属中的菌株YJ-17对靶向微生物具有较好的抑制作用[7]。今后我们将进一步开展日本鸢尾内生真菌次级代谢产物及其生物活性的研究。
参考文献
[1] STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an Endophytic fungus of Pacific yew[J]. Science,1993,260(5105):214-216.
[2] BEZERRA J D P, NASCIMENTO C C F, BARBOSA R D N,et al. Endophytic fungi from medicinal plant Bauhinia forficate:Diversity and biotechnological potential[J]. Brazilian Journal of Microbiology, 2015,46(1):49-57.
[3] STROBEL G A. Endophytes as sources of bioactive products[J]. Microbes and infection, 2003, 5(6):535-544.
[4] 王志偉,纪燕玲,陈永敢.植物内生真菌研究及其科学意义[J].微生物学通报,2015,42(2):349-363.
[5] 古海刚,白红进,曾艳波,等.中国红树植物角果木内生真菌的分离及其初步鉴定[J].微生物学杂志,2012,32(6):1-6.
[6] 姚裕群,越南槐内生真菌多样性、抑菌活性及其次生代谢产物研究[D].南宁:广西大学,2017.
[7] LIANG Z N, ZHU H, LAI K P, et al. Isolation of endophytic fungi from medicinal plant Bruea javanica and their microbial inhibition activity[J]. Journal of Chinese Medicinal materials, 2014,37(4):564-658.
[8] 黄康泰.现代本草纲目[M].北京:中国医药科技出版社,2001.
[9] 刘兆迪,解修超,陈文强,等.药用植物三尖杉内生真菌的分离鉴定及抗菌活性[J].中国实验方剂学杂志,2014,20(9):128-132.
[10] 王利娟,贺新生.植物内生真菌分离培养的研究方法[J].微生物学杂志,2006(4):55-60.
[11] 李 军,李 白,高广春.药用植物内生菌抑菌作用研究进展[J]. 浙江农业科学,2017,58(11):1989-1992.
[12] 罗利琼,谢华荣,邓祖军,等.蚌花内生真菌类群分布及抗菌、抗肿瘤活性的初筛[J].广东药学院学报,2016,32(6):683-689.
[13] 戴芳澜.真菌的形态和分类[M].北京:科学出版社,1987.
[14] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1982.
[15] 郭顺星.药用植物内生真菌生物学[M].北京:科学出版社,2016.
[16] 黄琪佳,吴 敏,黄玉莹,等.鸢尾内生真菌Fusarium oxysporum YW1的分离鉴定及其次生代谢产物的研究[J].华中师范大学学报(自然科学版),2016,50(6):880-885.
[17] 胡克兴,侯晓强,郭顺星.铁皮石斛内生真菌分布[J].微生物学通报,2010,37(1):37-42.
[18] TAN R X, ZOU W X. Endophytes: a rich source of functional metabolites[J]. Natural Product Reports, 2001,18(4):448-459.

