水稻CIPK基因家族的鉴定及OsCIPK5受稻瘟病菌诱导的qRT-PCR分析
喻丝丝 罗曦 连玲 许惠滨 陈丽萍 魏毅东 蔡秋华 谢华安 张建福


摘要:【目的】植物通过启动一系列信号传导过程来应对外部环境,这些过程通常涉及多种蛋白激酶,包括钙调神经磷酸酶B样蛋白互作激酶(calcineurin B-like protein-interacting protein kinases,CIPKs)。為更加清晰全面地了解水稻CIPK基因家族,本研究根据最新的基因组测序数据对水稻基因组中的CIPKs进行了鉴定。【方法】通过探讨拟南芥和水稻中CIPKs蛋白家族的结构特点,结合生物信息学和qRT-PCR技术系统分析水稻中CIPKs家族蛋白的结构。结合转录组数据,比较了粳稻云引受稻瘟病菌诱导后的表达情况。【结果】根据最新的水稻基因组数据,鉴定出31个水稻OsCIPK基因。系统发育树分析结果表明,31个OSCIPK基因可分为5个亚家族,这些亚家族具有不同的外显子一内含子和UTR的结构特点。从广谱抗稻瘟病品种粳稻云引受稻瘟病菌诱导的基因表达谱的趋势聚类中筛选出了OsCIPK5基因并对其进行了表达分析,结果表明,云引中OsCIPK5基因受稻瘟病菌的诱导表达。【结论】内含子缺失和片段重复在水稻OSCIPK基因家族的扩展中起到重要作用,同时OsCIPK5受到稻瘟病菌的诱导表达。
关键词:水稻;CIPK;基因家族;OsCIPK5;稻瘟病菌;qRT-PCR
中图分类号:S511 文献标志码:A 文章编号:1008-0384(2019)11-1237-09
0 引言
【研究意义】植物利用多种信号转导途径对外界环境做出响应,细胞内钙浓度的瞬时升高是机体对非生物胁迫和生物胁迫等多种信号响应的主要事件少习。高等植物表达几个主要的钙传感器家族,包括钙调蛋白(calmodulin,CaM)、CaM相关蛋白、CBL蛋白以及钙依赖蛋白激酶(calcium-dependentprotein kinases,CDPKs)[6-10]。CBL蛋白通过激活靶蛋白,如CBL互作蛋白激酶(CBL-interacting proteinkinases,CIPKs)来触发Ca2+介导的信号网络。植物CIPK的N端含有一个Ser/Thr蛋白激酶结构域,C端含有一个NAF结构域。拟南芥中的CIPK蛋白最初被称为SOS2蛋白激酶(Sail overly sensitive 2,SOS2),激活的CIPK可通过磷酸化下游信号元件来转导钙信号[11]。在拟南芥中,含有SOS3(CBL蛋白)[12-13]、SOS2(CIPK蛋白)[12-14]和SOS1(被SOS2激活的Na+/H+反向运输载体)[15-17]的SOS通路在Ca2+信号转导中的作用已被详细解析,其可以在盐胁迫条件下维持离子稳态[11,13,15,18-19]。【前人研究进展】前人基于基因组的分析表明,拟南芥中存在25个AtCIPK基因,水稻中存在30个OsCIPK基因[20-22]。Kolukisaoglu等[20]报道了30个水稻基因组中的OsCIPK基因,并将它们分别命名为OsCIPKI至OsCIPK30。研究表明,干旱、盐碱化、低温、聚乙二醇(PEG)或脱落酸(abscisic acid,ABA)等非生物胁迫可诱导20个OsCIPK基因的转录[21]。3个OsCIPK基因(OsCIPK3,OsCIPK12和Os CIPKI $)的过表达分别显著提高了转基因植物对低温、干旱和盐胁迫的耐受性[21]。Chen等[22]分离鉴定了15个OsCIPK基因,基因表达分析表明,这些基因可不同程度地被生物胁迫,如:白叶枯病菌和非生物胁迫(重金属、高盐度、低温和ABA)诱导表达。其中,经白叶枯病菌感染后,5个OsCIPK基因(OsCIPK1、2、10、11和12)转录上调,另有4个OSCIPK基因(OsCIPK2、10、11和14)受所有胁迫处理诱导,表明这些OsCIPK基因参与了多个胁迫反应途径和/或植物的抗病反应。【本研究切入点】虽然CIPK基因家族在许多植物中得到了广泛的研究,但是目前对水稻CIPK蛋白的认识还很有限。由于CIPK基因在植物多种生理功能中发挥重要作用,因此,对水稻CIPK家族成员进行系统的研究具有重要意义。【拟解决的关键问题】在本研究中,我们利用EnsemblPlants(http://plants.ensembl.org/)数据库和UniProt(https://www.uniprot.org/uniprot/)蛋白数据库的最新基因组数据鉴定出了31个水稻CIPK基因,进一步研究了该基因家族成员的外显子一内含子的结构、基序组成、基因复制、染色体分布、系统发育和同源性等,并分析了粳稻云引中OsCIPK5基因受稻瘟病菌诱导的表达情况,为水稻CIPK基因家族成员的功能鉴定提供了有价值的线索。
1 材料与方法
1.1 水稻CIPK基因家族的鉴定
在Ensembl Plants(http://plants.ensembl.orgo数据库下载水稻和拟南芥基因组序列文件,用TBtools软件从基因组序列中提取CDS序列,再转换成蛋白质序列。
在UniProt(https://www.uniprot.org/uniprot/)蛋白数据库下载水稻或拟南芥CIPK基因家族蛋白序列,用HMMER 3.0软件建模并搜索水稻或拟南芥中CIPK基因家族的成员,去掉序列重复的成员,筛选后的家族成员在NCBI(https://www.ncbi.nlm.nih.gov/Structure/bwrpsbo预测保守结构域,根据CIPK基因家族的保守结构域,验证基因家族中序列异常的成员,并对其进行手动校正。等电点、分子量等数据由ExPasy(http://web.expasy.org/protparam/)网站在线工具计算得来。
1.2 水稻CIPK基因家族结构分析
用MEGAX软件的极大似然估计法(MaximumLikelihood)构建31个水稻CIPK基因家族的系统发育树。bootstrap replications参数为1000,模型为LG+G。CIPK蛋白序列用MEME(http://meme.nbcr.net/meme/intro.html)在線工具分析水稻CIPK基因家族保守motif,motif数为10。用TBtools软件对水稻CIPK基因结构、保守结构域可视化,再将上述分析结果合并为一张图。
1.3 水稻CIPK基因家族进化分析
1.3.1 CIPK基因在染色体上的分布通过NCBI(ftp://ftp.ncbi.nlm.nih.gov/blast/)下载的blast软件对水稻基因组进行自身比对,再用MCScanX(Multiple CollinearityScan toolkit)软件对比对结果进行共线性分析,提取水稻CIPK基因的直系同源基因ID。用TBtools软件对CIPK基因在水稻12条染色体上的分布以及CIPK基因中直系同源基因关系进行可视化。
1.3.2 水稻和拟南芥CIPK基因的进化与分类用MEGAX软件的极大似然估计法(Maximum Likelihood)构建31个水稻CIPK基因和26个拟南芥CIPK基因的系统发育树,设置参数同上。导出文件,用Figtree软件对水稻和拟南芥CIPK基因分类进行注释与可视化。
1.4 qRT-PCR分析
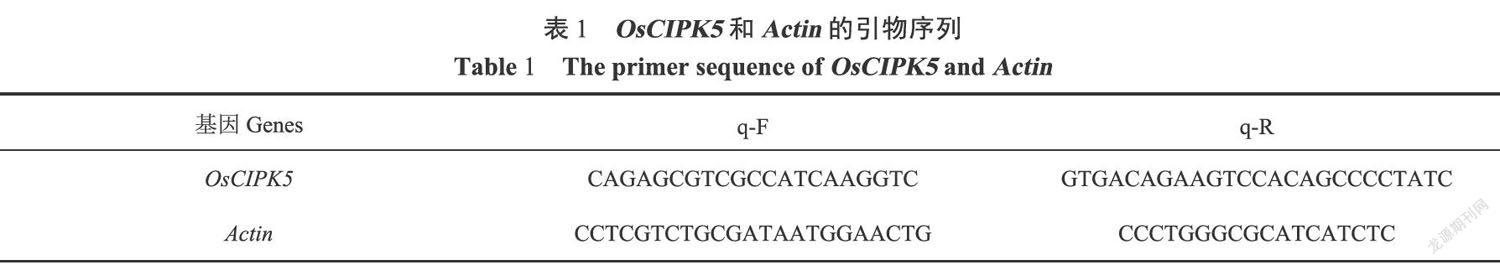
利用TriPure Isolation Reagent提取总RNA,选择Actin为内参基因,下载Actin和OsCIPK5的CDs序列,设计引物如表1所示。
采用喷雾接种法将稻瘟病菌孢子液分别喷洒到粳稻云引三叶一心期幼苗的叶片上,分别于0、12、24、36、48、72、96、120、144、168h共10个时间点取云引叶片样品,用液氮速冻,保存于-80℃冰箱中备用。提取的叶片RNA用High-Capacity cDNAArchive Kit反转成单链cDNA,将cDNA稀释20倍用于qRT-PCR分析。通过ABI Prism■7500型荧光定量PCR仪进行数据处理,之后通过仪器自带软件生成柱形图。
2 结果与分析
2.1 水稻CIPK基因的鉴定、染色体分布及同源性分析
通过BLAST和Hidden Markov Model搜索,对OsCIPK蛋白进行了鉴定。从水稻基因组中共鉴定出31个非冗余CIPK。保守域分析证实,所有的OsCIPK都能识别出S_TKc结构域,这是CIPK家族的基本特征。此外,对CIPK蛋白的多重序列比对表明,本研究中鉴定的所有OsCIPK在N端均含有激酶结构域,29个OsCIPK在C端均含有CIPK_C结构域。由于部分基因含有选择性mRNA剪接,因此选择每个基因最长的蛋白进行进一步分析。31个预测的OsCIPK蛋白的氨基酸残基范围为405~541个,相对分子质量范围为43.97~59.81kDa(表2)。
图1显示,除连锁群(linkage groups,LG)4和10无OsCIPK基因外,OsCIPK基因不均匀地分布于水稻10个LG。LG1的OsCIPK基因数量最多,共有7个。有些连锁群基因较多(如:LG1、LG5),而另一些连锁群基因较少;有些LG只有一个基因(如:LG2)。LG长度与OsCIPK基因数量无显著正相关。根据Holub[23]的描述,在200 kb内包含两个或多个基因的染色体区域被定义为串联重复事件。在LG1、5、7和9上,有10个OSCIPK基因(OsCIPK12/OsCIPK30、OsCIPK5/OsCIPK13、OsCIPK22/OsCIPK18、OsCIPK2/OsCIPK29和OsCIPK16/OsCIPK27)聚集成5个串联重复区域。LGl有两个簇,表明其为OsCIPK基因的一个分布热点。
为了更好地理解OsCIPK基因家族的进化程度,计算了OSCIPK基因对的Ka/Ks比值(表3)。所有直系同源的OsCIPK基因对Ka/Ks<1,说明水稻OsCIPK基因家族在进化过程中可能经历了较强的纯化选择性压力。
2.2 水稻CIPK基因的结构和保守基序
为了更好地了解水稻CIPK基因家族的结构特征,本研究根据系统发育关系分析了内含子/外显子分布、保守基序和顺式元件。系统发育分析表明,31个OsCIPK家族成员被分为5组(A、B、C、D和E;图2)。含有10~21个外显子的多外显子OsCIPK基因被聚集到A组,而只有1~4个外显子的缺外显子成员被聚集到其他4组(B、C、D和E;图2)。各类群保守的外显子数目支持了它们之间的密切进化关系和类群的分类。在拟南芥中,CIPK基因也被分为外显子丰富组和外显子贫乏组[20]。目前在玉米、杨树等单子叶植物和双子叶植物中发现的CIPK基因也存在类似的现象[24-25],说明了口尸尺基因家族结构的保守性。在植物进化的早期,内含子的产生率较高[26]。此外,根据Nuruzzaman等[27]的研究,分段复制后内含子丢失的速度快于内含子获得的速度。因此,A组可能代表CIPK家族的原始基因。此外,除了OsCIPK27,所有B组的缺外显子OsCIPK含有极短或没有5'-UTR,3'-UTR也短;除了密切相关的基因OsCIPK5/OsCIPK20以及OsCIPK28,C组OSCIPK的5'-UTR长且分段;除了OsCIPK13,D组的5'-UTR也极短,但3'-UTR长;E组的UTR虽短,但两端都有。总的来说,同一组中的基因结构都基本一致,说明CIPK组别的分类与基因结构的特性有关。
利用基序分析进一步支持了水稻OsCIPK的系统发育关系和分类(图2)。利用MEME软件对水稻OsCIPK的10个保守基序进行了特征分析。值得注意的是,所有水稻OsCIPK蛋白都含有标记为S Medomain的1、2、3、4、5、9motif,而除OsCIPK22和OsCIPK29外的29个水稻OsCIPK蛋白都含有与CIPK_C domain密切相关的6、7、8、10 motif。虽然OsCIPK29缺失了 motif 6,但它也含有其他基序赋予的S_TKc domain和CIPK_C domain,虽然OsCI-PK22 C端为AMPKA_C_like domain,但OSClPK22C端基序排列和结构与OsCIPK29一样,说明AMPKAC_like domain与CIPK_C domain的功能是一样的。CIPK蛋白具有N端催化激酶结构域和含有NAF基序的C端调控结构域的保守特性[25]。因此,本研究鉴定的所有水稻OsCIPK均具有CIPK家族的保守特征。保守的NAF基序介导了CBL-CIPK之间的物理互作,表明所鉴定的OsCIPK可能在CBL-CIPK网络中存在功能上的连接[28]。另外,在OsCIPK22和OsCIPK29这对旁系同源序列中,缺乏同样注释为NAF域的motif 6。
2.3 水稻和拟南芥CIPK基因家族的进化与分类
为了研究水稻OsCIPK蛋白与其他物种已知CIPK蛋白的进化关系,以水稻和拟南芥CIPK家族蛋白的全氨基酸为基础,构建了系统发育树(图3)。结果表明,根據序列相似性,57个CIPK蛋白可分为5个不同的类群(A~E),这与前人对拟南芥和胡杨CIPK的报道一致[24]。这31个OsCIPK被分配到5个具有较高自举值(bootstrap values,BV)的组,同时还有26个AtCIPK。油菜中CIPK的分类也出现了类似的现象,其中油菜CIPK与拟南芥、水稻、玉米等物种的CIPK共分为4组[29]。
系统发育分析还发现了水稻与拟南芥亲缘关系密切的同源CIPK(A组中OsCIPK24与AtCIPK24、OsCIPK8与AtCIPK8、OSCIPK23与AtCIPK23、OsCI-PK9与AtCIPK9;B组中OsCIPK16与AtCIPK16;C组中OsCIPK6与AtCIPK6、OsCIPK20与AtCIPK20;D组中OsCIPK7与AtCIPK7),表明在水稻和拟南芥分化之前就存在着一组古老的口PK基因。AtCIPK24/AtSOS2与OsCIPK24高度相似,可以与AtCBL4/AtSOS3相互作用,作用于Na+/H+的反向运输载体AtSOS1/AtNHX7,增强拟南芥根系的耐盐胁迫能力[30]。AtCIPK8是OsCIPK8的同源基因,参与调控初级硝酸盐反应的低亲和阶段[31]。这些证据表明CIPK基因可能在水稻中发挥作用。
2.4 稻瘟病菌对水稻OsCIPK5基因表达的诱导
在植物中,钙在各种信号转导途径中起着普遍的信使作用,包括对生物[32-33]和非生物胁迫[3,34]的反应,以及对细胞和发育过程的调控[35-36]。在水稻中,已有一些基于表达模式和生化数据的报道推测了OsCIPK可能的功能。OsCIPK23对授粉和干旱胁迫均有一定的作用[37];OsCIPK19响应光和营养物质[38];OsCIPK31的表达受低温、盐、光、细胞分裂素和糖等多种信号的影响[39];OsCIPK15在水稻缺O:耐受性中发挥了重要作用[40];OsCIPK1、OsCIPK2、OsCIPK10、OsCIPK11和OsCIPK12在接种白叶枯病菌后表达显著上调[22]。这些研究表明OsCIPK可能参与多种逆境信号的转导,但到目前为止还未有报道OsCIPK基因受稻瘟病菌的影响。本课题组利用Self-Organizing Map(SOM)方法对抗稻瘟病粳稻品种云引在不同侵染时间下的基因表达差异进行了分析,发现OsCIPK5基因显著上调[41],因此从中筛选出OsCIPK5基因并鉴定其表达是否受到稻瘟病菌的影响。随着侵染时间延长,OsCIPK5基因的的表达水平呈升高趋势。进一步进行qRT-PCR验证,分析其在稻瘟病菌侵染后10个时间点[0、12、24、36、48、72、96、120、144、168 hai(hours after infection)]的表达模式(图4)。结果表明,OsCIPK5基因在稻瘟病菌接种前表达量最低,在接种稻瘟病菌后表达量开始上调,但24hai后基因的表达量下降,到36hai时,基因的表达丰度甚至略低于0hai,之后基因的表达量又上调,48hai的表达水平高于前四个时间点,但之后表达又下调,至72hai到达低值,但高于0、12、24、36hai的表达量,后基因的表达水平又上调,并在120hai时表达丰度达到最大,之后OsCIPK5基因的表达急剧下降,在168hai时几乎不表达。
3 讨论与结论
水稻是最重要的粮食作物之一,也是单子叶模式植物。在本研究中,我们对水稻OsCIPK家族进行了全基因组的分析。在水稻基因组数据库的计算机分析中,通过对保守结构域和多重序列的比对分析,鉴定出了31个OSCIPK基因。通过对水稻和拟南芥的系统发育分析,将其分为5个亚家族。多重序列比对显示5组OsCIPK蛋白在N端均含有激酶结构域,在C端均含有CIPK_C/NAF结构域,说明水稻CIPK蛋白的高度保守性。在这些保守结构域的作用下,CIPK蛋白表现出对相应CBL蛋白的结合偏好。根据以往的研究,为响应各种刺激,CIPK可特异性地靶向结合CBL,并转导捕捉到的钙信号,这属于Ca2+介导的 CBL-CIPK网络[29,42]。
内含子的得失是CIPK基因家族扩展的一种发散力。基因结构分析表明,31个基因中有10个OsCIPK具有10~21个内含子,被聚类为同一组,表明其具有较高的保守性。在拟南芥CIPK家族中,有8个基因含有9~12个保守的内含子,其中7个是保持不变的[20]。同样,杨树中有9个CIPK基因含有12~14个内含子,其中7个是非常保守的[24]。因此,基于内含子数量的不同,水稻、拟南芥和杨树中CIPK家族成员可分为两个不同的基因簇,这进一步说明了植物基因组具有共同的祖先,进而分化为单子叶和双子叶谱系。在本研究中,水稻OSCIPK缺外显子成员又被分为4组,它们之间的区别主要集中在5-和3'-UTR。
连锁群和进化选择压分析表明,串联和分段复制事件在水稻OsCIPK家族的扩展中也发挥了重要作用(图1,表3)。全基因组复制事件是被子植物进化过程中常见的现象,通常会导致基因家族的扩大[43]。此外,LGI和LG5中OsCIPK基因的密集分布也是导致其基因家族规模多样性的潜在原因,这说明这两个连锁群为OSCIPK基因家族进化中最具活力的群体。3个串联重复基因对(OsCIPK12/OsCIPK30、OsCIPK5/OsCIPKl3和OsCIPK22/OsCIPK18)和2个直系同源基因对(OsCIPK11/OsCIPK28和OsCIPK5/OsCIPK20)分布在这两个连锁群上,这可以为OsCIPK基因家族的进化历史提供更多线索。在本研究中,我们还发现亲缘关系近的水稻OsCIPK成员倾向于散在分布,说明植物CIPK基因的多样性低。
CBL-CIPK通路作為植物钙信号转导网络的重要组成部分,进一步分析拟南芥、水稻等物种的应激诱导的CBL和C1PK家族成员的功能,有助于我们更好地理解应激反应中钙信号的分子机制[21,44-47]。本研究发现,OsCIPK5基因受到稻瘟病菌的诱导表达。目前,尚未有报道描述OsCIPK5基因与抗病性相关,本研究结果将为水稻抗稻瘟病的信号通路中CBL-CIPK信号通路的研究提供新的思路。将抗病基因导人改良品种以减少因稻瘟病造成的水稻产量的损失,是目前认为的最经济便捷的方法。但是,当培育品种的抗病性是基于单一的R基因时,它可迅速被新出现的相容性病原菌株崩溃[48]。因此,Ca2+介导的CBL-CIPK信号通路将大大提高作物的广谱抗性。
参考文献:
[1]BAUM G,LONG J C,JENKINS G I,et al.Stimulation of the bluelight phototropic receptor NPHI causes a transient increase incytosolic Ca2+[J].Proceedings of the National Academy of Sciencesof the United States of Americv,1999,96(23):13554-13559.
[2]EVANS N H,MCAINSH M R,HETHERINGTON A M.Calciumoscillations in higher plants[J].Current Opinion in Plant Biology,2001,4(5):415-420.
[3]KNIGHT H,KNIGHT M R.Abiotic stress signalling pathways:specificity and cross-talk[J].Trends in Plant Science,2001,6(6):262-267.
[4]MACROBBIE E A C.ABA activates multiple Ca2+fluxes in stomatalguard cells,triggering vacuolar K+(Rb+)release[J].Proceedings ofthe National Academy of Sciences of the United States of America,2000,97(22):12361-12368.
[5]SANDERS D,BROWNLEE C,HARPER J F.Communicating withcalcium[J].The Plant Cell,1999,11(4):691.
[6]CHENG S H,WILLMANN M R,CHEN H C,et al.Calcium signalingthrough protein kinases.The Arabidopsis calcium-dependent proteinkinase gene family[J].Plant Physiolog7,2002,129(2):469-485.
[7]HARMON A C,GRIBSKOV M,GUBRIIJM E,et al.The CDPKsuperfamily of protein kinases[J].New Phytologist,2001,151(1):175-183.
[8]LUAN S,RODRIGUEZCONCEPCION M,YALOVSKY S,et alCalmodulins and calcineurin B-like proteins:calcium sensors forspecific signal response coupling in plants[J].The Plant Cell,2002,14:5389-400.
[9]SNEDDEN W A,FROMM H.Cahnodulin as a versatile calciumsignal transducer in plants[J].New Phytologist,2001,151(1):35-66.
[10]ZIELINSKI R E.Calmodulin and calmodulin-binding proteins inplants[J].Annual Review of Plant Physiology and Plant MolecularBiology,1998,49(1):697-725.
[11]LIU J,ISHITANI M,HALFTER U,et al.The Arabidopsis thalianaSOS2 gene encodes a protein kinase that is required for salttolerance[J].Proceedings of the National Academy of Sciences of theUnited States ofAmerica,2000,97(7):3730-3734.
[12]ISHITANI M,LIU J P,HALFTER U,et al.SOS3 function in plantsalt tolerance requires N-myristoylation and calcium binding[J].ThePlant Cell,2000,12(9):1667-1677.
[13]SANCHEZ-BARRENA M J,MARTINEZ-RIPOLL M,ZHU J K,etal.The structure of the Arabidopsis thaliana SOS3:molecularmechanism of sensing calcium for salt stress response[J].Journal ofMolecular Biolog7,2005,345(5):1253-1264.
[14]GONG D M,GUO Y,SCHUMAKER K S,et al.The SOS3 family ofcalcium sensors and SOS2 family of protein kinases inArabidopsis[J].Plant Physiology,2004,134(3):919-926.
[15]SHI H Z,ISHITANI M,KIM C,et al.The Arabidopsis thaliana salttolerance gene SOS]encodes a putative Na+/H+antiporter[J].Proceedings of the National Academy of Sciences of the United Statesof America,2000,97(12):6896-6901.
[16]QIU Q S,GUO Y,DIETRICH M A,et al.Regulation of SOSl,aplasma membrane Na+/H' exchanger in Arabidopsis thaliana,bySOS2 and SOS3[J].Proceedings of the National Academy ofSciences of the United States of America,2002,99(12):8436-8441.
[17]QIU Q S,GUO Y,QUINTERO F J,et al.Regulation of vacuolarNa+/H+exchange in Arabidopsis thaliana by the salt-overly-sensitive(SOS)pathway[J].Journal ofBiological Chemistry,2004,279(1):207-215.
[18]XIONG L M,SCHUMAKER K S,ZHU I K.Cell signaling duringcold,drought,and salt stress[J].The Plant Cell,2002,14(S1):S165-183.
[19]ZHU J K.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biolog7,2002,53(1):247-273.
[20]KOLUKISAOGLUU,WEINL S,BLAZEVIC D,et al.Calciumsensors and their interacting protein kinases:genomics of theArabidopsis and rice CBL-CIPK signaling networks[J].PlantPhysiology,2004,134(1):43-58.
[21]XIANG Y,HUANG Y M,XIONG L Z.Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement[J].Plant Physiology,2007,144(3):1416-1428.
[22]CHEN X F,GU Z M,LIU F,et al.Molecular analysis of rice[7PKsinvolved in both biotic and abiotic stress responses[J].Rice Science,2011,18(1):1-9.
[23]HOLUB E B.The arms race is ancient history in Arabidopsis,thewildflower[J].Nature Reviews Genetics,2001,2(7):516-527.
[24]YU Y H,XIA X L,YIN W L,et al.Comparative genomic analysis ofCIPK gene family in Arabidopsis and Populus[J].Plant GrowthRegulation,2007,52(2):101-110.
[25]KANWAR P,SANYAL S K,TOKAS I,et al.Comprehensivestructural,interaction and expression analysis of CBL and CIPKcomplement during abiotic stresses and development in rice[J].CellCalcium,2014,56(2):81-95.
[26]ROY S W,PENNY D.Patterns of intron loss and gain in plants:intronloss-dominated evolution and genome-wide comparison of O.sativaand A.thaliana[J].Molecular Biology and Evolution,2007,24(1):171-181.
[27]NURUZZAMAN M,MANIMEKALAI R,SHARONI A M,et al.Genome-wide analysis of NAC transcription factor family in rice[J].Gene,2010,465(1/2):30-44.
[28]KLEIST T J,SPENCLEY A L,LUAN S.Comparative phylogenomicsof the CBL-CIPK calcium-decoding network in the mossPhyscomitrella,Arabidopsis,and other green lineages[J].Frontiers inPlant Science,2014(5):187.
[29]ZHANG H F,YANG B,LIU W Z,et al.Identification andcharacterization of CBL and CIPK gene families in canola(Brassicanapus L.)[J].BMC Plant Biology,2014,14(1):8.
[30]KUDLA J,BATISTIC O,HASHIMOTO K.Calcium signals:the leadcurrency of plant information processing[J].The Plant Cell,2010,22(3):541-563.
[31]HU H C,WANG Y Y,TSAY Y F.AYCIPK8,a CBL-interactingprotein kinase,regulates the low-affinity phase of the primary nitrateresponse[J].Plant Journal,2009,57(2):264-278.
[32]CHUNG E,PARK J M,OH S K,et al.Molecular and biochemicalcharacterization of the Capsicum annuum calcium-dependent proteinldnase 3(CaCDPK3)gene induced by abiotic and biotic stresses[J].Planta,2004,220(2):286-295.
[33]LUDWIG A A,SAITOH H,FELIX G,et al.Ethylene-mediated cross-talk between calcium-dependent protein kinase and MAPK signalingcontrols stress responses in plants[J].Proceedings of the NationalAcademy of Sciences of the United States of America,2005,102(30):10736-10741.
[34]FROHNMEYER H,LOYALL L,BLATT M R,et al.Millisecond UV-B irradiation evokes prolonged elevation of cytosolic-free Ca2+andstimulates gene expression in transgenic parsley cell cultures[J].Plant Journal,1999,20(1):109-117.
[35]TREWAVAS A J,MALH6 R.Cat' signalling in plant cells:the bignetwork![J].Current Opinion in Plant Biology,1998,1(5):428-443.
[36]IRAN P O T,HINMAN L E,UNGER G M,et al.A wound-induced[Ca2+]i increase and its transcriptional activation of immediateearly genes is important in the regulation of motility[J].ExperimentalCell Research,1999,246(2):319-326.
[37]YANG W Q,KONG Z S,OMO-IKERODAH E,et al.Calcineurin B-like interacting protein kinase OsCIPK23 functions in pollination anddrought stress responses in rice(Oryza sativa L.)[J].Journal ofGenetics and Genomics,2008,35(9):531-543.
[38]OHBA H,STEWARD N,KAWASAKI S,et al.Diverse response ofrice and maize genes encoding homologs of WPK4,an SNFI-relatedprotein kinase from wheat,to light,nutrients,low temperature andcytokinins[J].Molecular and General Genetics,2000,263(2):359-366.
[39]KIM K N,LEE JS,HAN H E,et al.Isolation and characterization of anovel rice Ca2+-regulated protein kinase gene involved in responses todiverse signals including cold,light,cytokinins,sugars and salts[J].Plant Molecular Biology,2003,52(6):1191-1202.
[40]LEE K W,CHEN P W,LU C A,et al.Coordinated responses tooxygen and sugar deficiency allow rice seedlings to tolerateflooding[J].Science Signaling,2009,2(91):ra61.
[41]HUANG F,LIAN L,HE W,et al.Genome-wide profiling of changesin gene expression in response to infection of the japonica rice varietyYunyin by Magnaporthe oryzae[J].Molecular Breeding,2014,34(4):1965-1974.
[42]DENG X M,HU W,WEI S Y,et al.TaCIPK29,a CBL-interactingprotein kinase gene from wheat,confers salt stress tolerance intransgenictobacco[J].PLoS One,2013,8(7):e69881.
[43]CANNON S B,MITRA A,BAUMGARTEN A,et al.The roles ofsegmental and tandem gene duplication in the evolution of large genefamilies in Arabidopsis thaliana[J].BMC Plant Biologl,2004,4(1):10.
[44]ZHU J K,LIU J P,XIONG L M.Genetic analysis of salt tolerance inArabidopsis:evidence for a critical role of potassium nutrition[J].The Plant Cell,1998,10(7):1181-1191.
[45]LI L,KIM B G,CHEONG Y H,et al.A Cat' signaling pathwayregulates a K+channel for low-K response in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United Statesof America,2006,103(33):12625-12630.
[46]XU J,LI H D,CHEN L Q,et al.A protein kinase,interacting with twocalcineurin B-like proteins,regulates K+transporter AKT1 inArabidopsis[J].Cell,2006,125(7):1347-1360.
[47]MARTINEZ-ATIENZA J,JIANG X Y,GARCIADEBLAS B,et alConservation of the salt overly sensitive pathway in rice[J].PlantPhysiology,2007,143(2):1001-1012.
[48]HAYASHI K,YOSHIDA H,ASHBCAWA I.Development of PCR-based allele-specific and InDel marker sets for nine rice blastresistance genes[J].Theoretical and Applied Genetics,2006,113(2):251-260.
(責任编辑:林海清)
收稿日期:2019-10-05 初稿;2019-11-02修改稿
作者简介:喻丝丝(1987-),女,博士研究生,主要从事水稻抗逆分子生物学研究(E-mail:349026685@明xom)
通信作者:谢华安(1941-),男,研究员,主要从事杂交水稻育种研究(E-mail:huaanxie@163.com);张建福(1971-),男,博士,研究员,主要从事水稻分子设计育种研究(E-mail:jianfzhang@163.com)
基金项目:国家重点研发计划项目(2016YFD0300508);福建省科技计划公益类专项(201881021-5);福建省财政专项—福建省农业科学院科技创新团队建设项目(STIT2017-1-1)

