超高压处理对蓝莓酚类物质生物可获得率及抗氧化性的影响
王鸥 周洁心 蔡圣宝 黄建


摘 要:目的:探讨不同条件超高压处理对蓝莓酚类物质的生物可获得率以及抗氧化性的影响。方法:在不同压力下对蓝莓果实进行不同时间的超高压处理。分析测定不同处理条件下蓝莓中酚类物质的含量。通过测定1,1-二苯基-2-三硝基苯肼(DPPH)和2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除能力评价超高压处理后蓝莓的抗氧化能力变化。利用超高效液相色谱-电喷雾串联四级杆质谱分析鉴定蓝莓中主要酚类物质及其含量变化情况。结果:不同压力与处理时间下,超高压处理均能提高蓝莓总酚、总黄酮和总花色苷的生物可获得率,其中在500MPa下处理5min效果最佳。DPPH和ABTS自由基清除能力实验结果表明,超高压处理可以显著提高蓝莓抗氧化性,在500 MPa处理5 min的蓝莓抗氧化能力最强。超高压前后共鉴定出9种酚类物质,其中7种为花色苷及其衍生物、2种类黄酮物质,这些物质中除了矮牵牛素外,其余物质在超高压处理后生物可获得率均显著增加。结论:超高压处理可以显著提高蓝莓中总酚、总黄酮及花色苷等酚类物质的生物可获得率,增强其清除自由基的能力,提高抗氧化性。
关键词:蓝莓;超高压;酚类物质;生物可获得率;抗氧化性
机体需要额外的抗氧化剂的协助以及时地清除体内过多的自由基[1-3]。自然界植物体内含有多种具有抗氧化能力的次级代谢产物[4],其中植物多酚由于其良好的抗氧化性被广泛研究。植物广泛分布于植物体内,按照其结构的差异,植物多酚可以分为酚酸类、类黄酮类、花青素类以及芪类等[5]。大量研究表明,植物多酚不论在体内还是体外均表现出非常优异的抗氧化能力[6]。另外,植物多酚可以预防和改善多种人体疾病,特别是一些退行性疾病,并认为植物多酚的这些生物活性与其良好的抗氧化性有关[7]。然而在植物体内,许多植物多酚与多种大分子结合或者被细胞壁等大分子阻挡,从而导致其生物可获得率往往较低,而植物多酚的生物可获得率是其发挥生物活性的基础,因此,研究者一直在探讨如何提高植物体内多酚的生物可获得率。目前常用的方法是发酵、酶预处理以及气爆等,这些方法均能一定程度提高植物体内多酚的生物可获得率[8]。此外,超高压是一种食品加工新技术,主要用于食品保鲜等非热加工方面。但也有研究发现,食品原料经超高压加工后,其生物活性成分的生物可获得率得到了显著提高[9]。因此,现有研究开始探讨超高压在提高食品功能活性成分的生物可获得率方面的进一步应用。
蓝莓中的植物多酚赋予了蓝莓多种功能活性,如抗氧化、预防非酒精性脂肪以及预防心血管疾病等[10],然而,目前关于超高压处理对蓝莓多酚生物可获得率及抗氧化性的影响研究却少见报道。因此,本研究利用超高压技术对新鲜蓝莓进行处理,探讨不同压力和处理时间对蓝莓中多酚的生物可获得率及其抗氧化性的影响。
1 材料与方法
1.1 材料与设备
蓝莓鲜果,云南省昆明市嵩明县高山蓝莓庄园,果实均匀饱满,无烂果和杂果;没食子酸、芦丁等对照品,成都曼斯特生物科技有限公司,纯度均在99%以上;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS],北京拜尔迪生物技术有限公司;色谱级甲醇、乙腈,德国Merck试剂公司;分析纯甲醇、甲酸、乙醇等试剂,国药集团。HPP600MPa/3-5L超高压处理设备,包头科发高压科技有限公司;SpectraMax M5型酶标仪,美国Molecular公司;Alpha1-2LD plus型真空冻干机,德国Christ公司;Ultimate 3000-Q-Exactive Orbitrap mass液质联用设备,德国Thermo Fisher公司。
1.2 方法
1.2.1 超高压处理 蓝莓鲜果洗净后密封包装,置于超高压设备样品室中,在不同压力下处理不同时间。超高压处理后的蓝莓破碎后,用含1%甲酸的80%甲醇超声提取0.5h,离心,复提1次,合并上清液待用。
1.2.2 总酚含量测定 采用福林酚法测定样品中总酚含量[11]。取等体积样品溶液和福林酚试剂,静置1min后加入1.5 mL 浓度为20%的碳酸钠溶液,定容至10.0 mL。70℃水浴10 min,冷却至室温后与765 nm下读取吸光值。以没食子酸为标准品,相同步骤处理,绘制标准曲线。
1.2.3 黄酮含量测定 在前期报道的黄酮含量测定方法基础上稍作改进[11]。样品用甲醇溶解并稀释,取1mL溶液用70%乙醇定容至2.5 mL,加入0.15 mL浓度为 5% NaNO-2溶液,摇匀静止5min。加入0.15 mL 浓度为10%的Al(NO-3)-3溶液,摇匀静置6min,最后加入1.0 mL 浓度为1mol/L 的NaOH。用70%乙醇定容至5.0 mL,静置30min,500 nm处测定吸光值。以芦丁为标准品,相同步骤处理,绘制标准曲线。
1.2.4 花色苷含量测定 采用pH示差法测定花色苷含量[11]。1.0 mL样品处理液分别加入至9.0 mL pH为1的KCl缓冲溶液与pH为4.5的乙酸钠缓冲溶液中。以蒸馏水加缓冲溶液调零,分别在520、700 nm处测定吸光值,计算花色苷含量。
1.2.5 抗氧化测定方法
(1)DPPH自由基清除能力测定[12]:配制浓度为1 mmol/L的DPPH-甲醇儲备液,使用时甲醇稀释10倍作为反应液。取1.0 mL 样品甲醇稀释液加入2.0 mL DPPH反应液,避光振荡30 min,于517 nm处测定吸光值。以等体积蒸馏水替代样品做为空白对照。计算测试样品与空白对照的吸光值差值,通过其与对照管吸光值比值计算DPPH自由基清除率。
(2)ABTS自由基清除能力测定[12]:7 mmol/L ABTS和4.9 mmol/L过硫酸钾溶液等体积混合,室温避光静置12h形成ABTS储备液。使用时储备液用乙醇稀释至734 nm下吸光值为0.70 ±0.02,得到ABTS反应液。测试时,0.5 mL样品加入2 mL ABTS反应液,30℃水浴6min,于734nm处测定吸光值。空白对照用等体积的蒸馏水代替样品。计算空白样品与测试样品的吸光值差值,通过其与空白样品吸光值的比值计算ABTS自由基清除率。
1.2.6 液相-质谱联用分析条件
(1)液相分离条件:Agilent ZORBAX RRHDSB-C18柱色谱(2.1 mm×100 mm,1.8 μm)。柱温35℃,流速1 mL/min,进样量2 μL。洗脱条件:流动相A为0.5%的甲酸水,流动相B为0.5%的甲酸乙腈。分离洗脱梯度:0~2 min,10%~13% B;2~5min,13%~15% B;5~15 min,15%~20% B;15~20 min,20%~30% B;20~25 min,30%~40% B;25~28 min,40%~60% B;28~30 min,60%~10% B;30~35 min,10% B。
(2)质谱工作条件:ESI离子源,正离子模式,ESI工作压力为3.9 kV;毛细管温度:300 ℃;雾化器压力:0.207 kV;干燥器压力:2.068 kV;干燥气流速:12 L/min;离子扫描范围100~1 500 m/z。
1.3 统计分析
利用SPSS17.0软件进行组间数据单因素方差分析及Tukey检验。以P<0.05记为差异显著。试验进行3次平行,結果表示为均数±标准差。
2 结果与分析
2.1 超高压处理对蓝莓酚类物质含量的影响
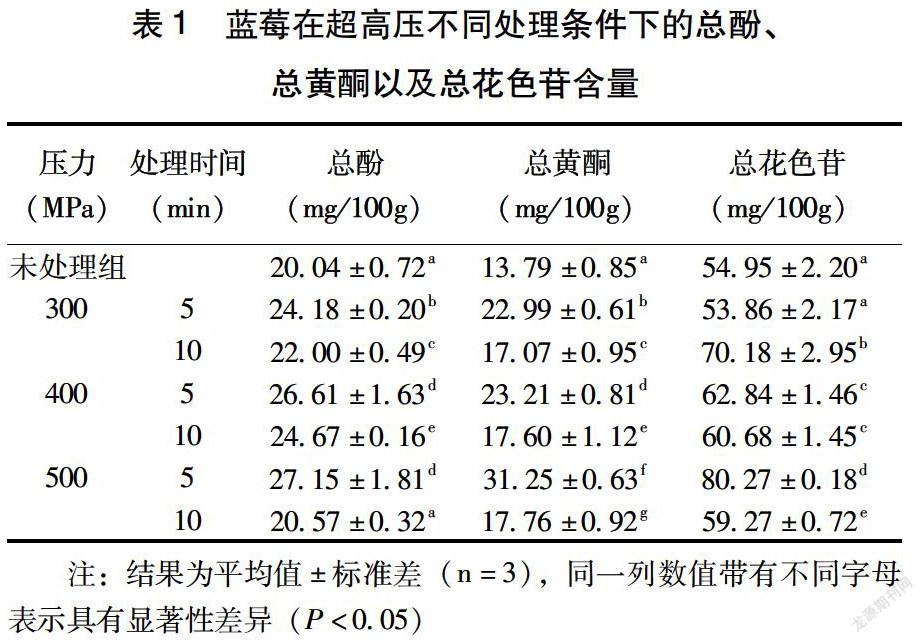
如表1所示,相较于未处理组,经过500 MPa处理10 min组的总酚含量以及300 MPa处理5 min组的总花色苷含量与未处理组相比未有显著变化,其余处理压力与处理时间下,均可以显著提高蓝莓中酚类物质的生物可获得率(P<0.05)。从总酚变化角度分析,400 MPa和500 MPa超高压处理5 min后蓝莓多酚的生物可获得率最高 (P<0.05),分别达到26.61±1.63、27.15±1.81mg/100g,与未处理组相比分别提升了32.78%、35.48%。经过500 MPa处理5min的蓝莓,其总黄酮的生物可获得率最高,提升为未处理组的126.61%(P<0.05)。此外,与未处理组相比,蓝莓经过500 MPa处理5 min后,其总花色苷的生物可获得率也增加最为明显,上升了46.10%。因此,综合分析超高压处理后总酚、总黄酮和总花色苷结果可知,500 MPa压力下处理5 min对蓝莓酚类物质的生物可获得率提高的效果最好。
2.2 超高压处理对蓝莓多酚抗氧化能力的影响
2.2.1 DPPH自由基清除能力 如表2所示,超高压处理前后的蓝莓均表现出DPPH自由基清除能力,并呈现剂量效应。同一测试浓度下,500 MPa处理后的蓝莓对DPPH自由基清除力达到最高。当500 MPa下处理5 min后,在1.39 mg/mL浓度条件下,有超过83%的DPPH自由基可以被蓝莓清除掉。如表4所示,除300 MPa处理10 min外,其他所有超高压处理组对DPPH自由基清除能力的IC-50值均显著低于未处理组 (P<0.05),表明超高压处理显著提高了蓝莓对DPPH自由基的清除能力。其中,500 MPa处理5 min的蓝莓对DPPH自由基清除能力的IC-50值最低 (P<0.05),说明该条件处理下的蓝莓对DPPH自由基清除能力最强。
2.2.2 ABTS自由基清除能力 如表3所示,超高压处理前后的蓝莓均表现出ABTS自由基清除能力,同时呈现剂量效应。在0.43~0.87 mg/mL测试浓度范围内,多数压力处理下,处理5 min后的蓝莓ABTS自由基清除能力显著高于同一压力下处理10 min (P<0.05)。其中,500 MPa处理5 min后,当在0.87 mg/mL浓度条件下,蓝莓对ABTS自由基的清除率近70%。如表4所示,除300 MPa下处理10 min外,其余处理条件下蓝莓对ABTS自由基清除能力的IC-50值均显著小于未处理组 (P<0.05)。与DPPH自由基清除能力结果相似,500 MPa处理5min的蓝莓对ABTS自由基清除能力的IC-50值最低 (P<0.05),说明该条件处理下蓝莓对ABTS自由基清除能力最强。
2.3 超高压后蓝莓多酚成分分析
基于上述结果分析,500 MPa处理5 min对蓝莓酚类物质的生物可获得率提高最为显著,因此,利用UHPLC-ESI-MS/MS对该超高压条件处理前后蓝莓的酚类物质组成及含量变化进行分析。总离子流如附图所示,酚类物质定性分析结果(酚类物质名称、保留时间、[M]+m/z以及MS/MS碎片等)如表5所示,共有9种酚类物质被鉴定出来,其中7种花色苷及其衍生物,分别为飞燕草素-3-二葡萄糖苷([M]+ m/z=465.102 6)、矮牵牛素-3-O-葡萄糖苷([M]+m/z =479.107 4)、矢车菊素-3-O葡萄糖苷([M]+m/z = 449.107 4)、锦葵色素-3-O-半乳糖苷([M]+m/z=493.133 3)、芍药素-3-O-葡萄糖苷([M]+m/z =463.122 7)、锦葵色素([M]+m/z=331.080 3)以及矮牵牛素([M]+m/z=317.065 3),其余2种分别为槲皮素-3-O-阿拉伯糖苷([M+H]+m/z=435.091 9)和槲皮素([M+H]+m/z=303.049 6)。
如表5所示,经过500 MPa超高压处理5 min后,这9种酚类物质中有8种的生物可获得率均得到显著提升,尤其是锦葵色素-3-O-半乳糖苷,其平均含量提升为未处理组的3倍以上,其次是芍药素-3-O-葡萄糖苷,较未处理组提升了2.5倍。矮牵牛素在超高压处理后的生物可获得率并没有显著变化。
3 讨论
超高压作为一种新的食品加工技术除用于杀菌保鲜目的外,还可以显著提升食品中营养物质含量,特别是一些功能成分的生物可获得率。有研究发现,与微波提取、热浸提等方法相比,超高压处理可以显著提高蓝莓多酚的提取率,同时这一方法得到的花色苷在储存期间更为稳定[13]。本研究通过比较不同超高压条件处理后,蓝莓总酚、总黄酮和总花色苷的变化情况可知,在相同处理压力下,处理5 min的效果优于处理10 min,推测其原因可能是因为超高压处理导致植物细胞内酶活发生变化,因而过长时间的处理会导致已释放的酚类物质发生一定损失[14]。另外,总体来说,在处理相同时间下,500 MPa处理的结果优于400 MPa和300 MPa,这可能是由于较高的压力有利于破坏蓝莓细胞壁,从而有利于植物细胞中的酚类物质更多地被释放,特别是包含在液泡中的花色苷类物质,从而增加了其生物可获得率。综上,在本研究探讨范围内,500 MPa压力下处理5 min是获得蓝莓酚类物质的较好条件,这一条件与前人研究中发现的蓝莓汁中花色苷的最佳保留条件一致[15]。
大量研究表明,植物多酚具有预防多种慢性疾病的作用,而这一作用被认为与其所表现的突出的抗氧化性密不可分[16-17]。前期研究结果显示,超高压处理糙米、茶叶等不同的植物均被证实具有增强其抗氧化能力的作用[18-19]。本研究中,利用DPPH和ABTS自由基清除實验探讨了蓝莓经过不同条件超高压处理后抗氧化能力的变化。从实验结果来看,不同超高压条件处理后均可以显著提升蓝莓的抗氧化性,尤其是ABTS自由基的清除能力,经过500 MPa处理5 min的蓝莓对ABTS自由基清除的IC-50值只有未处理组的一半,说明蓝莓经此条件超高压处理后对ABTS自由基的清除能力提高了1倍。这可能是由于在此超高压条件下,蓝莓的多酚生物可获得率得到极大的提高所引起的。前人对超高压处理蓝靛果的研究也同样表明,超高处理可以有效提高蓝靛果的抗氧化能力[20]。
综上,超高压处理可以显著提高蓝莓中总酚、总黄酮及花色苷等酚类物质的生物可获得率,增强其清除自由基的能力,提高抗氧化性。未来食品加工过程中可考虑利用该技术提高蓝莓相关食品的营养价值。
参考文献
[1]Cai Shengbao,et al.Comparative study of the effects of solid-state fermentation with three filamentous fungi on the total phenolics content (TPC),flavonoids,and antioxidant activities of subfractions from oats (Avena sativa L.)[J].Journal of Agriculture and Food Chemistry,2012,60(1):507-513.
[2]Blokhina Olga,Eija Virolainen,Kurt V Fagerstedt.Antioxidants,oxidative damage and oxygen deprivation stress:a review [J].Annnal of Botany,2003,91(2):179-194.
[3]Poprac Jomova,et al.Targeting free radicals in oxidative stress-related human diseases [J].Trends in Pharmacological Sciences,2017,38(7):592-607.
[4]Xu Dong-Ping,et al.Natural antioxidants in foods and medicinal plants:extraction,assessment and resources [J].International Journal of Molecular Sciences,2017,18(1):96.
[5]Rangel-Huerta,et al.A systematic review of the efficacy of bioactive compounds in cardiovascular disease:phenolic compounds [J].Nutrients,2015,7(7):5177-5216.
[6]Chen Guan Lin,et al.Antioxidant activities and contents of free,esterified and insoluble-bound phenolics in 14 subtropical fruit leaves collected from the south of China [J].Journal of Functional Foods,2017(30):290-302.
[7]Skrovankova Sona,et al.Bioactive compounds and antioxidant activity in different types of berries [J].International Journal of Molecular Sciences,2015,16(10):24673-24706.
[8]Liu Lei,et al.Fermentation and complex enzyme hydrolysis enhance total phenolics and antioxidant activity of aqueous solution from rice bran pretreated by steaming with α-amylase [J].Food Chemistry,2017(221):636-643.
[9]Santos,Mickael C.,et al.Use of high hydrostatic pressure to increase the content of xanthohumol in beer wort [J].Food and Bioprocess Technology,2013,6(9):2478-2485.
[10]Maha,Ayoub,De Camargo Adriano Costa,Shahidi Fereidoon.Antioxidants and bioactivities of free,esterified and insoluble-bound phenolics from berry seed meals [J].Food Chemistry,2016(197):221-232.
[11]Sun Dan,et al.Digestion property and synergistic effect on biological activity of purple rice (Oryza sativa L.)anthocyanins subjected to a simulated gastrointestinal digestion in vitro [J].Food Research International,2015(78):114-123.
[12]Zhang Chengting,et al.Phenolic composition,antioxidant and pancreatic lipase inhibitory activities of Chinese sumac (Rhus chinensis Mill.)fruits extracted by different solvents and interaction between myricetin-rhamnoside and quercetin-rhamnoside [J].International Journal of Food Science & Technology,2017,53(4):1045-1053.
[13]張海宁.超高压辅助提取蓝莓果渣花色苷及其对花色苷降解动力学的研究[D].南京:江苏大学,2016.
[14]Zhang,ZQ,Pang,XQ,Duan,XW,et al.Role of peroxidase in anthocyanin degradation in litchi fruit pericarp [J].Food Chemistry,2005,90(1):47-52.
[15]李星贺.超高压处理对蓝莓汁总抗氧化能力、酶活性及主要成分影响的研究[D].沈阳:沈阳农业大学,2017.
[16]Huang Shiqi,et al.Bioaccessibility and antioxidant activity of phenolics in native and fermented Prinsepia utilis Royle seed during a simulated gastrointestinal digestion in vitro [J].Journal of Functional Foods,2017(37):354-362.
[17]Zhang Chengting,et al.The free,esterified,and insoluble-bound phenolic profiles of Rhus chinensis Mill.fruits and their pancreatic lipase inhibitory activities with molecular docking analysis [J].Journal of Functional Foods,2018(40):729-735.
[18]谭俊峰,等.超高压处理对茶多酚提取率和抗DPPH自由基活性的影响[J].食品科学,2009,30(18):92-95.
[19]于勇,等.超高压处理对糙米多酚、黄酮类含量及其抗氧化性的影响[J].农业机械学报,2017,48(11):368-374.
[20]李新原,等.超高压处理对蓝靛果抗氧化物提取量及活性的影响[J].食品科学,2017,38 (3):119-124.
(责任编辑 唐建敏)

