种间杂交选育新型产脂蛹虫草
梁玲 赵燕玉 黄建忠

摘 要:為选育能够合成虫草素又能高效积累油脂的新型蛹虫草菌株,将高产虫草素的蛹虫草FY1421及高效合成油脂特别是不饱和脂肪酸的深黄被孢霉菌株Z0108进行原生质体融合。对亲本的原生质体的形成与再生、双亲灭活及融合的条件进行了筛选与优化,并结合96微孔板初筛和摇瓶发酵复筛,获取融合子。结果表明:蛹虫草菌株FY1421采用1.5%溶壁酶+0.5%蜗牛酶+0.5%纤维素酶的混合酶液处理120 min,原生质体数量最多,再生率最高;深黄被孢霉菌株Z0108采用1%溶壁酶+1%蜗牛酶+1%纤维素酶的混合酶液处理4 h,原生质体数量最多,再生率最高;FY1421原生质体采用60℃水浴热灭活10min,Z0108原生质体采用紫外线灭活30s,均可达到100%的灭活率;灭活双亲在35℃下,使用40%的PEG促融10 min,融合效率最高。从650株融合子筛选得到融合菌株RCS262,其摇瓶发酵虫草素含量达5926μg·g-1,油脂含量达到37.5%。采用原生质体融合技术进行蛹虫草与深黄被孢霉的种间杂交,成功获得融合菌株既能高产虫草素,也具有高效积累油脂的能力。
关键词:蛹虫草;深黄被孢霉;杂交;原生质体融合
中图分类号:S567.39 文献标志码:A 文章编号:0253-2301(2019)11-001
DOI: 10.13651/j.cnki.fjnykj.2019.11.001
Selection of a New Type of Lipidproducing Cordyceps Militaris by Interspecific Hybridization
LIANG Ling, ZHAO Yanyu, HUANG Jianzhong
Abstract: In order to select a new strain of Cordyceps militaris that could synthesize cordycepin and accumulate oil efficiently, the protoplast fusion was performed on the strain FY1421 of Cordyceps militaris with high yield of cordycepin and the strain Z0108 of mortierella isabellina with high efficiency in oil synthesis, especially in unsaturated fatty acid synthesis. The conditions of protoplast formation and regeneration, inactivation and fusion of parents were screened and optimized. And the fusions were obtained by combining the initial screening of 96 microwell plate with the shaking flask fermentation. The results showed that the strain FY1421 of Cordyceps militaris was treated with a mixture of 1.5% lysozyme+0.5% snail enzyme+0.5% cellulase for 120 min, with the largest number of protoplasts and the highest regeneration rate. The strain Z0108 of mortierella isabellina was treated with a mixture of 1% lymolytic enzyme+1% snail enzyme+1% cellulase for 4 h, with the largest number of protoplasts and the highest regeneration rate. The protoplast of FY1421 was inactivated by 60℃ water bath for 10 min, and the protoplast of Z0108 was inactivated by ultraviolet ray for 30 s, both of which could achieve 100% inactivation rate. And the inactivated parents were fused with 40% PEG for 10 min at 35℃which could achieve the highest fusion efficiency. The fusion strain RCS262 was screened from 650 strains of fusions, and the content of cordycepin with the shaking flask fermentation reached 5926 μg·g-1, while the oil content reached 37.5%. The protoplast fusion technique was used to conduct the interspecific hybridization of Cordyceps militaris and Mortierella isabellina, and the fusion strain obtained successfully could not only produce high yield of cordycepin but also accumulate oil efficiently.
Key words: Cordyceps militaris; Mortierella isabellina; Hybridization; Protoplasts fusion
蛹虫草Cordyceps militaris又称为北虫草、北冬虫夏草、蛹草,分类学上隶属于真菌门Eumycota,子囊菌亚门Ascomycotinia、子囊菌纲Ascomycctes、粪壳菌亚纲Sordariomycetes、肉座菌目Hypocreales、麦角菌科Clavicipitaceae、虫草属Cordyceps,是虫草属的模式菌,一种极具保健功能的名贵中药[1]。据文献报道,蛹虫草富含多种生物活性成分,包括虫草素、腺苷、虫草多糖、虫草酸、超氧化物歧化酶(SOD)、甾醇、糖醇、不饱和脂肪酸、多种氨基酸和维生素等,具有提高免疫力、调节内分泌、改善记忆力、延缓衰老、抗氧化、抗菌、抗肿瘤、抗炎、抗病毒、镇静、保护肝肾及呼吸系统等多种生理功能[1-3]。其活性成分中不饱和脂肪酸主要为γ亚麻酸及亚油酸,但是含量非常低,难以达到其应有的生理功效。
深黄被孢霉Mortierella isabellina用于微生物发酵,能够生产γ亚麻酸等多不饱和脂肪酸(polyunsaturated fattyacids, PUFAs),这些脂肪酸在保持细胞流动性、降低胆固醇、改善血液微循环等方面有重要作用[4],其菌粉及提取物具有降血脂、降血糖的作用[5]。通过杂交技术使蛹虫草菌株与深黄被孢霉优势互补,得到一种既具有蛹虫草的生物活性功能,又兼具深黄被孢霉高产不饱和脂肪酸的新型菌株,实现蛹虫草资源营养成分多优并举,是一个全新的课题,具有极高的现实意义与应用价值。
在不同的物种间,由于存在不亲和性因子及细胞壁,种间杂交基本不可能。而将细胞去壁制备成原生质体后,便能够跨过这个障碍,实现远缘杂交,产生杂交后代。原生质体融合技术应用于种间杂交已有先例,刘宝等[6]利用原生质体融合技术将黄花烟草和枸杞进行杂交,得到了兼具双亲优良性状的杂种小苗。刘冰等[7]利用重寄生链霉菌与生防放线菌进行原生质体融合,得到了具有生防效果的放线菌。
本研究创新性地利用原生质体融合技术开展蛹虫草菌株与深黄被孢霉的种间杂交,通过技术路线优化(图1),旨在获取蛹虫草本身腺苷类活性物质高含量的基础上,促进油脂合成与积累,实现蛹虫草资源生物活性物质的有效补充,达到一菌多效、生理活性功能物质多效叠加的目的。
1 材料与方法
1.1 试验材料
1.1.1 出发菌种 蛹虫草菌FY1421(Cordyceps militaris FY1421),由厦门元尊生物工程有限公司提供;深黄被孢霉Z0108(Mortierella isabellina Z0108),由教育部工业微生物工程研究中心保存。
1.1.2 培养基 (1)蛹虫草斜面培养基及固体平板培养基PDA:马铃薯浸出粉20 g·L-1,葡萄糖20 g·L-1,琼脂20 g·L-1, pH自然,121℃灭菌20 min。(2)深黄被孢霉斜面及固体平板培养基:葡萄糖70 g·L-1,尿素5 g·L-1,酵母膏2 g·L-1,柠檬酸钠12 g·L-1,硫酸铵6 g·L-1,硫酸镁 1 g·L-1,磷酸氢二钾 1 g·L-1,维生素B6 10 mg,琼脂20 g·L-1,pH自然,121℃灭菌20 min。(3)菌丝培养液:马铃薯浸出粉20 g·L-1,葡萄糖20 g·L-1,蔗糖50 g·L-1,磷酸二氢钾0.8 g·L-1,硫酸镁0.3 g·L-1,pH 6.8~7.0,121℃灭菌20 min。(4)再生培养基:蔗糖205 g·L-1,马铃薯浸出粉20 g·L-1,葡萄糖20 g·L-1,尿素 5 g·L-1,柠檬酸钠12 g·L-1,pH自然,121℃灭菌20 min。(5)融合子种子培养基:蔗糖40 g·L-1,酵母粉8 g·L-1,磷酸二氢钾0.5 g·L-1,硫酸镁0.5 g·L-1,柠檬酸钠1 g·L-1,柠檬酸1 g·L-1,微量元素母液10 mL,维生素B1 10 mg,维生素B6 10 mg,pH自然,121℃灭菌20 min;其中微量元素母液包括:七水合硫酸亚铁280 mg,氯化钙110 mg,五水硫酸铜25 mg,七水硫酸锌29 mg,定容至1000 mL,4℃存储,备用。(6)融合子发酵培养基:蔗糖40 g·L-1,蛋白胨15 g·L-1,酵母粉15 g·L-1,玉米粉35 g·L-1,硫酸铵5 g·L-1,磷酸二氢钾 5 g·L-1,硫酸镁3 g·L-1,微量元素母液10 mL,维生素B1 20 mg,维生素B2 10 mg,维生素B6 10 mg,pH调至6.8~7.0,121℃灭菌20 min。微量元素母液同融合子种子培养基。
1.1.3 主要药品和试剂 (1)渗透压稳定剂:pH 6.0的0.2 mol·L-1磷酸盐缓冲液,0.6 mol·L-1氯化钠,121℃灭菌20 min。(2)甘氨酸溶液:称取20 g甘氨酸溶于100 mL水中,用0.22 μm的针头式过滤器过滤除菌,-4℃保藏。(3)溶壁酶,购自于广东微生物菌种保藏中心;蝸牛酶和纤维素酶均购自于生工生物工程(上海)有限公司。(4)PEG6000购自于国药集团化学试剂有限公司。
1.1.4 主要仪器设备 高速冷冻离心机为贝克曼公司制造;UV2100型紫外可见分光光度计为尤尼柯(上海)仪器有限公司制造;梅特勒 pH计为瑞士梅特勒托利多集团制造;索氏抽提仪为上海洪纪仪器设备有限公司制造;高效液相色谱为日本岛津公司制造。
1.2 试验方法
1.2.1 蛹虫草菌株FY1421原生质体制备 将蛹虫草菌株FY1421接种至固体斜面培养基,26℃培养7 d。取培养好的蛹虫草FY1421新鲜斜面,加入5 mL的无菌水,将孢子洗脱下来,用脱脂棉过滤获得孢子悬液,孢子浓度为5.0×107个·mL-1。取100 μL孢子悬液接种至50 mL菌丝培养液中,添加终浓度为0.5%的甘氨酸,置于恒温摇床中26℃、220 r·min-1振荡培养24 h,离心收集菌丝体,用渗透压稳定剂重悬,洗涤离心1次,去除残留的培养基,得到制备原生质体的出发菌丝体。取少量FY1421出发菌丝体进行适当稀释后取100 μL涂布于固体PDA培养基上,26℃培养至长出菌落,计算菌落数A。
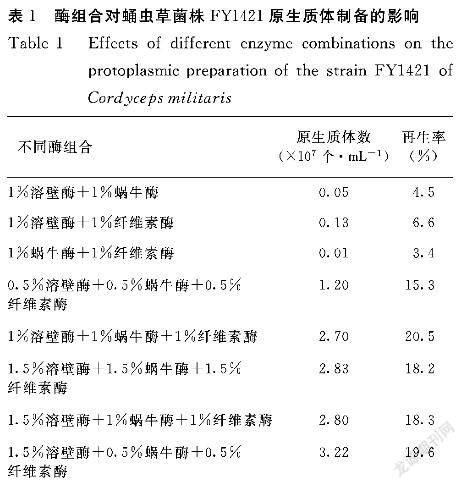
在每一支离心管菌丝体中分别加入10 mL不同浓度配比的溶壁酶蜗牛酶纤维素酶混合酶液(浓度配比包括1%溶壁酶+1%蜗牛酶、1%溶壁酶+1%纤维素酶、1%蜗牛酶+1%纤维素酶,0.5%溶壁酶+0.5%蜗牛酶+0.5%纤维素酶、1%溶壁酶+1%蜗牛酶+1%纤维素酶、1.5%溶壁酶+1.5%蜗牛酶+1.5%纤维素酶、1.5%溶壁酶+1%蜗牛酶+1%纤维素酶、1.5%溶壁酶+0.5%蜗牛酶+0.5%纤维素酶),30℃水浴酶解,每隔5 min轻摇混匀,使原生质体脱落,每隔30 min镜检观察原生质体形成情况。酶解时间设置为30、60、90、120、150、180 min,酶解结束后用脱脂棉过滤除去菌丝,3000r·min-1离心15 min,并用渗透压稳定剂洗涤离心2次除酶,用适量的高渗溶液重悬得到蛹虫草菌株FY1421的原生质体[8]。
1.2.2 深黄被孢霉原生质体制备 取培养好的Z0108新鲜斜面制备孢子悬液,孢子浓度为1.7×109个·mL-1。接种20 μL孢子悬液至50 mL菌丝培养液中,添加终浓度为1%的甘氨酸,28℃、220 r·min-1振荡培养16h,离心收集菌丝体,用渗透压稳定剂洗涤离心1次,得到制备原生质体的出发菌丝体。取少量Z0108出发菌丝体进行适当稀释后取100μL涂布于固体PDA培养基上,28℃培养至长出菌落,计算菌落数A′。
在每一支离心管菌丝体中分别加入10 mL不同浓度配比的溶壁酶蜗牛酶纤维素酶混合酶液(浓度配比同1.2.1中蛹虫草菌株FY1421原生质体制备),30℃水浴酶解,每隔5 min轻摇混匀,使原生质体脱落,每隔30 min镜检观察原生质体形成情况。酶解时间设置为1、2、3、4、5、6 h,酶解结束后用脱脂棉过滤除去菌丝,3000r·min-1离心15 min,并用渗透压稳定剂洗涤离心2次除酶,用适量的高渗溶液重悬得到深黄被孢霉菌株Z0108的原生质体[9-10]。
1.2.3 原生质体再生 将两菌株的原生质体悬液用渗透压稳定剂梯度稀释后取100 μL涂布于再生培养基平板上,培养至长出菌落,计算FY1421菌落数B及Z0108菌落数B′。另外,将原生质体用无菌水梯度稀释后涂布于再生培养基平板,计算长出的FY1421菌落数C及Z0108菌落数C′。根据试验结果结合后续试验需求选择合适的原生质体制备与再生条件。
1.2.4 原生質体灭活 蛹虫草菌株FY1421原生质体的灭活条件为热灭活。取多支5 mL 离心管中放入1 mL 原生质体悬液,于恒温水浴锅中分别进行50、55、60、65℃热灭活处理,灭活时间分别为5、10、15、20 min,每梯度3次重复,并设置对照组。每隔5 min 轻轻振荡离心管1次。灭活后涂布再生板培养,计算不同温度和时间的致死率。
深黄被孢霉原生质体灭活方式为紫外线灭活。取1mL原生质体置于6cm平皿中,在功率为30W的紫外灯下,照射距离为20cm处开盖,避免白光干扰条件下垂直照射15、20、25、30、35、40 s进行紫外灭活。涂布再生平板在28℃恒温培养箱中培养至长出单菌落,计算致死率。
1.2.5 原生质体融合与再生 采用最优灭活条件灭活后的两亲株原生质体等体积混合,3000r·min-1离心15min,分别加入1mL 40%的PEG6000(含0.04 mol·L-1的CaCl2),轻柔混匀,置于30、33、35、37℃水浴中分别促融10、15、20min,加入渗透压稳定剂终止反应后离心,重悬后稀释一定倍数后涂布再生平板,26℃培养7~9d至长出再生菌落,计算融合率。
1.2.6 融合子的检出 平板长出的再生菌落,经形态、颜色甄别后挑选类似融合子进行96微孔板初筛及摇瓶发酵复筛,发酵结束后检测虫草素及油脂含量,筛选出既能生产虫草素和腺苷,且油脂含量高的融合菌。收集发酵菌丝采用HPLC测定虫草素的含量[11],采用索氏提取法[12]测定油脂含量。
1.3 数据处理与分析
计算公式:菌株FY1421原生质体再生率=(B-C)/(A-C)×100%,菌株Z0108原生质体再生率=(B′-C′)/(A′-C′)×100%。融合率=再生菌落数/双亲原生质体总数×100%。试验数据采用Excel 进行统计分析及作图。
2 结果与分析
2.1 蛹虫草菌株FY1421原生质体制备最佳条件的选择
2.1.1 酶系统的选择 蛹虫草菌株FY1421及深黄被孢霉Z0108皆为丝状真菌,细胞壁的主要成分为几丁质、葡聚糖层、纤维素等,因此选用了溶壁酶、蜗牛酶及纤维素酶的组合进行破壁。由表1可见,采用1.5%溶壁酶+0.5%蜗牛酶+0.5%纤维素酶的混合酶液处理蛹虫草菌株FY1421时,原生质体的形成数量最多,达到3.22×107个·mL-1,此时的再生率也最高,为20.5%。因此选用1.5%溶壁酶+0.5%蜗牛酶+0.5%纤维素酶的混合酶液作为制备蛹虫草菌株FY1421原生质体的最适酶液。
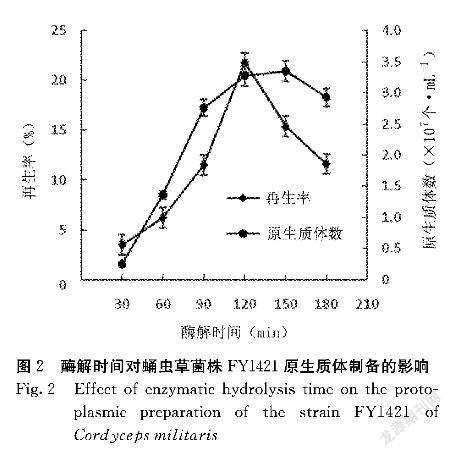
2.1.2 酶解时间的选择 用最适酶液组合处理蛹虫草菌株FY1421的菌丝体,随着酶解时间的增加,通过显微镜观察到越来越多的球状原生质体从菌丝端脱落,最终在视野中全部变为球形的原生质体。图2结果显示,蛹虫草菌株FY1421随着酶解时间的延长原生质体数量迅速增加,在酶解90min后增速变缓,酶解150min时原生质体达数最多,达到3.35×107个·mL-1,继续延长酶解时间,原生质体数稍有减少,再生率在酶解120min时最高,达到21.8%,再延长酶解时间则再生率显著下降,可能是由于时间过长部分原生质体酶解过度破裂。
2.2 深黄被孢霉菌株Z0108原生质体制备最佳条件的选择
2.2.1 酶系统的选择 由表2可见,采用1%溶壁酶+1%蜗牛酶+1%纤维素酶的混合酶液处理深黄被孢霉菌株Z0108时,原生质体生成数量最多,达到7.99×106个·mL-1,再生率也最高。选择1%溶壁酶+1%蜗牛酶+1%纤维素酶的混合酶液作为制备深黄被孢霉菌株Z0108的最佳酶液。
2.2.2 酶解时间的选择 深黄被孢霉菌株Z0108的原生质体数随着酶解时间延长快速增加,在酶解4 h后原生质体数增加速度趋缓,由图3可见,酶解6 h时,原生质体数达到最多。再生率在酶解之初随着原生质体数量增加而不断增加,在酶解4 h时达到最大,为17.3%,继续延长酶解时间再生率显著下降,可能原因是酶解时间太长时细胞膜受损,导致难以再生。因此选择酶解4 h为最佳的酶解时间。
2.3 原生质体灭活条件确定
由表3可见,采用60℃以下温度进行灭活蛹虫草菌株FY1421原生质体时,时间延长至20 min也达不到100%的致死率,灭活温度为60℃时,灭活10 min即可达到100%的致死率,因此选择60℃灭活10 min为蛹虫草菌株FY1421原生质体的灭活最佳条件。
如图4所示,深黄被孢霉菌株Z0108原生质体对紫外线照射比较敏感,在距离30 W紫外灯20 cm处照射25 s时致死率达到了95%。为了后续融合子的检出,需去除亲株的干扰,选择紫外线灭活30 s,深黄被孢霉Z0108原生质体的灭活率达100%。
2.4 融合条件的确定
采用40%的PEG6000(含0.04%的CaCl2)進行促融,由表4可见,融合温度选择35℃、时间为10 min时融合率最高。温度偏低或偏高融合率都相对降低,融合时间太短时,可能有的原生质体还没实现融合;而时间太长可能促融剂对细胞有毒害作用,造成融合率下降。
2.5 融合子检出
蛹虫草菌落为浅黄色,而深黄被孢霉菌落颜色为深灰色,菌落的颜色差异有助于识别融合子。在
融合子再生平板上挑选了颜色与亲株有区别的菌株650株进行96孔板初筛,得到83株发酵产物中既含有虫草素,又含有较高油脂产量的融合菌株。进行摇瓶发酵验证,筛选得到12株虫草素含量较高,且油脂含量提高幅度较大的融合菌,摇瓶发酵结果见图5,其中1株编号为RCS262的融合菌,虫草素含量为5926 μg·g-1,油脂含量达到37.5%,实现了高产虫草素且富含油脂的目标。将融合菌连续传代5次,每一代进行摇瓶发酵验证虫草素及油脂含量,产量差异在5%范围内,基本保证了遗传的稳定性。
3 结论与讨论
本研究以高产虫草素的蛹虫草菌株FY1421及高产油脂的深黄被孢霉Z0108为出发菌株,利用原生质体融合技术促进两亲株种间杂交。首先对两亲株原生质体制备的条件进行探索,对制备原生质体的关键因素优化组合,找到了最佳的原生质体制备条件,即蛹虫草菌株FY1421的原生质体制备条件为:采用1.5%溶壁酶+0.5%蜗牛酶+0.5%纤维素酶的混合酶液30℃水浴酶解120 min,可获得最高的原生质体制备率及再生率;深黄被孢霉Z0108的原生质体制备条件为:采用1%溶壁酶+1%蜗牛酶+1%纤维素酶的混合酶液在30℃水浴酶解4 h,可获得最高的原生质体制备率及再生率。虽然两株出发菌株均为丝状真菌,但由于菌株不同,细胞壁的成分存在一定差异,其最适的酶及酶解条件也不尽相同。
对两个亲株分别采取高温和紫外方式灭活,采取不同的方式灭活可使细胞受损的机制不一致,以便在后期融合时两亲株能够优势互补而修复,从而获得融合子。本研究从众多融合子中筛选的融合菌株RCS262获得了双亲的高产性能,虫草素产量达到5926 μg·g-1,油脂含量达到37.5%,这可能是双亲细胞核相互作用的结果,但距离原亲株的产量还有一定差距,可能与细胞在融合过程中受到的损伤有关系。然而加热及紫外照射也是一种诱变育种的方式,从理论上说有获得更高产量的可能性,有待进一步试验筛选。另外,融合子从菌丝形态与生长特性来说与亲本之一的蛹虫草菌株较为相似,而且扩增其ITS(Internal Transcribed Spacer)序列比对发现,其与亲本之一的蛹虫草菌株的相似性达到97.7%以上(结果另文发表),初步确认融合子仍为蛹虫草菌株。
融合菌株通常稳定性不高,易在后期传代的过程中出现分离。本研究中获得的大多数融合菌株在传代3~4次之后逐渐出现分离,恢复亲株的性状。融合菌株RCS262虽经过了多代分离,其遗传性状仍然保持稳定,但其优良性状能否长期保持,是否还有其他双亲没有的性状以及与双亲的合成与代谢的差异将在后续从不同方面进一步探讨。
参考文献:
[1]陈俐彤,曹红峰,黄文芳.蛹虫草的化学成分、药效及应用[J].现代食品科技,2005,21(3):192-197.
[2]TANG J P,LIU Y T,ZHU L.Optimization of fermentation conditions and purification of cordycepin from Cordyceps militaris[J].Preparative Biochemistry and Biotechnology,2014,44(1):90-106.
[3]黄冕,张松.虫草素生理功效的研究进展[J].菌物研究,2010,8(4):234-244.
[4]ZHANG X W,LI M C,WEI D S,et al.Disruption of the Fatty Acid Δ6Desaturase Gene in the Oilproducing Fungus Mortierella Isabellinaby Homologous Recombination[J].Current Microbiology,2007,55(2):128-134.
[5]蔡双连.深黄被孢霉提取物降血脂和血糖作用的研究[D].福州:福建师范大学,2004.
[6]刘宝,陶文静,张忠恒,等.黄花烟草和枸杞属间原生质体融合再生杂种小苗[J].实验生物学报,1995,28(3):319-327.
[7]刘冰,宗兆锋,王记侠.重寄生链霉菌F46与生防放线菌SC11融合菌株的筛选[J].西北农林科技大学学报(自然科学版),2006,34(3):93-97.
[8]施巧琴,吴松刚.工业微生物育种学[M].北京:科学出版社,2003.
[9]李明春,邢来君.γ亚麻酸生产菌深黄被孢霉原生质作的形成和再生[J].菌物系统,1997,16(1):24-29.
[10]徐新丽,谢必峰.深黄被孢霉3.3410原生质体的制备和再生研究[J].生物技术,2009,19(2):46-48.
[11]刘春泉,宋江峰,李大婧,等.虫草素的提取纯化及测定方法研究进展[J].食品科学,2007, 28(11):596-599.
[12]李植峰,玲张,沈晓京,等.四种真菌油脂提取方法的比较研究[J].微生物学通报,2001,28(6):72-75.
(责任编辑:柯文辉)
2019年第11期

