贵州苗药方“四大血”对CIA大鼠滑膜血管增生的作用机制
袁桃花,黄宇键,李佳豪,曹 恒,吴昌学,吴 宁
(贵州医科大学:1. 基础医学院;2. 临床医学院;3. 医学分子生物学重点实验室,贵州贵阳 550025)
类风湿性关节炎(rheumatoid arthritis, RA)是一种以侵犯小关节滑膜并伴有炎症的对称性慢性自身免疫性疾病[1],目前其发病机制尚不明确。多数RA患者关节组织都会形成血管翳症状,而血管内皮生长因子(vascular endothelial growth factor, VEGF)及血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)作为促血管内皮细胞分裂及增殖的重要因子,可介导滑膜组织中血管形成,增加微血管通透性,加重血管翳症状。RA作为一种炎症性疾病,体内促炎因子可激活磷酯酰肌醇3激酶/蛋白激酶B(phosphtidylinositol 3-kinase/protein kinase B, PI3K/AKT)通路,促使VEGF、VEGFR-2表达上调[2-3],从而加速血管形成,增加血管通透性,更利于炎症因子释放,造成恶性循环,加重病情。PI3K/AKT通路外蛋白人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome ten, PTEN)可使缺氧诱导因子-1α失活,同时抑制PI3K/AKT通路活化,降低 VEGF表达,延缓疾病恶化程度。
目前,临床上对RA的治疗主要靠抗风湿药、糖皮质激素等药物改善病情[4],但均存在一定的毒副作用,因此开发毒副作用小、疗效较为显著的新药尤为必要。苗医验方“四大血”(SX)由苗药黑骨藤、见血飞、五花血藤、鸡血藤4种藤本药材组成,作为贵州苗族地区治疗RA的特有药方,有治疗气血瘀阻等功效[5-6]。但目前SX仍处于经验用药阶段,且国内相关研究较少。本课题组前期研究结果显示,SX水煎液对RA的动物模型-佐剂性关节炎大鼠有明显疗效,可以减轻关节肿胀程度,抑制关节滑膜组织增生等临床病理表现,且能下调肿瘤坏死因子-α、白细胞介素1-β等炎症因子的表达[4-5]。胶原诱导关节炎大鼠(collagen induced arthritis in rats, CIA)在致炎后有血管翳表现,其发病机制与人RA极为相似,是目前研究RA的理想模型。本研究通过CIA检测VEGF、VEGFR-2含量及PTEN/PI3K/AKT通路中相关蛋白的表达,结合病理组织切片,观察SX对RA的疗效,进一步阐述其治疗机制,为SX临床药物的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物与试剂 实验动物:SD大鼠,42只,雌雄各半,体质量180~220 g,由重庆腾鑫生物技术有限公司提供,合格证号[SCXK(渝)2007.005]。苗药“四大血”由苗药nangx dlob ghat(仰嗟嘎)、hsob hxangt(梭向)、ghab jongx bel sob xok(嘎龚布梭学)、vob mongb dlenb(莴蒙棱)4种藤本药材组成,并由贵阳中医学院苗医药教研室提供,并经田振华副教授鉴定为鸡血藤、五花血藤、见血飞、黑骨藤;雷公藤多苷片购自黄石飞云制药公司,批号:20080301;不完全弗氏佐剂购自美国Sigma公司,批号:033K8933;大鼠VEGF定量分析酶联免疫检测试剂购自安徽巧伊生物技术有限公司;Pten抗体(A2B1)购自Santa Cruz公司;PI3K和AKT抗体均购自Cell Signaling公司;兔、鼠二抗购自Bioworld公司;PCR逆转录试剂盒购自宝日医生物技术(北京)有限公司。
1.1.2主要仪器 水平电泳槽DYY-Ⅲ 31D,北京六一仪器厂;Quanity One凝胶成像分析系统,美国BIO-RAD公司;DYY-5型稳压稳流电泳仪,北京六一仪器厂。
1.2 实验方法
1.2.1实验动物分组 将42只SD大鼠随机分成“四大血”高剂量组(SX 40 g/kg组)、“四大血”中剂量组(SX 20 g/kg组)、“四大血”低剂量组(SX 10 g/kg组),雷公藤多苷片对照组(GTW)、空白对照组(Nor)、模型组(Mod),共6组,每组7只。
1.2.2CIA大鼠模型的构建 取2 mg/mL牛Ⅱ型胶原适量在冰上与等量不完全弗氏佐剂混合,均匀充分乳化后,加一滴乳化剂于水中以不扩散为准,取乳化后的混合物200 μL于尾根部皮下注射免疫[7],1周后以100 μL乳剂于尾根部皮下加强免疫1次。Nor、Mod对照组在尾根部皮下注射同量生理盐水(NS),总计2次免疫,通过关节炎指数(arthritis index, AI)评分判定造模情况[8]。
1.2.3药物的制备 取SX共2 000 g(五花血藤、鸡血藤、见血飞、黑骨藤比例为15∶22∶15∶8),加适量水煮3次(时间分别为1 h、30 min、30 min),合并浓缩液500 mL为受试药,浓度为4 kg/L(按生药量计),置于4 ℃冰箱备用(保存1周)。
1.2.4发病严重程度的观察及检测 ①大鼠关节症状表现。每日定期观察大鼠情况,如红肿、关节畸形等,拍照记录[1]。并在初次注射乳化剂当天,观察大鼠后足关节,之后隔7 d观察1次,进行AI评分。AI评分标准:0分(无红肿);1分(关节有红色斑点或轻度肿胀);2分(关节病变中度红肿);3分(关节除中度红肿外,伴有轻度功能障碍);4分(关节重度红肿,僵直甚至畸形,严重功能障碍)。其中达到2分及2分以上为造模成功。②关节足肿度。致炎前及自初次免疫时起,每周采用排水法测大鼠双后足跖容积,测3次取均值,计算足趾肿胀度。肿胀度公式:ER(%)=(Va-Vb)/Vb×100%(其中Vb为造模前的容积,Va造模后的容积)。
1.2.5给药方案 造模成功后2 d除Nor组及Mod组灌NS外,其余组药物灌胃,GTW组和SX 40 g/kg组灌胃为40 g/kg,SX 20 g/kg组、SX 10 g/kg组分别为20 g/kg、10 g/kg(按生药量计),每日1次,连续21 d[6]。
1.2.6标本采集 于末次给药次日用100 g/L水合氯醛对CIA大鼠进行麻醉,取心脏血之后麻醉处死大鼠,取各组大鼠炎性后腿,-80 ℃冰箱中备用。
1.2.7病理组织切片制备 操作流程:脱蜡→染色→水洗→分化→漂洗→脱水Ⅰ→复染→脱水Ⅱ→烤片→中性树胶封片→显微镜下观察。
1.2.8ELISA法测各组大鼠血清中VEGF的表达 操作步骤按大鼠VEGF检测ELISA试剂盒的说明书进行,试验结果判定以酶标仪的读数为准。
1.2.9RT-PCR法检测CIA大鼠关节滑膜组织中VEGF及VEGFR-2 mRNA的含量 ①RT-PCR引物的设计合成。根据GenBank提供大鼠VEGF mRNA序列(AY702972)、VEGFR-2 mRNA序列(U93306.1)、GAPDH mRNA序列(NM_017008)。利用Primer Premier 5.0软件进行引物设计,所得序列用Primer-Blast验证,确定其特异性。通过引物公司合成,设计的引物如下表(表1)。②标本制备及逆转录。按Trizol Reagent试剂盒提取总RNA,溶于DEPC水中(-80 ℃保存备用)。取上述RNA样本1 μL于超微量紫外分光光度计上测RNA样品A260与A280比值及其RNA浓度(ng/L),比值为1.8~2.0,RNA无降解。之后按照逆转录试剂盒进行逆转录,将cDNA保存在-20 ℃冰箱备用。③实时荧光定量PCR。按照实时荧光定量PCR试剂盒处理反转录样本后,进行样本扩增,预变性,95 ℃ 5 min;循环反应,95 ℃ 10s,60 ℃ 30 s,循环40次;溶解曲线,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。用2-△△Ct计算法处理数据。
表1 各基因的引物序列
Tab.1 Oligonucleotide primers used for Real-time PCR

Gene类型ForwardReverseVEGF5′-CCTGGCTTTACTGCTGTACCT-3′5′-GCTGGTAGACGTCCATGAACT-3′VEGFR-25′-CCTTAGGTGCTTCCCCATATC-3′5′-GAGCCCGCATTCTCGTTC-3′GAPDH5′-GTGCCAAAAGGGTCATCATCTC-3′5′-GGTTCACACCCATCACAAACATG-3′
1.2.10Western blot检测滑膜组织中PTEN、PI3K、AKT蛋白表达 取大鼠滑膜组织,液氮研磨,提取样本,用BCA试剂盒测蛋白浓度。蛋白变性后取20 g进行上样电泳,按200 mA、2 h条件进行转膜,50 g/L脱脂奶粉封闭过夜,孵育一抗(beta-actin;PTEN、AKT、PI3K抗体的稀释比及孵育时间:1∶7 000,室温2 h;1∶1 000,4 ℃过夜),洗膜(每次10 min,洗3次),孵育二抗(兔和鼠二抗的稀释比分别为1∶1 000和1∶5 000,室温脱色摇床缓慢摇动90 min),加入洗涤液(1×TBST)进行洗膜,曝光显影,凝胶成像仪上进行蛋白条带检测和灰度分析。

2 结 果
2.1 SX对CIA大鼠关节肿胀度及AI评分的影响
各组大鼠造模后,双后肢基本全部出现不同程度的红肿。根据AI评分和足肿度结果,各给药组大鼠给药后双后肢膝、踝和趾间关节红肿均逐渐减退。连续给药2周后,相比于Mod组,SX 40 g/kg组、SX 20 g/kg足肿度下降(P<0.05);到给药3周后,SX组、GTW组均较Mod组减小,以SX 40 g/kg组和GTW组较为明显(P<0.01)。给药2周后,SX组AI评分低于Mod组(P<0.05,P<0.01);给药3周后,SX所有组评分均低于Mod组(P<0.01,表2、表3,图1、图2)。
2.2 组织病理学变化
2.2.1大鼠滑膜组织病理切片观察 从切片中可见,Nor组足趾滑膜组织未见明显的炎性细胞浸润。Mod组真皮乳头层和网状层可见大量炎性细胞浸润,纤维组织增生、水肿,偶见各层组织结构紊乱,上皮组织破坏。GTW组炎性细胞明显减少,浸润程度减轻。SX 40 g/kg组织偶见极少量散在分布的炎性细胞,SX 20 g/kg组炎性细胞浸润明显下降,纤维组织增生水肿减轻,但SX 10 g/kg组仍可见较多炎性细胞浸润、组织水肿(图3)。
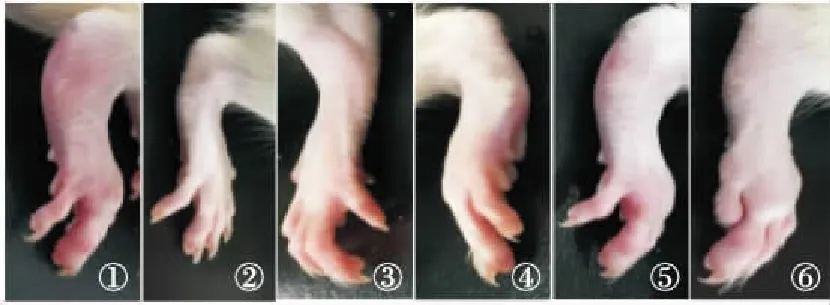
图1 各组大鼠关节肿胀度
Fig.1 Degree of joint swelling in rats of each group
①Mod组;②Nor组;③ GTW组;④SX 40 g/kg组;⑤SX 20 g/kg组;⑥SX 10 g/kg组。
表2 SX对CIA大鼠关节肿胀度的影响


分组14d23d30d37dNor组0.16±0.110.11±0.080.12±0.030.14±0.11Mod组1.03±0.07#0.95±0.22#1.02±0.24#0.98±0.23#GTW组0.93±0.08#0.72±0.010.55±0.02∗0.34±0.09∗∗ SX 40g/kg组1.10±0.06#0.74±0.170.59±0.06∗0.32±0.20∗∗SX 20g/kg组1.12±0.10#0.79±0.300.71±0.110.46±0.05∗SX 10g/kg组0.96±0.11#0.80±0.120.74±0.230.51±0.20∗
与Nor组相比,#P<0.05;与Mod组相比,*P<0.05,**P<0.01。
表3 SX对CIA大鼠关节炎指数评分的影响


分组7d14d23d30d37dNor组0.00±0.000.00±0.000.00±0.000.00±0.000.00±0.00Mod组4.86±1.47##7.14±0.90##6.57±1.27##7.00±1.00##7.43±0.79##GTW组5.29±1.117.00±0.825.57±0.794.29±0.76∗∗2.57±0.79∗∗SX 40g/kg组4.86±0.96.86±1.006.86±0.695.29±1.11∗2.71±1.60∗∗SX 20g/kg组4.29±1.987.14±0.904.57±0.533.29±1.11∗∗1.86±0.69∗∗SX 10g/kg组5.42±0.987.29±0.766.14±0.695.29±0.76∗3.57±1.27∗∗
与Nor组相比,##P<0.01;与Mod组相比,*P<0.05,**P<0.01。
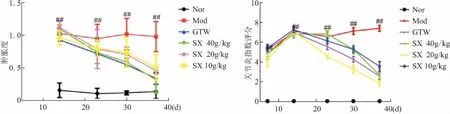
图2 SX对CIA大鼠关节肿胀度及AI评分的影响
Fig.2 Effect of SX on joint swelling and arthritis index score of CIA rats (n=7)
与Nor组相比,##P<0.01。

图3 各组大鼠组织病理学变化
Fig.3 Pathological tissue section of each group (×400)
①A、B、C、D、E、F依次代表Nor组、Mod组、GTW组、SX 40 g/kg组、SX 20 g/kg组、SX 10 g/kg组。
2.2.2切片炎症细胞计数 在400倍光镜下用高清图像采集系统随机选取5个区域进行炎性细胞计数(每组5张切片)。与Mod组比较,SX组、GTW组炎性细胞浸润数都出现明显下降(P<0.01)。Nor组炎性细胞浸润数明显少于SX 10 g/kg组(P<0.01)。与GTW组相比,SX 40 g/kg组、SX 20 g/kg组炎性细胞浸润数接近,差异无统计学意义(P>0.05);相比于Mod组,SX组大鼠足趾组织炎症程度均有减轻的趋势,尤其以SX 40 g/kg组、SX 20 g/kg组最为明显(P<0.01,表4)。
2.3 对大鼠血清中VEGF含量的影响与Nor组相比,Mod组大鼠血清中VEGF含量明显升高(P<0.01);SX组及GTW治疗组均比Mod组低(P<0.01);SX 20 g/kg组、SX 10 g/kg组与GTW组比较无统计学差异(P>0.05);SX 40 g/kg组比GTW组明显升高(P<0.01);SX各剂量组中VEGF含量未呈现出与灌胃浓度的反比关系(表5)。
表4 各组CIA大鼠足趾炎症肿胀组织炎性细胞浸润计数

组别炎性细胞数Nor组7.74±4.52∗∗Mod组189.38±14.35GTW组28.92±13.01∗∗SX 40g/kg组9.88±3.43∗∗SX 20g/kg组41.46±13.03∗∗SX 10g/kg组155.93±15.39∗∗△△
与Mod组相比,**P<0.01;与Nor组相比,△△P<0.01。
表5 各组CIA大鼠血清VEGF含量
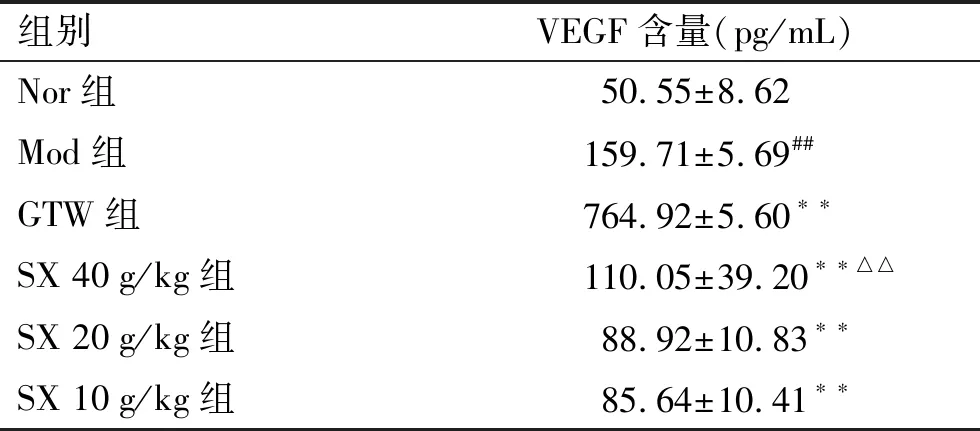
组别VEGF含量(pg/mL)Nor组50.55±8.62Mod组159.71±5.69##GTW组764.92±5.60∗∗SX 40g/kg组110.05±39.20∗∗△△SX 20g/kg组88.92±10.83∗∗SX 10g/kg组85.64±10.41∗∗
与Nor组相比,##P<0.01;与Mod组相比,**P<0.01;与GTW组相比,△△P<0.01。
2.4 SX对CIA大鼠滑膜关节组织VEGF、VEGFR-2 mRNA表达的影响给药21 d,与Mod组比较,SX组VEGF mRNA含量均降低,其中SX 10 g/kg和SX 40 g/kg可下调VEGF mRNA的表达(P<0.01)。与Mod组相比,SX能不同程度地降低VEGFR-2 mRNA的表达(P<0.01)。与Nor组相比,SX组、GTW组的VEGF、VEGFR-2 mRNA的含量差异不大(P>0.05,图4)。

图4 SX对CIA大鼠滑膜组织VEGF、VEGRR-2 mRNA表达的影响
Fig.4 Effect of SX on the expressions of VEGF and VEGFR-2 mRNA in synovial tissue of CIA rats
与Mod组相比,*P<0.05,**P<0.01。
2.5 SX对CIA大鼠滑膜组织PTEN/PI3K/AKT通路中相关蛋白表达的影响给药21 d后,与Nor组相比,Mod组PTEN表达量下调(P<0.01)。与Mod组相比,SX各剂量组能明显上调(P<0.01,P<0.05),SX 40 g/kg组和SX 20 g/kg组作用和GTW组相当(P>0.05)。与Nor组相比,Mod组PI3K蛋白表达量明显上调(P<0.05);与Mod组比较,SX 40 g/kg组、SX 20 g/kg下调(P<0.05);SX 10 g/kg组与Mod组比较差异无统计学意义(P>0.05),而SX各剂量组和GTW组相比差异无统计学意义(P>0.05)。Mod组AKT磷酸化水平相比于Nor组明显升高(P<0.01),而与Mod组相比,SX可以抑制AKT的磷酸化水平(P<0.01),其与GTW组相比磷酸化水平相当,差异无统计学意义(P>0.05,图5、图6)。

图5 SX对CIA大鼠滑膜组织PTEN/PI3K/AKT通路蛋白的影响
Fig. 5 Effect of SX on PTEN/PI3K/AKT pathway protein in synovial tissue of CIA rats
①SX 40 g/kg组;②SX 20 g/kg组;③SX 10 g/kg组;④GTW组;⑤Mod组;⑥Nor组。

图6 SX对CIA大鼠滑膜组织PTEN、PI3K、AKT蛋白表达的影响
Fig.6 Effects of SX on the expressions of PTEN, PI3K, and AKT protein in synovial tissue of CIA rats
与Nor组比较,#P<0.05,##P<0.01;与Mod组比较,*P<0.05,**P<0.01;与GTW组比较,△P<0.05。
3 讨 论
类风湿性关节炎属难治愈疾病,其病理反应主要是炎症、滑膜血管增生、软骨及骨组织破坏等,过度增生的滑膜血管及大量炎性细胞会导致血管翳的形成[9]。在血管翳微环境中,血管通透性增加,更便于炎性细胞释放,造成恶性循环,加重病情,增加治疗难度。VEGF高表达能增加血管通透性,诱导骨髓内的内皮细胞活化,进而促进血管新生,加重血管翳症状。VEGFR-2作为VEGF家族中重要的血管因子受体,可加强VEGF活性;同时,活化的VEGFR-2可以激活PI3K-AKT途径[10],上调VEGF表达。在典型的PI3K/AKT激活通路中,AKT及其上游的3-磷脂肌醇依赖性蛋白激酶-1(PDK1)通过其PH结构域与磷脂酰肌醇的相互作用募集到细胞膜,由PI3K产生P3,再通过PDK1激活T环中Thr308启动AKT磷酸化[8]。PTEN作为负调控因子,具有多种功能,其脂质磷酸酶活性可通过PI3K的D3位发生去磷酸化生成PIP2,进而阻碍PI3K对AKT的磷酸化作用,负调控PI3K/AKT信号通路介导的血管内皮细胞活动[11],下调VEGF及VEGFR-2的表达。
SX作为苗族地区治疗RA的特有药方,通过AI评分、关节肿胀度检测和及病理组织检查,发现SX能明显改善CIA大鼠关节肿胀,减轻关节滑膜组织中炎性细胞浸润。此外,SX能活化负调控因子PTEN及抑制PI3K、AKT蛋白的表达,下调VEGF mRNA、VEGFR-2 mRNA的表达,且VEGF蛋白与mRNA表达均下调。CIA模型大鼠滑膜组织中PTEN表达下调,表明炎症环境能抑制PTEN的表达,从而激活PI3K/AKT通路。SX可通过上调PTEN的表达减弱PI3K/AKT的活化,抑制下游VEGF及VEGFR-2的表达,缓解滑膜血管新生和炎症,从而发挥治疗作用。
综上所述,SX减轻血管翳及炎性症状与PTEN/PI3K/AKT、VEGF/VEGFR-2通路密切相关,提示SX具有重要的药用价值。页

