基于SCoT分子标记的48份杨桃种质遗传多样性分析
欧景莉 朱杨帆 陈豪军 周俊岸 陈燕 何江 宁琳 潘祖建 甘卫堂



摘要:【目的】分析48份楊桃种质的遗传多样性,为杨桃种质资源的鉴定保护及开发利用提供理论依据。【方法】从60条SCoT引物中筛选出扩增条带清晰稳定、多态性丰富的引物,对从国内外收集的48份杨桃种质材料进行PCR扩增,统计分析电泳图谱,利用Popgene 1.32计算其遗传多样性参数,采用NTSYSpc 2.1计算种质间的遗传相似系数和遗传距离,利用UPGMA法进行聚类分析,并根据遗传相似系数进行主成分分析。【结果】从60条SCoT引物中筛选出的11条引物共扩增出115条条带,其中多态性条带102条,占总条带数的88.7%,每条SCoT引物扩增的总条带数(TNB)和多态性条带数(NPB)分别为10.45和9.27条,多态性比率(PPB)为70.00%~100.00%,平均为88.84%;多态性信息量(PIC)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)和Shannon’s信息指数(I)的平均值分别为0.77、1.7758、0.4229和0.6061。48份杨桃种质间的遗传相似系数为0.4957~0.9217,平均为0.6841。聚类分析结果显示,在遗传相似系数0.6618处可将48份杨桃种质划分为三大类群,第Ⅰ类群均为甜杨桃种质,第Ⅱ类群以酸杨桃种质为主,第Ⅲ类群以甜杨桃种质为主。主成分分析结果与聚类分析结果基本一致,均与杨桃的果实风味和种质来源高度相关。【结论】杨桃种质资源具有较丰富的遗传多样性,且筛选获得的SCoT引物对杨桃种质资源有较高的多态性检测率,适用于杨桃种质资源鉴别及亲缘关系分析。
关键词: 杨桃;遗传多样性;SCoT标记;聚类分析;主成分分析
中图分类号: S667.902.4 文献标志码: A 文章编号:2095-1191(2019)08-1680-08
Genetic relationship analysis of 48 Averrhoa carambola L. germplasms based on SCoT marker
OU Jing-li, ZHU Yang-fan, CHEN Hao-jun*, ZHOU Jun-an, CHEN Yan, HE Jiang,NING Lin, PAN Zu-jian, GAN Wei-tang
(Guangxi Subtropical Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530001, China)
Abstract:【Objective】In order to provide theoretical support and reference for the identification,protection,development and utilization of Averrhoa carambola L. germplasm resources,the present study analyzed the genetic diversity of 48 A. carambola germplasms. 【Method】SCoT primers with rich polymorphism and clear amplified bands were screened out from 60 primers,the 48 A. carambola germplasm resources collected from home and abroad were amplified by PCR. The electrophoretogram was analyzed, and genetic diversity parameters were calculated by Popgene 1.32. Then the genetic similarity coefficient and genetic distance between different germplasms were calculated using NTSYSpc 2.1. The unweighted pair-group method with arithmetic mean(UPGMA) method was used for cluster analysis. Based on the genetic similarity,principal coordinate analysis was also carried out. 【Result】A total of 115 bands were amplified from 11 primers which screened out from 60 SCoT primers,including 102 polymorphic bands, accounting for 88.7% of the total. The total number of bands(TNB) and polymorphic bands(NPB) amplified from each primer were 10.45 and 9.27,respectively. The percentage of polymorphism bands(PPB) was 70.00%-100.00%,with an average of 88.84%. The mean value of polymorphism information content(PIC), effective number of alleles(Ne),Nei’s gene diversity(H) and Shannon’s information index(I) were 0.77, 1.7758,0.4229 and 0.6061,respectively. The genetic similarity coefficient between different A. ca-rambola germplasms was 0.4957-0.9217,and the average was 0.6841. According to the results of cluster analysis,48 A. carambola germplasms could be divided into three groups at the genetic similarity of 0.6618. All the A. carambola germplasms in groupⅠand Ⅲ belonged to sweet A. carambola,while groupⅡwas mainly acid A. carambola. The results of principal component analysis and cluster analysis were basically consistent, and both were highly related to the fruit flavor and germplasm sources. 【Conclusion】The genetic diversity of A. carambola germplasm resources is quite rich. SCoT marker has high polymorphism detection efficiency on A. carambola germplasm. It can be used for the identification and relationship analysis of A. carambola germplasms.
Key words: Averrhoa carambola L.; genetic diversity; SCoT marker; clustering analysis; principal component analysis
0 引言
【研究意义】杨桃(Averrhoa carambola L.)为热带亚热带水果,在我国已有1500多年的栽培历史,广西、广东、福建、海南、台湾和云南等省(区)均有较大面积栽培,其可加工成罐头、蜜饯、果酒、果酱和蜜炼果膏等,满足了人们对果品多样化、营养化及保健化的需求(刘韬等,2011;刘锴栋等,2013)。杨桃种质资源较丰富,其栽培品种多由实生变异而来,故品种(系)间的形态特征极其相似,易出现同物异名或同名异物的现象,难以科学准确鉴别。此外,由于历史原因,一些地方品种的来源和亲缘关系难以确认,给杨桃种质资源的科学保护及有效利用带来了极大困难。因此,开展杨桃种质资源的遗传多样性及亲缘关系分析,对杨桃的种质鉴定及有效开发利用具有重要意义。【前人研究进展】目标起始密码子多态性分子标记(SCoT)是一种基于翻译起始位点的目的基因标记(Collard and Mackill,2009),其操作简单、多态性高、重复性好、引物通用性强,能有效产生与性状连锁的位点,可检测出不同基因型供试材料间的微小差异,准确反映种质间亲缘关系(蔡元保等,2014)。目前,SCoT分子标记已广泛应用于龙眼(陈虎等,2010,2012)、芒果(Luo et al.,2010;罗聪,2012)、枇杷(韩国辉等,2011a;龙治坚,2013)、柑橘(韩国辉等,2011b;靳佳佳,2018)、葡萄(Guo et al.,2012;王发明等,2017)、番木瓜(杨祥燕等,2013)、澳洲坚果(蔡元保等,2013)、桃(陈红等,2014)、梨(和世玉,2014;杨君祎,2015)、番石榴(何江,2017)和柿子(关长飞等,2019)等果树的种质鉴定、基因差异表达、遗传多样性和亲缘关系分析及指纹图谱构建、功能基因挖掘等。随着近年来分子标记的广泛应用,已有多位学者利用RAPD分子标记对杨桃种质的遗传多样性进行研究。戴子云(2010)研究发现,17份广东杨桃种质的地理起源与RAPD表型无相关性;刘韬等(2011)对17份福建杨桃品种进行遗传多样性分析,结果发现其具有丰富的遗传多样性;刘锴栋等(2013)研究发现,RAPD分子标记与形态标记所反映出的10份广东地区杨桃品种间的遗传多样性具有较高一致性和可信度,因此,将二者结合起来可较好地揭示杨桃种质的遗传多样性。【本研究切入点】虽然前人已采用RAPD分子標记对我国部分地区杨桃种质的遗传多样性进行分析,但供试材料较少,种质来源不够广泛,无法为杨桃种质资源的有效利用提供系统全面的参考。且目前尚无利用SCoT分子标记对杨桃种质资源进行遗传多样性分析的研究报道。【拟解决的关键问题】采用SCoT分子标记对从国内外收集的48份杨桃种质资源进行遗传多样性分析,为杨桃种质资源的鉴定保护及开发利用提供理论参考。
1 材料与方法
1. 1 试验材料
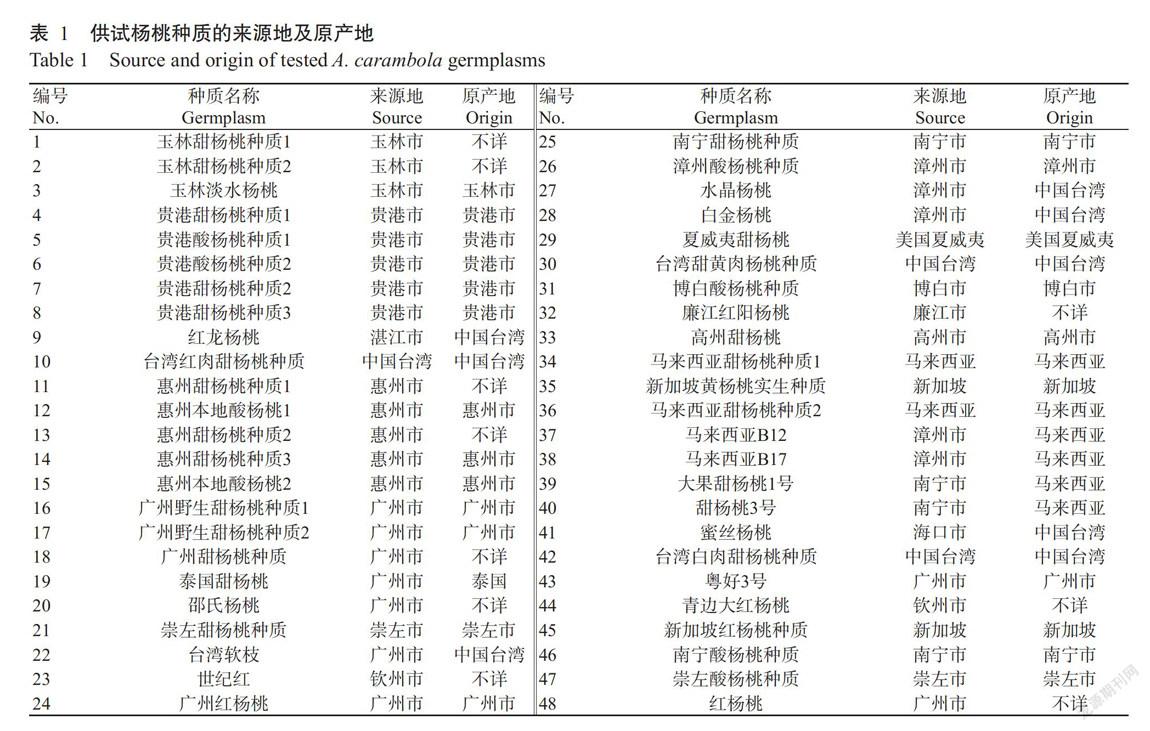
供试的48份杨桃种质材料均采自广西亚热带作物研究所杨桃种质资源圃,其来源地和原产地见表1。dNTPs、Taq DNA聚合酶和DNA Marker购自天根生化科技(北京)有限公司,其他化学试剂均购自南宁市茵兴科技产品有限公司。主要仪器设备:PCR扩增仪(ABI Veriti,美国)、冷冻离心机(SIGMA 3-30K,德国)、核酸蛋白测定仪(Bio-Rad Smart Spec Plus,美国)和凝胶成像系统(Bio-Rad UV-3,美国)等。
1. 2 试验方法
1. 2. 1 DNA提取 选取供试种质的健康无病害干净嫩叶,用液氮速冻后于-80 ℃保存备用。采用改良的CTAB法(陈虎等,2009)提取嫩叶DNA,并用核酸蛋白测定仪检测其浓度和纯度,最后统一稀释至30 mg/L,-20 ℃保存备用。
1. 2. 2 SCoT引物筛选及PCR扩增 参考Collard和Mackill(2009)的设计原则设计60条SCoT引物(SCoT1~SCoT60),由生工生物工程(上海)股份有限公司合成。采用欧景莉等(2015)优化的SCoT-PCR反应体系,以马来西亚B17、廉江红阳杨桃、贵港酸杨桃种质1和夏威夷甜杨桃等8份遗传背景差异明显的杨桃种质嫩叶DNA为模版,从60条SCoT引物中筛选出11条扩增条带清晰稳定、多态性好的引物(表2),对48份供试杨桃种质进行PCR扩增。SCoT-PCR反应体系20.0 μL:2.5 mmol/L Mg2+,0.3 mmol/L dNTPs,30 mg/L DNA模板,1.00 μmol/L引物,0.4 U Taq DNA聚合酶。扩增程序:94 ℃预变性5 min;94 ℃ 1 min;50 ℃ 1 min;72 ℃ 90 s,进行35个循环;72 ℃延伸10 min。PCR产物用1.8%琼脂糖凝胶电泳进行检测,并在Bio-Rad UV-3型凝胶成像系统上观察并拍照。
1. 3 统计分析
观察电泳图谱,按同一位置有无条带进行赋值,有条带记为“1”,无条带记为“0”,最终形成(0,1)矩阵。利用Popgene 1.32计算遗传多样性参数,包括各引物的扩增总条带数(Total number of bands,TNB)、多态性条带数(Number of polymorphism bands,NPB)、多态性条带百分比(Percentage of polymorphism bands,PPB)、有效等位基因数(Effective number of alleles,Ne)、多态性信息量(Polymorphism information content,PIC)、Nei’s基因多样性指数(Nei’s gene diversity,H)和Shannon’s信息指数(Shannon’s information index,I)。采用NTSYSpc 2.1计算不同种质间的遗传相似系数和遗传距离,利用UPGMA法进行聚类分析,并根据遗传相似系数进行主成分分析(PCA)。
2 结果与分析
2. 1 遗传多样性分析结果
从60条SCoT引物中筛选出11条扩增条带清晰、多态性好的引物,利用其对48份杨桃种质资源进行扩增,共得到115条条带,其中多态性条带数为102条,占总条带数的88.7%,多态性较好(表3)。其中,引物SCoT49的扩增结果如图1所示。每条引物的TNB为8~13条,NPB为7~12条;PPB为70.00%~100.00%,平均为88.84%,其中,引物SCoT44和SCoT51的PPB均为100.00%;PIC为0.72~0.82,平均为0.77;Ne为1.5752~1.8898,平均为1.7758;H为0.3161~0.4651,平均为0.4229;I为0.4576~0.6574,平均为0.6061,表明杨桃种质资源具有较丰富的遗传多样性,且筛选获得的11条SCoT引物对杨桃种质资源有较高的多态性检测率,适用于杨桃种质资源的鉴别及亲缘关系分析。
2. 2 聚类分析结果
利用NTSYSpc 2.1计算48份杨桃种质材料间的遗传相似系数,再利用UPGM法进行聚类分析,结果如图2所示。48份杨桃种质的遗传相似系数为0.4957~0.9217,平均为0.6841,其中,广州野生甜杨桃种质2(17)(括号内为种质编号,下同)和广州甜杨桃种质(18)间的遗传相似系数最高,为0.9217,结合二者的采集地、样本树龄及农艺性状、植物学性状等数据信息,广州野生甜杨桃种质2很有可能是广州甜杨桃种质的实生后代;玉林甜杨桃种质1(1)与红龙杨桃(9)间的遗传相似系数最小,为0.4957,说明二者的遗传差异最大,推测二者的原产地相隔较远,在进化过程中产生明显的基因差异。
在遗传相似系数为0.6618处,可将48份杨桃种质材料划分为三大类群。第Ⅰ类群包含27份甜杨桃种质,该类群在遗传相似系数0.7020处又可分为A和B两个亚群,其中,A亚群共14份种质,除马来西亚B17(38)外,原产地为马来西亚的种质(34、36、37、39和40)均聚在此亚群,A亚群还包含了2份玉林甜杨桃种质(1、2)、2份台湾种质(10、41)及来源于惠州(11)、廉江(32)、广州(48)、钦州(44)和新加坡(35)的种质各1份;B亚群包含13份种质,除了来源于崇左的甜杨桃种质(21)、漳州的水晶杨桃(27)、钦州的世纪红(23)外,其余10份均来源于广东的广州和惠州。虽然红杨桃(48)和广州红杨桃(24)均采源于广州,且名称极为相似,但分别屬于不同亚群,说明二者非同一种质。第Ⅱ类群包含14份杨桃种质,其中包括8份酸杨桃种质,还包括3份来源于贵港的甜杨桃种质(4、7、8)及来源于台湾(42)、广州(43)和南宁(25)的甜杨桃种质各1份。可见,该类群种质的果实风味多为酸、酸甜或甜酸。第Ⅲ类群包含7份杨桃种质,其中,3份原产地为台湾(9、28和30),其他4份原产地分别为玉林(3)、高州(33)、马来西亚(38)和新加坡(45)。该类群中,除玉林淡水杨桃(3)的果实甜味和酸味均很淡,介于甜杨桃和酸杨桃之间外,其他种质均为甜杨桃。玉林淡水杨桃(3)与类群内其他种质的遗传相似系数均较小,从遗传角度上反映出该类群种质在风味特征上的差异。
2. 3 主成分分析结果
根据遗传相似系数进行主成分分析,并绘制二维散点平面分布图,如图3所示。前3个主成分贡献率依次为13.02%、9.11%和7.45%,累计贡献率为29.58%,能代表原始数据的主要信息。在二维散点平面分布图中,种质间的距离越近,表示亲缘关系越近;反之则越远。根据种质间的距离可将48份杨桃种质分成A、B、C和D 4个组,其中,A组和B组分别相当于聚类分析结果中第Ⅰ类群的A亚群和B亚群,C组和D组分别相当于第Ⅱ类群和第Ⅲ类群,表明主成分分析结果与聚类分析结果高度相似。A组和B组存在交错现象,与聚类分析结果中A和B两个亚群同属Ⅰ类群相互印证。但在主成分分析结果中,马来西亚甜杨桃种质1(34)归为C组,可能其起源与C组的种质更接近,因相关科研资料欠缺,历史年代久远,现已无法考证。从整体来看,供试杨桃种质在图3中分布广泛,表明其遗传背景较广,遗传多样性较丰富。综合对比图2和图3可知,系统聚类分析结果和主成分分析结果基本一致,虽然主成分分析的分类结果不如聚类分析结果可将各组边界明确划分,但能更直观地反映出种质间的亲缘关系,将两者结合可更全面地了解各种质间的亲缘关系。
3 讨论
SCoT分子标记是一种根据起始密码子ATG侧翼序列的保守性和一致性设计单向引物,扩增产生偏向候选功能基因区的显性多态性标记(Collard and Mackill,2009),且其扩增的多态性条带绝大部分是基因组内部的功能基因或与之紧密相邻,能有效与目标性状连锁,可通过筛选某个分子标记来实现性状筛选(熊发前等,2009)。本研究选用11条SCoT引物对48份杨桃种质进行PCR扩增,共得到115条条带,其中多态性条带数为102条,占总条带数的88.7%。戴子云(2010)利用13条PAPD引物从17份广东杨桃种质扩增获得的多态条带百分比为59%;刘韬等(2011)利用13条RAPD引物从17份福建杨桃种质扩增获得的多态性条带百分比为97.19%;刘锴栋等(2013)利用10条RAPD引物从10份广东杨桃种质扩增获得的多态性条带百分比为93.02%。刘韬等(2011)、刘锴栋等(2013)扩增获得的多态性条带百分比较本研究稍高,究其原因可能是本研究供试材料较多,但仅用11条SCoT引物进行多态性分析。PIC作为评价物种遗传多样性参数的重要指标,当PIC大于0.5时,具有高度多态性(Vanhala et al.,1998)。本研究筛选出的SCoT引物平均PIC为0.77,远高于0.5,说明这些引物为高度多态性信息引物,具有较高的检测效率,可用于杨桃种质鉴定、遗传多样性分析及遗传图谱构建,且这些多态性位点很可能是功能基因或与目标性状相关联,为基因定位和基因克隆提供理论依据。
分析了解杨桃种质资源间的亲缘关系及变异信息,为杨桃种质资源鉴定及育种时亲本选择提供理论依据。根据本研究聚类分析和主成分分析结果,48份杨桃种质可分为三大类群,所有酸杨桃种质均属于第Ⅱ类群,而甜杨桃种质则主要集中在第Ⅰ和Ⅲ类群,仅少数甜杨桃种质在第Ⅱ类群。第Ⅰ类群又可在遗传相似系数0.7020处分为A和B两个亚群,A亚群以原产地为马来西亚及来源于玉林和新加坡等地的种质为主,B亚群则主要为广东的种质。而来自广西贵港和南宁的种质集中在Ⅱ类群,来源于我国台湾的种质则主要集中在第Ⅲ类群。可见,本研究的聚类分析结果与杨桃果实风味和种质来源高度相关,与刘锴栋等(2013)的研究结论基本一致。因此,本研究筛选获得的11条SCoT引物扩增产物中极可能存在与果实风味(酸甜)相关的基因位点。本研究中,台湾软枝和泰国大果甜杨桃归于同一类,而马来西亚B17归于另一类群,与刘韬等(2011)的研究结果相一致。虽然本研究的聚类分析结果与杨桃种质的果实风味和品种来源相关性较高,但并未严格按照果实风味或来源地进行划分,可能是因为部分种质来源地并非原产地,说明杨桃种质遗传多样性较丰富,遗传背景较复杂,要明确其亲缘关系需要进行更深入的调查和研究。因此,要鉴定不同的杨桃种质,区分同名异种或同种异名的杨桃品种,除了采用分子标记技术外,还应综合形态特征、品质性状等进行分析更有效。
4 结论
杨桃种质资源具有较丰富的遗传多样性,且筛选获得的SCoT引物对杨桃种质资源有较高的多态性检测率,适用于杨桃种质资源鉴别及亲缘关系分析。
参考文献:
蔡元保,杨祥燕,陈豪军,曾黎明,庞新华,孙光明. 2014. SRAP结合SCoT标记分析番木瓜种质的遗传多样性[J]. 植物遗传资源学报,15(2):292-298. [Cai Y B,Yang X Y,Chen H J,Zeng L M,Pang X H,Sun G M. 2014. Genetic diversity analysis of papaya resources by SRAP and SCoT combination[J]. Journal of Plant Genetic Resources,15(2):292-298.]
蔡元保,杨祥燕,陈显国,曾黎明,郭凌飞,林玉虹,崔明勇. 2013. 澳洲坚果SCoT反应体系的建立及应用[J]. 热带亚热带植物学报,21(3):253-258. [Cai Y B,Yang X Y,Chen X G,Zeng L M,Guo L F,Lin Y H ,Cui M Y. 2013. Establishment and application of SCoT amplification system for macadamia[J]. Journal of Tropical and Subtropical Botany,21(3):253-258.]
陈红,杨鑫,安华明. 2014. 贵州桃种质资源遗传多样性的SCoT分析[J]. 西北植物学报,34(8):1559-1564. [Chen H,Yang X,An H M. 2014. Genetic diversity of peach acce-ssions in Guizhou analysed by SCoT markers[J]. Acta Botanica Boreali-Occidentalia Sinica,34(8):1559-1564.]
陈虎,何新华,黄桂香,李峰,姜建初,朱建华. 2012. 不同龙眼资源遗传多样性的SCoT和ISSR比较分析[J]. 广西植物,32(4):536-541. [Chen H,He X H,Huang G X,Li F,Jiang J C,Zhu J H. 2012. Comparion and analysis of SCoT and ISSR markers for genetic diversity of longan[J]. Guihaia,32(4):536-541.]
陳虎,何新华,罗聪,高美萍,朱建华. 2009. 龙眼SCoT-PCR反应体系的优化[J]. 基因组学与应用生物学,28(5):970-974. [Chen H,He X H,Luo C,Gao M P,Zhu J H. 2009. The optimization of SCoT-PCR system of longan(Dimocarpus longan)[J]. Genomics and Applied Biology,28(5):970-974.]
陈虎,何新华,罗聪,朱建华,李峰. 2010. 龙眼24个品种的SCoT遗传多样性分析[J]. 园艺学报,37(10):1651-1654. [Chen H,He X H,Luo C,Zhu J H,Li F. 2010. Analysis on the genetic diversity of 24 longan(Dimocarpus longan) accessions by SCoT markers[J]. Acta Horticulturae Sinica,37(10):1651-1654.]
戴子云. 2010. 19个品种杨桃(Averrhoa carambola)对Cd的富集能力与修复潜力比较[D]. 广州:中山大学. [Dai Z Y. 2010. Cadmium accumulation and potential for phytoextraction of cadmium in 19 cultivars of Averrhoa carambola[D]. Guangzhou:Sun Yat-sen University.]
关长飞,胡超琼,王孟珂,阮小凤,王仁梓,杨勇. 2019. 陕西省柿种质资源遗传多样性分析[J]. 植物遗传资源学报. doi:10.13430/j.cnki.jpgr.20181213001. [Guan C F,Hu C Q,Wang M K,Ruan X F,Wang R Z,Yang Y. 2019. Genetic diversity analysis of persimmon germplasm resour-ces in Shaanxi Province[J]. Journal of Plant Genetic Resources. doi:10.13430/j.cnki.jpgr.20181213001.]
韩国辉,汪卫星,向素琼,边禹,郭启高,何桥,李晓林,梁国鲁. 2011a. 多倍体枇杷SCoT分析体系的建立与优化[J]. 果树学报,28(3):433-437. [Han G H,Wang W X,Xiang S Q,Bian Y,Guo Q G,He Q,Li X L,Liang G L. 2011a. Establishment and optimization of SCoT system in polyploidy loquats[J]. Journal of Fruit Science,28(3):433-437.]
韩国辉,向素琼,汪卫星,贾志刚,洪棋斌,梁国鲁. 2011b. 柑橘SCoT分子标记技术体系的建立及其在遗传分析中的应用[J]. 园艺学报,38(7):1243-1250. [Han G H,Xiang S Q,Wang W X,Jia Z G,Hong Q B,Liang G L. 2011b. Establishment and application of SCoT molecular marker system for Citrus[J]. Acta Horiiculturae Sinica,38(7):1243-1250.]
何江. 2017. 40份番石榴种质资源亲缘关系的形态学性状和SCoT研究[D]. 南宁:广西大学. [He J. 2017. Morphological characters and SCoT analysis of genetic relationships among 40 accessions of guava germplasm[D]. Nanning:Guangxi University.]
和世玉. 2014. 库尔勒香梨SCoT反应体系优化及优良营养系鉴定[D]. 新疆:石河子大学. [He S Y. 2014. Optimization of start codon targeted polymorphism(SCoT) system and identification of Korla Fragrant Pear excellent clones[D]. Xinjiang:Shihezi University.]
靳佳佳. 2018. 不同金柑品种亲缘性及叶片气孔和果皮精油差异性[D]. 南宁:广西大学. [Jin J J. 2018. Affinity and differences of blade stomatal and pericarp essential oil in defferent kumquat varieties[D]. Nanning:Guangxi University.]
刘锴栋,袁长春,黎海利,陈春华,谭雪琼. 2013. 杨桃遗传多样性的形态特征与RAPD标记的相关性分析[J]. 果树学报,30(1):69-74. [Liu K D,Yuan C C,Li H L,Chen C H,Tan X Q. 2013. Correlation analysis of genetic diversity of carambola cultivars using morphological and RAPD markers[J]. Journal of Fruit Science,30(1):69-74.]
刘韬,车建美,黄素芳,廖汝玉,刘波. 2011. 福建省主要杨桃品种遗传多样性分析[J]. 果树学报,28(3):448-452. [Liu T,Che J M,Huang S F,Liao R Y,Liu B. 2011. RAPD analysis of genetic diversity of carambola in Fu-jian Province[J]. Journal of Fruit Science,28(3):448-452.]
龍治坚. 2013. 枇杷属植物的遗传多样性分析和指纹图谱初步构建[D]. 重庆:西南大学. [Long Z J. 2013. Genetic diversity analysis and fingerprint construction of Eriobotrya on SSR and SCoT markers[D]. Chongqing:Southwest University.]
罗聪. 2012. 芒果SCoT分子标记与逆境和重要开花时间相关基因研究[D]. 南宁:广西大学. [Luo C. 2012. Study on SCoT markers and analysis on genes of stress-related and important flowering time in mango[D]. Nanning:Guangxi University.]
欧景莉,覃剑峰,余炳宁,黄小江,陆祖双,朱鹏锦,陈豪军. 2015. 杨桃SCoT标记PCR反应体系建立与验证[J]. 中国南方果树,44(3):16-21. [Ou J J,Qin J F,Yu B N,Huang X J,Lu Z S,Zhu P J,Chen H J. 2015. Establishment and varification of the PCR protocol for SCoT in Averrhoa carambola L.[J]. South China Fruits,44(3):16-21.]
王发明,李洁维,叶开玉,龚弘娟,莫权辉,蒋桥生,刘平平. 2017. 41份葡萄种质遗传多样性的ISSR和SCoT对比分析[J]. 广西植物,37(1):1-8. [Wang F M,Li J W,Ye K Y,Gong H J,Mo Q H,Jiang Q S,Liu P P. 2017. Comparative analysis on the genetic diversity of 41 vitis germplasm resources by ISSR and SCoT molecular mar-kers[J]. Guihaia,37(1):1-8.]
熊发前,唐荣华,陈忠良,潘玲华,庄伟建. 2009. 目标起始密码子多态性(SCoT):一种基于翻译起始位点的目的基因标记新技术[J]. 分子植物育种,7(3):635-638. [Xiong F Q,Tang R H,Chen Z L,Pan L H,Zhuang W H. 2009. SCOT:A novel gene targeted marker technique based on the translation start codon[J]. Molecular Plant Breeding,7(3):635-638.]
杨君祎. 2015. 砀山酥梨授粉品种亲缘关系的SCoT分析及对石细胞含量的影响[D]. 合肥:安徽农业大学. [Yang J Y. 2015. The effects on the stone cell content of Dangshansu pear based on genetic relationship of pollination cultivars by SCoT analysis[D]. Hefei:Anhui Agriculture University.]
杨祥燕,蔡元保,黄秋伟,陈涛,覃剑峰,彭靖茹. 2013. 番木瓜主栽品种SCoT指纹图谱构建及遗传变异分析[J]. 西北植物学报,33(9):1756-1761. [Yang X Y,Cai Y B,Huang Q W,Chen T,Qan J F,Peng J R. 2013. SCoT fingerprints and genetic variations of papaya(Carica papaya L.) major cultivars[J]. Acta Botanica Boreali-Occidentalia Sinica,33(9):1756-1761.]
Collard B C Y,Mackill D J. 2009. Start codon targeted(SCoT) polymorphism:A simple,novel DNA marker technique for generating gene-targeted markers in plants[J]. Plant Molecular Biology Reporter,27(1):86-93.
Guo D,Zhang J,Liu C. 2012. Genetic diversity in some grape varieties revealed by SCoT analyses[J]. Molecular Biology Reports,39(5):5307-5313.
Luo C,He X,Chen H,Ou S,Gao M. 2010. Analysis of diversity and relationships among mango cultivars using start codon targeted(SCoT) markers[J]. Biochemical Syste-matics and Ecology,38(6):1176-1184.
Vanhala T,Tuiskula-Haavisto M,Elo K,Vilkki J,Maki-Tanila A. 1998. Evaluation of genetic variability and genetic distances between eight chicken lines using microsatellite markers[J]. Poultry Science,77(6):783-790.
(責任编辑 陈 燕)

