核桃酚类化合物对戊基苯酚免疫毒性的保护作用
高宇琪 王雨昕 万一方 柴凡淅 许美玉
摘 要:目的:分离鉴定对戊基苯酚免疫毒性具有保护作用的核桃酚类化合物成分。方法:用脾淋巴细胞增殖分析实验和酶联免疫吸附试验,检测核桃多酚对戊基苯酚免疫毒性的保护作用;用硅胶层析技术分离核桃多酚;用高效液相色谱—电喷雾—离子阱/飞行时间串联质谱技术鉴定核桃酚类化合物组成。结果:核桃多酚显著抑制戊基苯酚对脾淋巴细胞所致免疫毒性,其中用甲醇和氯仿比例为2∶1的溶液在硅胶层析柱上洗脱的F4组分的免疫保护作用较强,该组分包含67%鞣花单宁和33%黄酮类化合物。结论:保护戊基苯酚免疫毒性的核桃多酚活性成分由5%鞣花酸己糖苷异构体、39%鞣花酸、23%鞣花酸戊糖异构体和 32%槲皮素戊糖苷同分异构体组成。
关键词:核桃酚类化合物;免疫保护作用;免疫毒性;戊基苯酚;鞣花单宁;黄酮
汽车尾气已成为我国大气污染物的重要来源之一[1],戊基苯酚(PP)是汽油车尾气颗粒物中一种重要的活性成分,1L尾气中包含约0.1~1.1mg PP[2-3]。戊基苯酚不仅对鱼类具有生殖毒性[4],还对小鼠脾脏具有免疫毒性造成机体损伤[5]。脾淋巴细胞主要包括T细胞和B细胞,其中CD4+TH1、CD4+TH2和CD8+T细胞分别通过释放白细胞介素-2(IL-2)、白细胞介素-4(IL-4)和颗粒酶B(granzyme-B)发挥其免疫作用[6]。有研究表明,戊基苯酚不仅降低小鼠脾淋巴细胞的细胞活力,还抑制T细胞分泌细胞因子和颗粒酶[5]。
植物多酚对各种有毒物质具有保护作用[7-8]。核桃中含有丰富的多酚物质[9],在所有坚果中,核桃的总酚含量最高[10]。核桃多酚能够预防结肠癌和前列腺癌[11-12];通过抑制体外低密度脂蛋白氧化来防止心血管疾病[13];并通过改善神经元内信号传导,减少β-淀粉样蛋白介导的细胞死亡,预防神经退行性疾病[14-16]。核桃多酚通常分为非黄酮类化合物和黄酮类化合物,非黄酮类物质是核桃多酚的主要成分,包括鞣花单宁、鞣花酸及其衍生物、芍药素等[17-18]。鞣花单宁含有六羟基联苯二甲酰基基团,具有如抗氧化、抗癌和抗炎活性等多种生物学活性[19]。黄酮类物质是一种含有二苯基骨架结构的酚类物质,具有抗氧化活性[20]。黄酮类化合物是一种有效的抗菌剂[21],且具有显著的防癌作用[22]。在前期研究中我们发现,核桃多酚能够有效地缓解戊基苯酚诱导的免疫毒性,该作用与其抗氧化活性具有密切关系[23]。然而,具有保护戊基苯酚诱导的免疫毒性作用的核桃多酚活性成分尚不清楚。本文主要研究不同核桃多酚组分的免疫保护作用,分析各组分的酚类化合物组成,同时研究酚类化合物组成与保护作用之间的关系,为核桃多酚的有效利用提供科学依据。
1 材料与方法
1.1 材料与试剂
核桃(河北晶品果业有限公司);戊基苯酚、噻唑兰(MTT)(Sigma,美国);ELISA试剂盒(武汉华美生物工程有限公司);LC-MS级溶剂(Honeywell Burdick & Jackson,美国);硅胶柱(200~300目)(青岛海洋化学公司,中国)。
1.2 方法
1.2.1 实验动物 饲养清洁级8周龄昆明雄性小鼠(军事医学科学院实验动物中心)在23~25℃、相对湿度57%~60%且无菌的环境下,并提供12h的明暗周期循环。所有小鼠提供可自由食用的无菌食物及过滤水。
1.2.2 核桃多酚的制备 将核桃冷冻24h后,去壳后的核桃仁粉碎至粉末,取30g粉碎物倒入240mL pH 4.8溶液(100mmol/L乙酸缓冲液和丙酮的体积比为3∶7的混合液),充分搅拌混匀,在4℃下浸提24h 2次,合并提取液,用37℃旋蒸去除丙酮。加入75mL乙酸乙酯萃取3次,合并萃取液,旋蒸除乙酸乙酯,冷冻干燥。
1.2.3 核桃多酚的分离 取30mg核桃多酚溶于无水甲醇,缓缓加入到硅胶柱(200~300目)。分别用甲醇∶氯仿比例为1∶4、1∶2、1∶1、2∶1、4∶1和1∶0的混合物进行洗脱。用TLC方法收集多酚类物质,分别得到6个组分,冻干收集的各组分并依次命名为F1、F2、F3、F4、F5、F6。由于F5和F6的含量非常低,因此本文选择F1~F4组分进行后续实验。
1.2.4 小鼠脾淋巴细胞的制备及活力测定 根据Yang等[23]的实验方法进行小鼠脾淋巴细胞的制备及活力测定。小鼠脱颈处死,于无菌环境下取脾,利用RPMI1640培养基,制备脾淋巴细胞悬浮液。用RPMI1640培养基制备5×106 cell/mL脾淋巴细胞悬浮液,向96孔板中加入100μL/well,37℃、5% CO2培养箱培养4h。按实验设计每孔加入100μL样品(对照组为RPMI1640完全培养基,染毒组10-4mol/L PNMC,保护组为10-4mol/L PNMC+1.0 μg/mL 核桃多酚),于37℃、5% CO2条件下培养48h。取出培养板,弃去上清液,每孔加入150μL DMSO,避光在摇床上摇板20min。使用酶标仪在570nm处测定各孔吸光值。
1.2.5 小鼠脾淋巴细胞分泌细胞因子及颗粒酶测定 制备脾淋巴细胞悬液,向96孔板中加入脾淋巴细胞单细胞悬液100μL/well,37℃、5% CO2的培养箱中培养4h。按实验设计每孔加入100μL样品(对照组为RPMI1640完全培养基,染毒組10-4mol/L PNMC,保护组为10-4mol/L PNMC+1.0μg/mL核桃多酚),于37℃、5% CO2条件下培养48h,收集上清液,按照酶联免疫试剂盒说明书的方法测定上清液中各个细胞因子的含量。
1.2.6 LC-MS分析(HPLC-ESI-IT-TOF-MS) 根据Yang等[23]的条件,使用装备有HPLC系统(SIL-20A HT自动取样器、LC-20AD泵系统、SDP-M20A光电二极管阵列检测器)的Shimadzu's LC-MS Solution设备(Shimadzu,日本)进行LC-MS分析以鉴定提取物组分成分。首先使用C18反相柱(Shimpack XR-ODS column色谱柱,50mm×3.0mm id±2.2μm,岛津制作所,美国)进行样品的LC分离,洗脱时流动相为 0.1%甲酸水溶液(A)以及乙腈(0.1%甲酸)混合溶液(B),流速1mL/min,进样量10μL。分离后使用负电离模式的常规ESI源进行电离,氮气作为雾化器和干燥气体,流速为1.5L/min;ESI源电压设定为4.5kV,检测器电压为1.5V。通过Shimadzu's LC-MS Solution软件(Shimadzu Scientific Instruments Inc.)进行系统控制和光谱数据分析。
1.2.7 统计学分析 所有试验均进行3组重复实验,所有数据均以平均值±标准偏差来表示,方差分析使用SPSS软件进行a post hoc test及Tukey's test,P<0.05为统计学上显著性差异,P<0.01为极显著性差异。
2 结果与分析
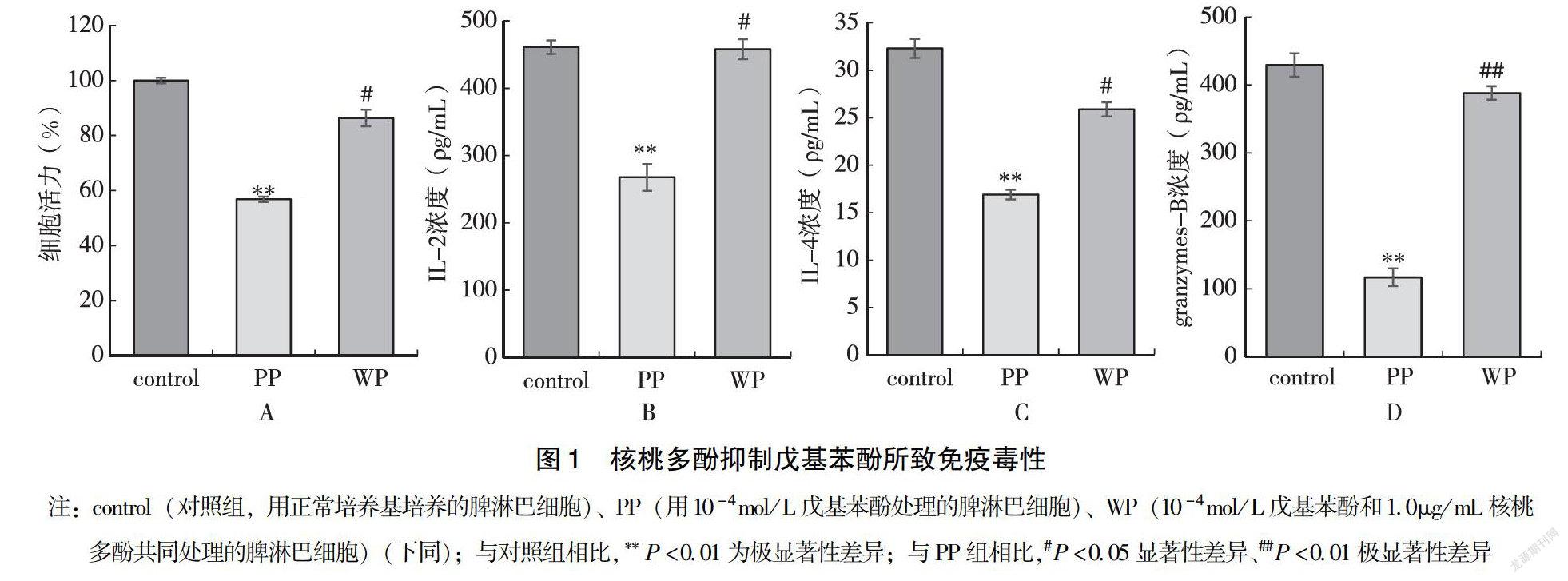
2.1 核桃多酚抑制戊基苯酚所致免疫毒性
为研究核桃多酚对戊基苯酚诱导的脾淋巴细胞毒性影响,将脾淋巴细胞分为对照组(正常培养基培养)、染毒组(戊基苯酚处理)和保护组(戊基苯酚+核桃多酚处理)等3个组培养48h,通过MTT细胞增殖分析实验和酶联免疫吸附试验检测细胞活力和产生细胞因子水平。脾淋巴细胞活力检测结果显示,单独用戊基苯酚处理的染毒组脾淋巴细胞活力下降至56.83%(与对照组相比,P<0.05),而当核桃多酚与戊基苯酚共同处理脾淋巴细胞时,细胞活力提高到86.43%(与染毒組相比,P<0.05;与对照组相比无显著性差异),细胞活力下降得到显著抑制(图1A)。酶联免疫吸附试验检测结果表明,当用戊基苯酚处理脾淋巴细胞时,显著降低了分泌细胞因子IL-2、IL-4、颗粒酶-B的水平,与对照组相比分别降低至57.5%、51.6%、28.7%(图1B、C、D)。然而用核桃多酚与戊基苯酚一起处理脾淋巴细胞时,分泌细胞因子IL-2、IL-4和颗粒酶B的水平上调至98.8%、82.5%、91.3%(图1B、C、D)。以上结果表明,核桃多酚具有显著抑制戊基苯酚对小鼠脾淋巴细胞产生的免疫毒性作用。
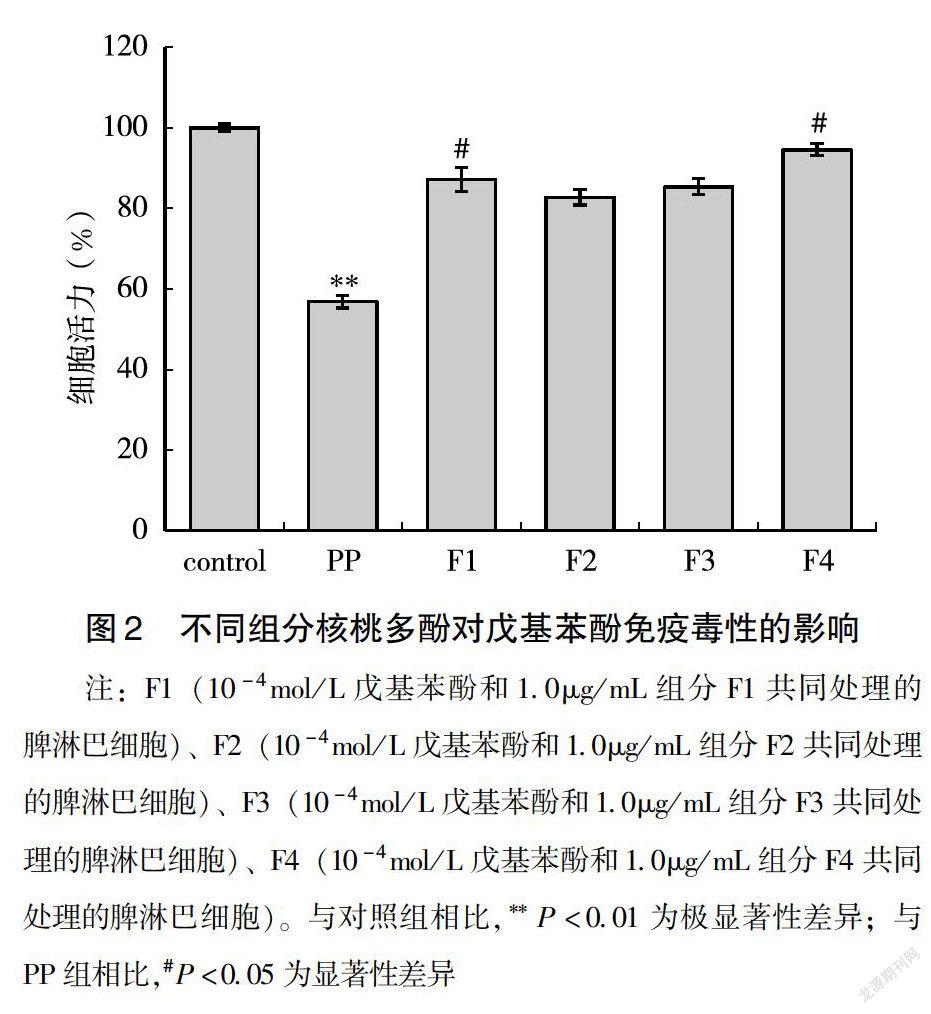
2.2 核桃多酚免疫保护作用活性组分分离
以不同比例混合的氯仿和甲醇溶液作为洗脱剂,通过硅胶层析柱对核桃多酚进行梯度洗脱,得到F1、F2、F3和F4等4个组分。用MTT细胞增殖分析实验,通过检测对暴露于戊基苯酚的脾淋巴细胞增殖影响,研究不同组分的免疫保护作用。细胞增殖分析实验结果表明,4个组分均能以不同程度缓解戊基苯酚对小鼠脾淋巴细胞造成的免疫毒性(图2)。F1、F2、F3和F4组分的免疫保护作用强弱顺序为F4>F1>F3>F2,即F4组分的免疫保护作用最显著,其能够将暴露于戊基苯酚的脾淋巴细胞活力从57%提高到95%,基本恢复到对照组的水平(图2)。以上结果表明,在核桃多酚提取物中,用甲醇和氯仿比例为2∶1的洗脱液,通过硅胶层析技术分离的组分(F4)具有较强的免疫保护作用。
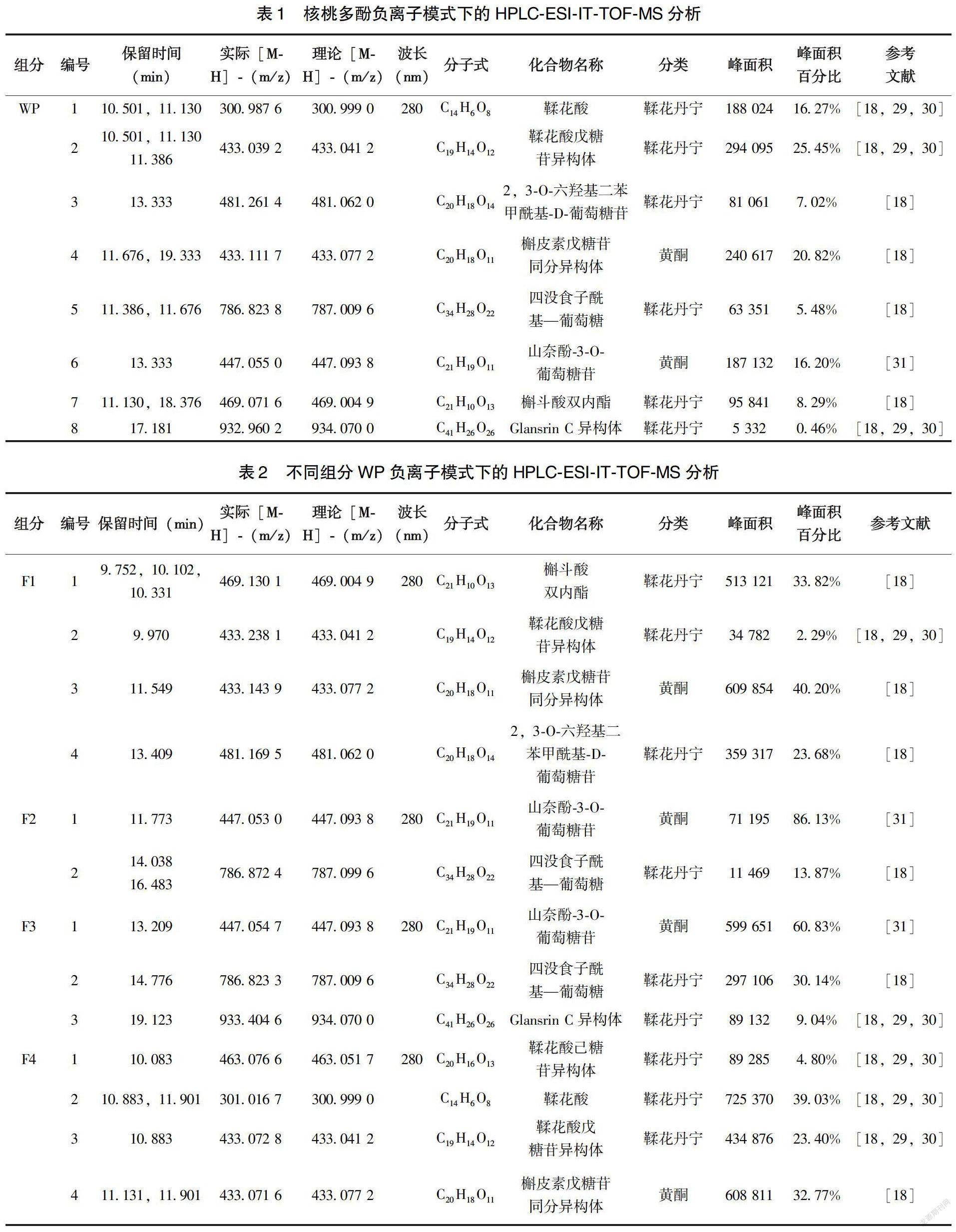
2.3 高效液相色谱—电喷雾—离子阱/飞行时间串联质谱检测
用高效液相色谱—电喷雾—离子阱/飞行时间串联质谱技术,对核桃多酚和各组分的酚类化合物的组成进行了测定。对核桃多酚检测结果显示,含有8 种酚类化合物,属于鞣花单宁或黄酮类化合物(表1)。对F1、F2、F3和F4组分组成测定结果发现,分别含有4、2、3、4种酚类化合物,均属于鞣花单宁或黄酮类化合物。质谱图信号峰面积计算结果显示,F1、F2 、F3和F4组分中鞣花单宁相对含量分别为60%、14%、39%、67%,黄酮类化合物分别为40%、86%、61%、33%(表2)。结合各组分的免疫保护作用研究结果发现,各组分中鞣花单宁相对含量排序与其免疫保护活性排序一致,均为F4>F1>F3>F2,即核桃多酚中鞣花单宁含量较高的组分具有较强的免疫保护活性。
核桃多酚主要由鞣花单宁和黄酮组成,而其中鞣花单宁含量较高的组分具有较强的免疫保护活性,这可能与鞣花单宁的抗氧化活性较高具有密切关系[23]。多酚的抗氧化活性取决于其结构,尤其与羟基的数量、位置以及于芳环上取代基的性质具有密切关系[24]。位于苯环邻位和对位的酚羟基具有供给电子性质,有利于多酚的抗氧化活性,而间位上的羟基具有吸电子特性,不利于其抗氧化作用[25]。鞣花单宁类化合物含有2个邻苯二酚基团,而槲皮素只含有1个邻苯二酚基团和1个间二苯酚基团[26-27]。鞣花单宁类化合物结构决定其具有较高的抗氧化活性[28]。F4组分由67%鞣花单宁(鞣花酸己糖苷异构体、鞣花酸、鞣花酸戊糖异构体)和33%槲皮素戊糖异构体组成,其较强的免疫保护作用与抗氧化活性较高的鞣花单宁类含量较高具有密切关系。
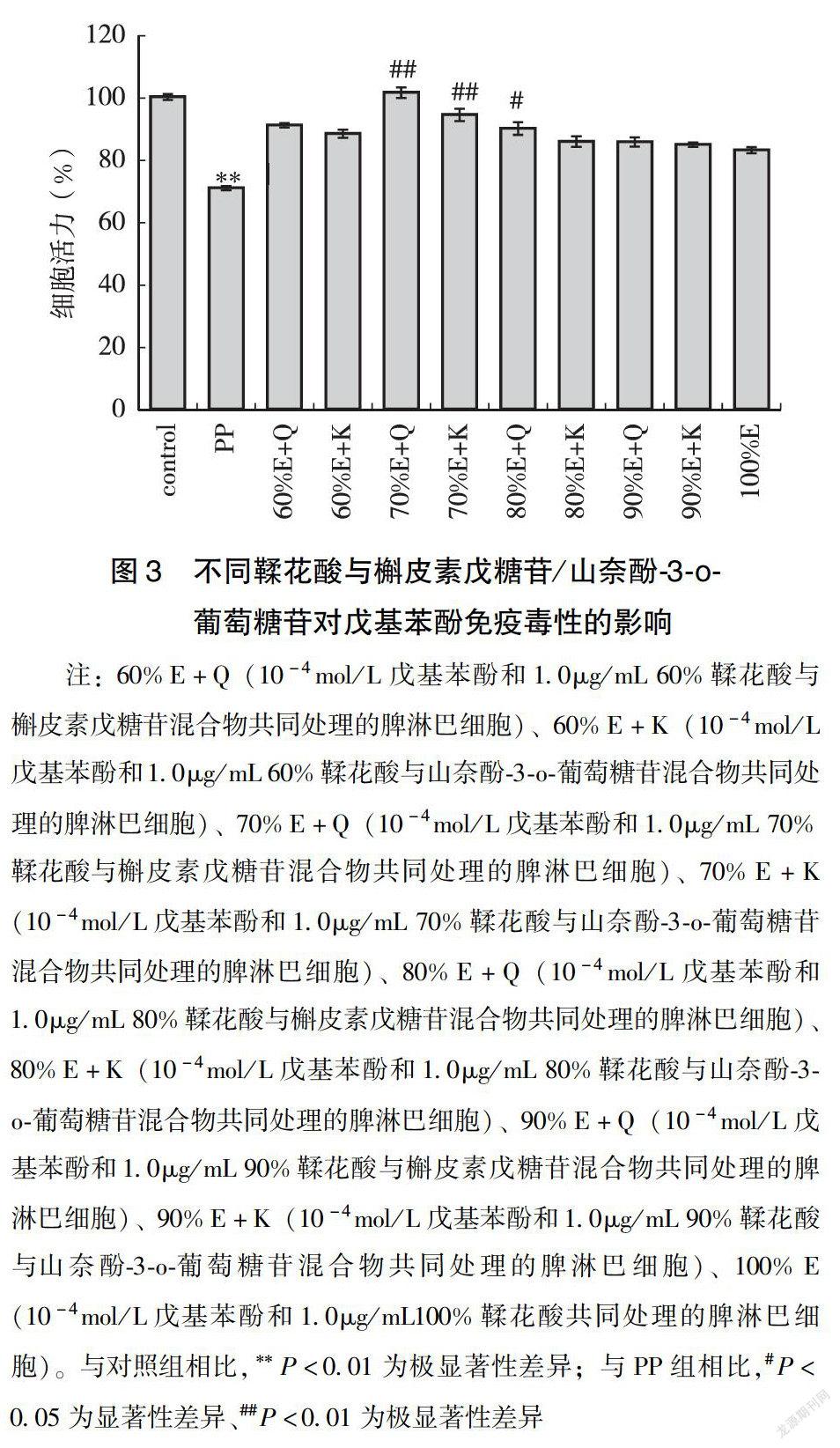
2.4 鞣花单宁类化合物含量对抑制戊基苯酚免疫毒性作用的影响
鞣花单宁通常在酸性环境下水解并通过分子内酯化作用生成鞣花酸[18]。核桃多酚中的鞣花单宁类化合物主要为鞣花酸及其衍生物,因此,用鞣花酸代表鞣花单宁类化合物(槲皮素戊糖苷或山奈酚-3-o-葡萄糖苷代表黄酮类化合物),研究鞣花单宁含量对抑制戊基苯酚免疫毒性作用的影响。如图3所示,鞣花酸和槲皮素/山奈酚的混合物对戊基苯酚免疫毒性均具有一定保护作用,当鞣花单宁类化合物含量为70%时,显示较强的免疫保护作用,高于鞣花单宁类含量为100%时表现的免疫保护作用,能够使脾淋巴细胞增殖水平接近正常对照组。鞣花单宁类化合物以一定比例与黄酮类物质混合时,显示比单独的该化合物更显著的免疫保护活性,提示鞣花单宁可能通过与其他酚类化合物的协同作用,增强了其免疫保护作用[32]。不同酚类化合物存在不同最佳混合比例[33],由5%鞣花酸己糖苷异构体、39%鞣花酸、23%鞣花酸戊糖异构体和 32%槲皮素戊糖苷同分异构体组成,即约70%鞣花单宁和30%黄酮类混合时,对戊基苯酚免疫毒性具有较显著的保护作用。
3 结论
核桃多酚通过显著抑制戊基苯酚对脾淋巴细胞增殖和分泌细胞因子功能毒性作用,发挥免疫保护作用。在核桃多酚的组成组分中,鞣花单宁类化合物含量为67%的组分显示较强的免疫保护作用,能够使戊基苯酚毒性作用下的脾淋巴细胞的增殖功能恢复到几乎和正常脾淋巴细胞同等水平,该组分中含有5%鞣花酸己糖苷异构体、39%鞣花酸、23%鞣花酸戊糖异构体和32%槲皮素戊糖苷同分异构体等4种酚类化合物。虽然核桃多酚对戊基苯酚免疫毒性的保护作用机制还没有得到阐明,有待于进一步深入研究,然而本研究结果对阐明核桃多酚的生物学功效提供了科学依据,也对解决由汽车尾气污染引起的健康问题具有重要意义。
参考文献
[1]檀华梅,张兰怡,邱荣祖,等. 汽车尾气污染物测试技术应用研究现状与展望[J].牡丹江大学学报,2018,27(2):121-125.
[2]Ohtani T,et al. Cellular basis of the role of diesel exhaust particles in inducing Th2-dominant response[J].Journal of Immunology,2005,174(4):2412-2419.
[3]Murahashi T,Sasaki S,Nakajima T. Determination of endocrine disruptors in automobile exhaust particulate matter[J].Journal of Health Science,2003,49(1):72-75.
[4]涂瓏珑. 槲皮素和原花青素对4-硝基酚诱导的小鼠生殖细胞损伤的缓解作用[D].杭州:浙江大学,2013.
[5]Yang L,Ma S,Wan Y,et al. Effect of 4-pentylphenol and 3-methyl-4-nitrophenol on murine splenic lymphocyte populations and cytokine/granzyme production[J].Journal of Immunotoxicology,2016,13(4):548-556.
[6]但刚,刘晨霞,吴丽娟. T淋巴细胞功能及检测方法[J].国际检验医学杂志,2015,36(3):377-380.
[7]Chen Q,Zhang R,Li W M,et al. The protective effect of grape seed procyanidin extract against cadmium-induced renal oxidative damage in mice[J].Environ Toxicol Pharmacol,2013,36(3):759-768.
[8]Zhang H,Fang W,Xiao W,et al. Protective role of oligomeric proanthocyanidin complex against hazardous nodularin-induced oxidative toxicity in Carassius auratus lymphocytes[J].Journal of Hazardous Materials,2014,274(12):247-257.
[9]Sánchezgonzález C,Izquierdopulido M. Health benefits of walnut polyphenols:an exploration beyond their lipid profile[J].Critical Reviews in Food Science & Nutrition,2015,57(16):3373-3383.
[10]Vinson J A,Cai Y. Nuts,especially walnuts,have both antioxidant quantity and efficacy and exhibit significant potential health benefits[J].Food & Function,2012,3(2):134-140.
[11]Reiter R J,et al. A walnut-enriched diet reduces the growth of LNCaP human prostate cancer xenografts in nude mice[J].Cancer Investigation,2013,31(6):365-373.
[12]Nagel J M,Brinkoetter M,Magkos F,et al. Dietary walnuts inhibit colorectal cancer growth in mice by suppressing angiogenesis[J].Nutrition,2012,28(1):67-75.
[13]Anderson K J,Teuber S S,Gobeille A,et al. Walnut polyphenolics inhibit in vitro human plasma and LDL oxidation[J].Journal of Nutrition,2001,131(11):2837-2842.
[14]Poulose S M,Miller M G,Shukitt-Hale B. Role of walnuts in maintaining brain health with age[J].Journal of Nutrition,2014,144(4 Suppl):561S-566S.
[15]Lin Y H,Jr S N. Whole body distribution of deuterated linoleic and alpha-linolenic acids and their metabolites in the rat[J].Journal of Lipid Research,2007,48(12):2709-2724.
[16]Muthaiyah B,Essa M M,Chauhan V,et al. Protective effects of walnut extract against amyloid beta peptide-induced cell death and oxidative stress in PC12 cells[J].Neurochemical Research,2011,36(11):2096-2103.
[17]Rorabaugh J M,et al. English and black walnut phenolic antioxidant activity and following human nut consumption[J].Food & Nutrition Sciences,2011,2(3):249-252.
[18]Regueiro J,et al. Comprehensive identification of walnut polyphenols by liquid chromatography coupled to linear ion trap-Orbitrap mass spectrometry[J].Food Chemistry,2014,152(2):340-348.
[19]Silva R M,Pereira L D,Véras J H,et al. Protective effect and induction of DNA repair by Myrciaria cauliflora seed extract and pedunculagin on cyclophosphamide-induced genotoxicity[J].Mutation Research,2016,810:40-47.
[20]Riceevans C A,Miller N J,Paganga G. Structure-antioxidant activity relationships of flavonoids and phenolic acids[J].Free Radic Biol Med,1996,20(7):933-956.
[21]Xie Y,et al. Antibacterial activities of flavonoids:structure-activity relationship and mechanism[J].Current Medicinal Chemistry,2015,22(1):132-149.
[22]Cui L,et al. Flavonoids,flavonoid subclasses,and esophageal cancer risk:a meta-analysis of epidemiologic studies[J].Nutrients,2016,8(6):350.
[23]Yang L,Ma S,Han Y,et al. Walnut polyphenol extract attenuates immunotoxicity induced by 4-Pentylphenol and 3-methyl-4-nitrophenol in murine splenic lymphocyte[J].Nutrients,2016,8(5):287.
[24]Balasundram N,Sundram K,Samman S. Phenolic compounds in plants and agri-industrial by-products:antioxidant activity,occurrence,and potential uses[J].Food Chemistry,2006,99(1):191-203.
[25]Kondo K,et al. Mechanistic studies of catechins as antioxidants against radical oxidation[J].Archives of Biochemistry & Biophysics,1999,362(1):79-86.
[26]Sudheer A R,Muthukumaran S,Devipriya N,et al. Ellagic acid,a natural polyphenol protects rat peripheral blood lymphocytes against nicotine-induced cellular and DNA damage in vitro:with the comparison of N-acetylcysteine[J].Toxicology,2007,230(1):11-21.
[27]Ma B,Zeng J,Shao L,et al. Efficient bioconversion of quercetin into a novel glycoside by Streptomyces rimosus subsp. rimosus ATCC 10970[J].Journal of Bioscience & Bioengineering,2013,115(1):24-26.
[28]Pradeep Pratap Singh,et al. Activity-guided isolation of antioxidants from the roots of Rheum emodi[J].Natural Product Research,2013,27(10):946-949.
[29] Slatnar A,Mikulic-Petkovsek M,Stampar F,et al. Identification and quantification of phenolic compounds in kernels,oil and bagasse pellets of common walnut(Juglans regia,L.)[J].Food Research International,2015,67:255-263.
[30] Grace M H,et al. Efficient preparative isolation and identification of walnut bioactive components using high-speed counter-current chromatography and LC-ESI-IT-TOF-MS[J].Food Chemistry,2014,158(9):229-238.
[31] Hooft J J J V D,et al. Structural annotation and elucidation of conjugated phenolic compounds in black,green,and white tea extracts[J].Journal of Agricultural & Food Chemistry,2012,60(36):8841-8850.
[32] Mertens-Talcott S U,Talcott S T,Percival S S. Low concentration of quercetin and ellagic acid synergistically influence proliferation,cytotoxicity and apoptosis in MOLT-4 human leukemia cells[J].Journal of Nutrition,2003,133(8):2669-2674.
[33] Tomás-Menor L,et al. The promiscuous and synergic molecular interaction of polyphenols in bactericidal activity:an opportunity to improve the performance of antibiotics?[J].Phytotherapy Research Ptr,2015,29(3):466-473.
Abstract:Objective The aim of the present study is to fractionation and identify the active compositions with protective effect against immunotoxicity induced by pentylphenol in walnut polyphenol.Method MTT tetrazolium dye assay and enzyme-linked immunosorbent assay were chose to assess the protective activity of walnut polyphenol against immunotoxicity induced by pentylphenol.Silica gel column chromatography was applied to fractionate walnut polyphenol. HPLC-ESI-IT-TOF-MS was used to identify walnut phenolic compositions.Result Walnut polyphenol significantly attenuated immunotoxicity induced by pentylphenol. Fraction eluted with a mixture of methanol/chloroform(2∶1)by silica gel column,F4 showed stronger protective effect,which contained 67%ellagitannins and 33%flavonoids.Conclusion The active compositions of walnut polyphenol with protective effect against immunotoxicity consisted of 5%ellagic acid hexoside isomer,39%ellagic acid,23%ellagic acid pentoside isomer and 32%quercetin pentoside isome.
Keywords:walnut phenolic composition;immunoprotective effect;immunotoxicity;pentylpheno;ellagitannins;flavonoids
(責任编辑 唐建敏)

