重金属铜、锌、镉复合胁迫对麻疯树幼苗生理生化的影响
朱成豪 唐健民 高丽梅 邹蓉 史艳财 付嵘 曾小飚
摘 要:該研究以Cu2+、Zn2+、Cd2+单一胁迫为对照,探讨不同浓度的Cu2+、Zn2+、Cd2+复合胁迫对麻疯树幼苗生理生化指标的影响。结果表明:随着Cu2+、Zn2+、Cd2+浓度的增加,麻疯树幼苗叶片中的蛋白质(Pro)、丙二醛(MDA)含量均逐渐增加,其叶片叶绿素含量随着Zn2+胁迫浓度的增加呈现出先降后升的趋势,在中等浓度(100 mg·L-1)的Zn2+胁迫时含量最低、随着Cu2+胁迫浓度的增加叶绿素含量先升高后降低,在Cu2+浓度为200 mg·L-1时含量最高,达到1 200 mg·g-1 FW;Cd2+胁迫对叶绿素含量和根系活力无明显影响。根系活力在Zn2+浓度为100 mg·L-1 时最强,随着Cu2+浓度的增加而减弱。低浓度的Cu2+、Zn2+、Cd2+对过氧化物酶活性和可溶性糖含量都具有促进作用。Cu2+、Zn2+、Cd2+复合胁迫时对可溶性蛋白、叶绿素和丙二醛含量均无明显影响,随着复合胁迫时浓度的增加,可溶性糖含量和根系活力先增后减。这表明麻疯树对三种重金属的胁迫具有一定的抗性,过高浓度的胁迫会影响麻疯树幼苗生理生化的一些指标,但是麻疯树可以通过自身的防御系统使伤害降到最小。此外,重金属复合胁迫可以在一定程度上减轻单一胁迫对麻疯树幼苗造成的毒害作用。
关键词:重金属胁迫, 麻疯树, 生理生化特性
中图分类号:Q945.78, S718.43
文献标识码:A
文章编号:1000-3142(2019)06-0752-09
Abstract:Cu2+, Zn2+ and Cd2+ single stress were used as controls to study the effects of different concentrations of Cu2+, Zn2+ and Cd2+ on physiological and biochemical indexes of Jatropha curcas seedlings. The results showed that the contents of protein (Pro) and malondialdehyde (MDA) in leaves of J. curcas seedlings increased gradually with the increase of Cu2+, Zn2+ and Cd2+ concentrations, and the chlorophyll content of leaves increased with the increase of Zn2+ stress concentration. The post-reduction trend was the lowest at the medium concentration (100 mg·L-1) Zn2+ stress, and the chlorophyll content increased first and then decreased with the increase of Cu2+ stress concentration. The highest content was obtained when Cu2+ concentration was 200 mg·L-1, reaching 1 200 mg· g-1; Cd2+ stress had no significant effects on chlorophyll content and root activity. The root activity was the strongest when Zn2+ concentration was 100 mg·L-1, and it decreased with the increase of Cu2+ concentration. Low concentrations of Cu2+, Zn2+ and Cd2+ promoted both pero-xidase activity and soluble sugar content. The contents of soluble protein, chlorophyll and malondialdehyde were not significantly affected by Cu2+, Zn2+ and Cd2+ stresses. The soluble sugar content and root activity increased first and then decreased with the increase of concentration during complex stress. The results showed that J. curcas had certain resis-tance to stress of the heavy metals. Excessive concentration of stress could affect some physiological and biochemical indexes of J. curcas seedlings, but J. curcas could reduce damage through its own defense system. In addition, heavy metal complex stress could alleviate the toxic effects of single stress on J. curcas seedlings to some extent.
Key words:heavy metal stress, Jatropha carcas, physiological and biochemical characteristics
由于生活和工业污水的排放、大气沉降、采矿冶炼和农药化肥的大量施用,土壤累积富集了大量污染物,土壤污染尤其是重金属污染状况变得越来越严重(周国华等,2002;公勤等,2018)。重金属污染是环境研究和保护的重点和难点(孙波等,2003),因其不同于大气和水体污染,具有隐蔽性、潜伏性和累积性的特点,是一类污染性质非常严重的土壤污染,重金属可以在生物体内富集,有时还会转化为更具毒性的甲基化合物。因此,急需找到一条在不影响土壤原本理化性质的基础上治理重金属污染的新途径,而植物的修复作用成为较易接受的方法(魏树和等,2005)。在現实环境中,单一重金属污染物对环境的影响较少见,往往是多种污染物对环境产生复合污染。复合污染时污染物的联合作用方式有相加、拮抗、协同与独立作用(吕小王,2004)。一些重金属元素如Cu、Fe和Zn等,在较低浓度时是植物生长发育的必需元素,但过多吸收植物会出现明显的不良症状。如,过量的Cu既不利于植物正常生长发育,还会使植物遭受重金属毒害;Cd是土壤污染中最具毒性的物质之一,且植物根系吸收的Cd最容易向地上部迁移;过量的Zn会作用于叶绿素生物合成途径的几种酶肽链中富含SH的部分,改变它们的正常构型,抑制酶活性和阻碍叶绿素合成。因此研究这三种重金属(Cu、Zn、Cd)单一及复合胁迫对植物生理生化造成的影响,对寻求治理重金属污染的新途径具有一定意义。
麻疯树(Jatropha curcas)系大戟科(Euphorbiacae)麻疯树属(Jatropha Linn.)落叶灌木树种,被称为小桐子(云南)、假花生(广西)等。原产美洲热带,现全世界热带和南亚热带地区均有栽培,我国主要分布于云南、四川、贵州、广西等省(区),以云南分布面积最广,资源数量最大(杨顺林等,2006)。麻疯树种子含油率在40%以上,富含油酸和亚油酸(70%以上);油脂碘值低,属于半干性油,流动性好,它与柴油、汽油、酒精的掺合性很好,相互掺合后在长时间内不分离,适合作工用油,是一种优质的木本油料植物(于曙明等,2006)。除榨取能源油外,其油渣、油饼可作农药、饲料或肥料等;全株有毒,茎、叶、树皮均有丰富的白色乳汁,内含大量毒蛋白、麻疯酮等具有抗病毒、抗AIDS、抗肿瘤作用的成分,可开发作医药、生物农药和生物杀虫剂等;此外麻疯树根系发达,是保水固土、防止沙化、增殖有机土质、建造防护林的优良造林材料,对改善生态环境和恢复植被有重要作用(苟圆和华坚,2007)。麻疯树作为世界公认的有较高经济价值的再生能源树种,研究其对重金属污染的修复作用,以便不耗费更多的劳动力成本,发展前景良好。
本研究利用不同浓度的Cu2+、Zn2+、Cd2+溶液对麻疯树幼苗进行单一及复合胁迫处理,测定胁迫14 d后其幼苗的各项生理指标,包括丙二醛(MDA)、过氧化物酶(POD)、根系活力、叶绿素含量、蛋白质(Pro)含量、细胞膜透过性、脯氨酸含量等,以了解麻疯树受胁迫后生理生化的变化规律,探讨铜、锌、镉毒害植物的机理以及被毒害后麻疯树的各种生理响应和抗逆效果,对麻疯树的生长促进和重金属污染的植物修复提供科学根据。
1 材料与方法
1.1 材料与试验设计
1.1.1 麻疯树种子萌发 麻疯树种子采购于云南壮大科技有限公司,品系为TD2。选取饱满种子,用自来水浸泡12 h后用浓度为0.2 g·L-1高锰酸钾消毒10 min,用蒸馏水反复洗去残留的高锰酸钾,用已消毒的镊子将清洗干净的麻疯树种子置于预先消毒准备好的口径为27 cm×22 cm×3.5 cm,下垫1层脱脂棉上层盖滤纸的铝合金盘中,转入已经消毒的恒温恒湿培养箱中培养,培养条件设定为温度25 ℃、湿度85%、光照1 000 lx。萌发期间保证种子的水分需求。待种子发芽,胚根长至约0.5 cm时移栽。
1.1.2 麻疯树幼苗培养试验 选取发芽良好的麻疯树种子移栽至塑料杯中,用洗净并风干的沙砾固定根系,用pH6.4的1/2 Hoagland培养液在室内自然条件下浇灌培养。培养期间保证水分及养料的需求。培养3 d后选出长势一致的幼苗进行重金属胁迫试验。
1.1.3 麻疯树幼苗重金属胁迫盆栽试验设计 处理Cu2+ 溶液质量浓度(以纯 Cu2+ 计)为0、25、50、100、200、400 mg·L-1;处理 Zn2+ 溶液质量浓度(以纯 Zn2+计)为0、25、50、100、200、400 mg·L-1,处理 Cd2+溶液质量浓度(以纯 Cd2+计)为0、5、25、50、100、200 mg·L-1处理 Cu2+、Zn2+、Cd2+ 复合的浓度(单位为mg·L-1)为0+0+0、25+25+5、50+50+25、100+100+50、200+200+100、400+400+200;各浓度组分别记为 T1、T2、T3、T4、T5、T6。配方试剂及浓度为322 μmol·L-1尿素;360 μmol·L-1 MgSO4·7H2O,600 μmol·L-1Ca ( NO3 ) 2 ·4H2O;300 μmol·L-1KH2PO4;900 μmol·L-1 KNO3 ;4.3 μmol·L-1MnSO4·H2O;4.0 μmol·L-1Na2B4O7·10H2O;0.34 μmol·L-1CuSO4 · 5H2O;1.3 μmol·L-1 ZnSO4 ·7H2O; 0.04 μmol·L-1Na2MoO4·2H2O;3.4 μmol·L-1Fe-EDTA。
以1/2 Hoagland培养液配置的胁迫液对麻疯树幼苗进行胁迫处理,每个实验组10棵幼苗。选取长势一致的麻疯树幼苗,用洗净并风干的沙砾固定根系。用不同浓度的CdCl2、CuSO4和ZnSO4的单独及混合完全培养液浇灌,使之保持湿润状态,每两天将聚乙烯塑料杯中剩余的完全培养液倒出,重新加入新的培养液进行胁迫。培养14 d后,在同组中选取长势一致的三株麻疯树幼苗进行各项生理指标的测定。
1.1.4 麻疯树幼苗根的取样 把根仔细洗净,地上部分从茎基部切除。将根放入三角瓶中,倒入反应液(1%TTC溶液、0.4 μmol·L-1的琥珀酸和磷酸缓冲液以1∶5∶4比例混合),以浸没根为度,置37 ℃左右暗处放1~3 h,以观察着色情况,待新根尖端几毫米以及细侧根都明显地变成红色。
1.2 麻疯树幼苗的生理生化测定
丙二醛(MDA)与可溶性糖含量用硫代巴比妥酸(TBA)法测定(殷恒霞等,2009);过氧化物酶(POD)活性用愈创木酚法测定(汤章城,1999);根系活力用TTC法测定(张志良等,2009);葉片光合色素含量用80%丙酮萃取法测定(李得孝等,2005);可溶性蛋白(Pro)用考马斯亮蓝法测定(曲春香等,2006);游离脯氨酸含量用酸性茚三酮法测定;细胞膜渗透压通过测定外渗液电导率变化来测定(石连旋等,2013);CAT活性用紫外吸收法测定。
1.3 数据分析
本研究原始数据的相关计算借助于Excel软件 ,并用SPSS(13.0)对数据进行 one-way ANOVA分析(P<0.05)。
2 结果与分析
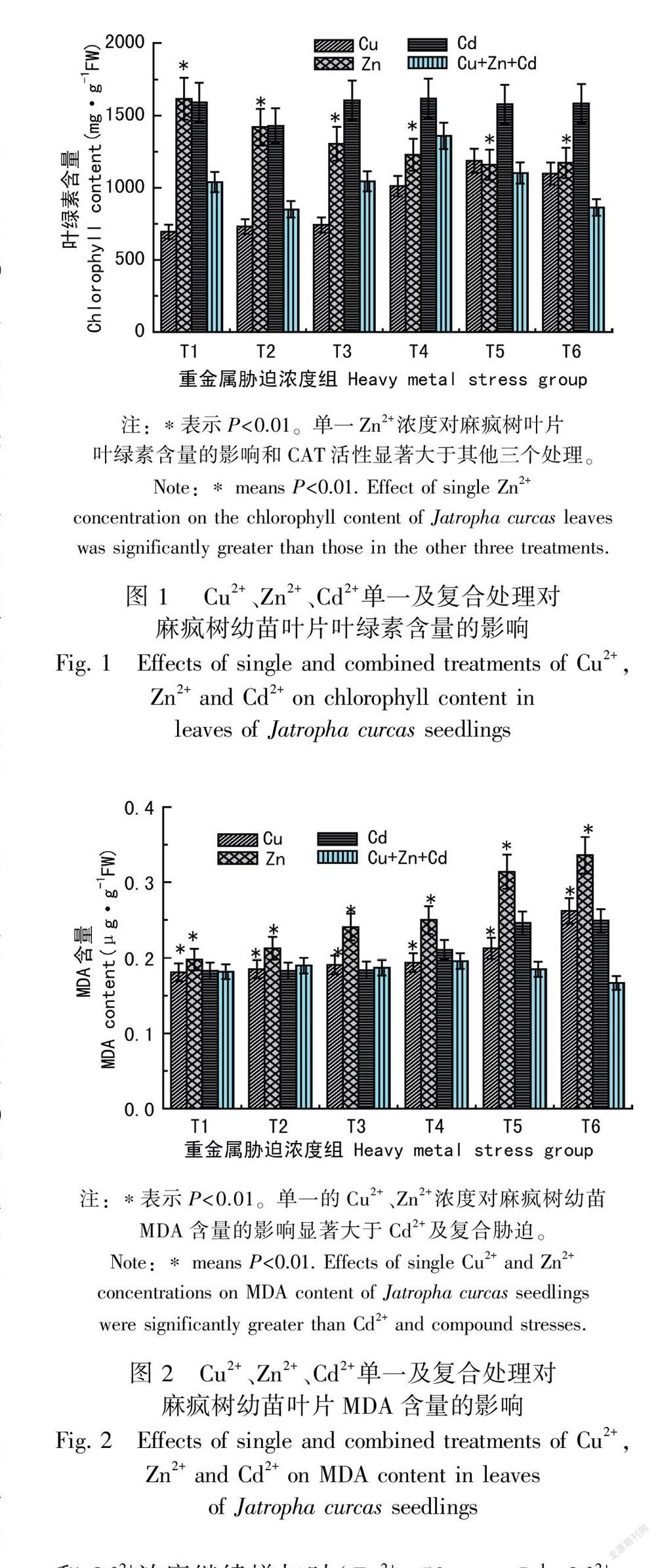
2.1 Cu2+、Zn2+、Cd2+单一及复合胁迫对麻疯树幼苗叶绿素含量的影响
由图1可知,随着Cu2+浓度的增加,麻疯树幼苗叶片的叶绿素含量先升后降,当Cu2+浓度为200 mg·L-1时叶绿素含量最大,且受Cu2+胁迫的五组麻疯树叶片的叶绿素含量均比对照组有所增加。由此可知,Cu2+浓度较大时对麻疯树叶片中叶绿素的积累仍具有促进作用。麻疯树幼苗叶片的叶绿素含量随着Zn2+浓度的增加越来越低,随着Zn2+摄入的增加麻疯树叶片中叶绿素合成遭受的破坏越严重(P<0.01)。而不同Cd2+浓度胁迫对叶绿素的合成影响不大(P>0.05)。在同一浓度组处理下,以Zn和Cd对叶绿素的含量变化影响最大。Cu、Zn、Cd 复合胁迫时与对照组相比各浓度组的叶绿素含量均有不同程度的升降,但是变化幅度都不大。由此可知,随着Cu2+、Cd2+的加入减缓了Zn2+对叶绿素合成的毒害作用。
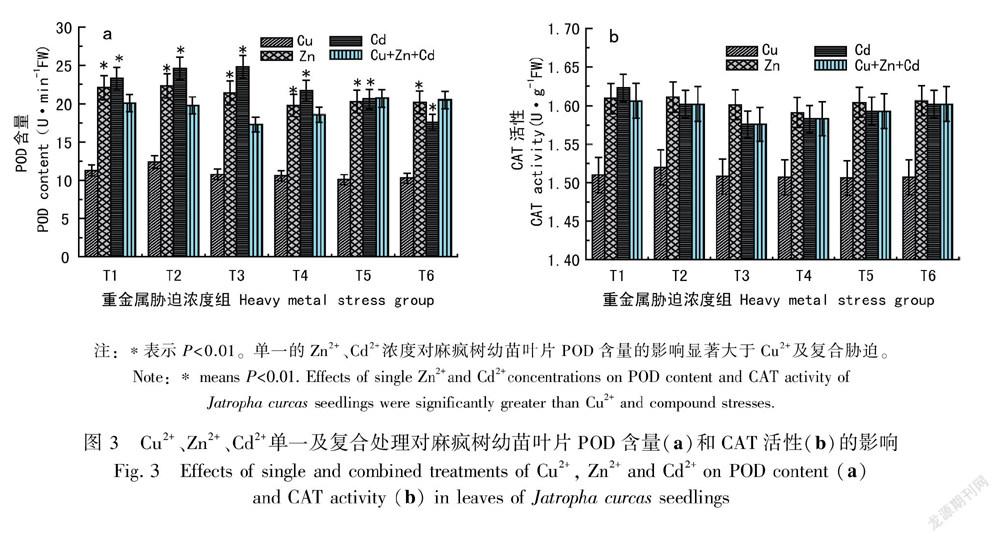
2.2 Cu2+、Zn2+、Cd2+单一及复合胁迫对麻疯树幼苗丙二醛(MDA)含量的影响
图2结果表明,随着Cu2+、Zn2+浓度的增加,丙二醛的含量也逐渐增加(P<0.01),表明Cu2+、Zn2+胁迫明显加快了植物叶片细胞膜脂过氧化过程。低浓度的Cd2+对麻疯树叶片MDA含量与对照组相比无明显的变化,只有在较高浓度 (Cd2+>100 mg·L-1)时麻疯树叶片膜脂的过氧化程度才开始加剧,MDA 含量升高,膜结构受损严重,幼苗的抗逆性下降。Cu2+、Zn2+、Cd2+复合胁迫随着浓度的增加与对照组相比MDA的含量均有不同程度的升降,但幅度都很小。
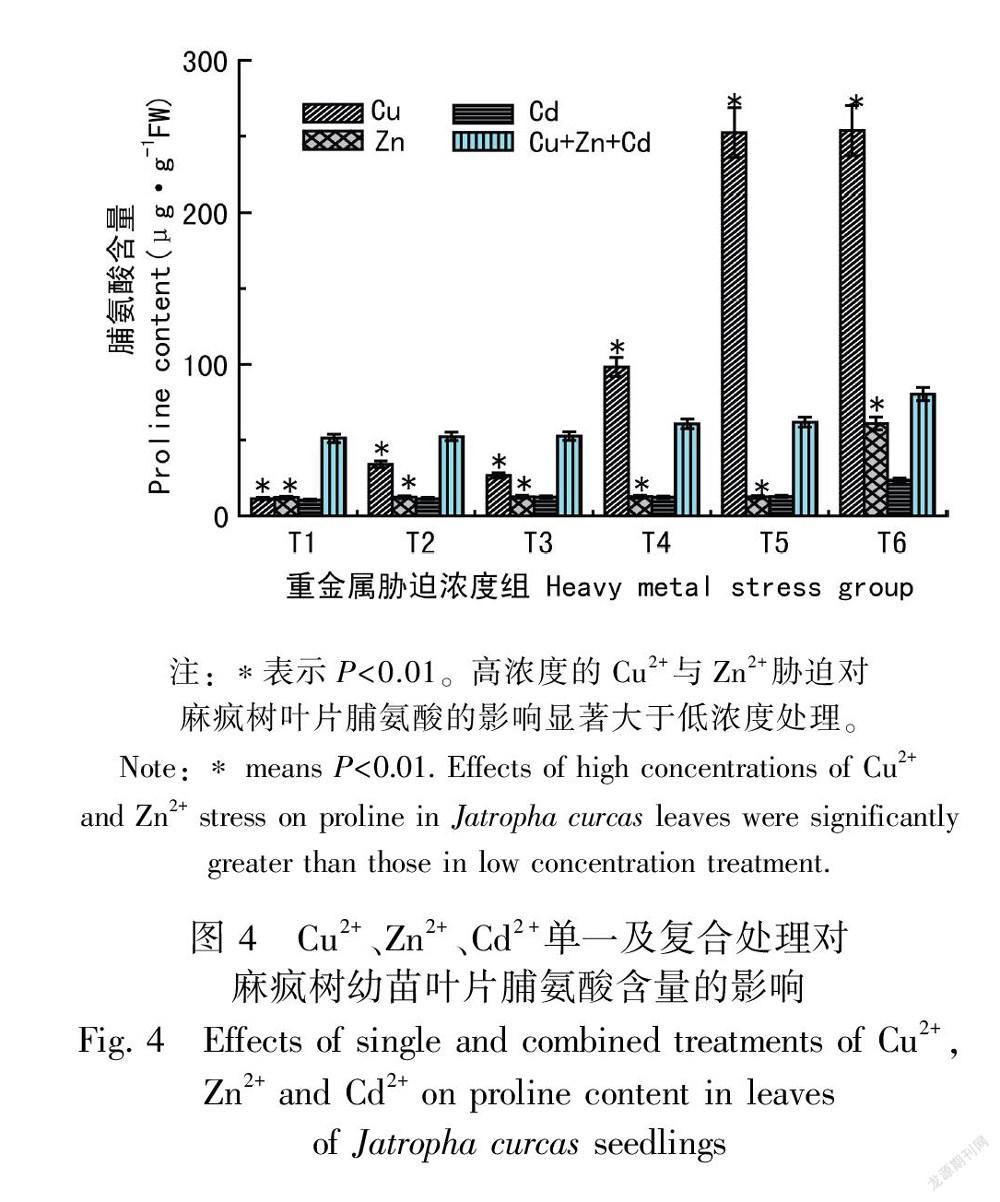
2.3 Cu2+、Zn2+、Cd2+单一及复合胁迫对幼苗叶片过氧化物酶(POD)及CAT活性的影响从图3:a可以看出,不同浓度的Cu2+胁迫,幼苗叶片的POD活性与对照组相比相差均不大(P>0.05)。Zn2+和Cd2+胁迫则对幼苗叶片的POD活性造成极显著的影响(P<0.01)。随着Zn2+和Cd2+浓度的增加,POD活性均先升后降,说明低浓度的Zn2+和Cd2+能提高麻疯树幼苗的POD活性,当Zn2+
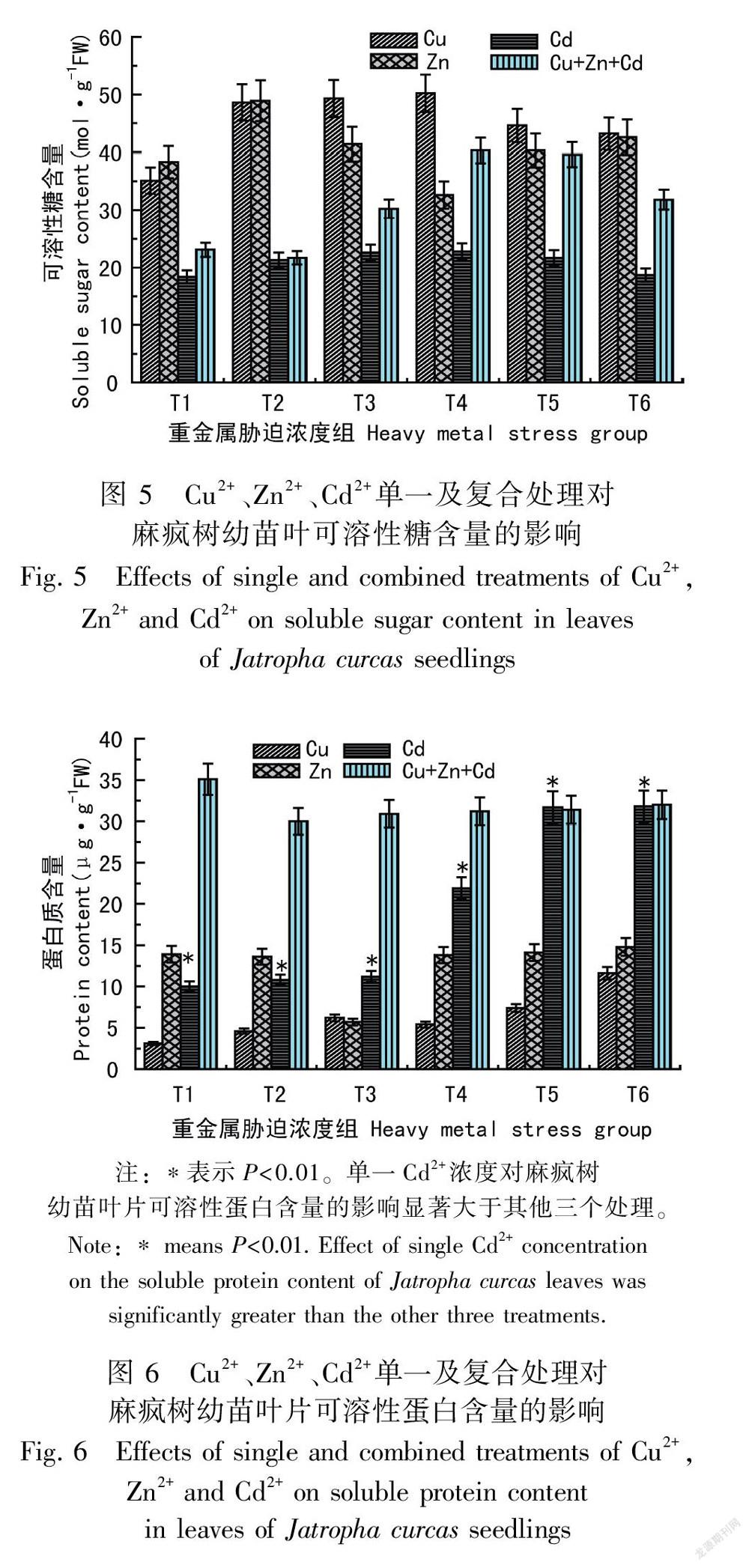
2.4 Cu2+、Zn2+、Cd2+单一及复合胁迫对麻疯树幼苗叶片脯氨酸含量的影响
从图4可以看出,在较低(Cu2+、 Zn2+ <100 mg·L-1)浓度胁迫时麻疯树幼苗脯氨酸含量与对照组相比无明显影响,但在较高浓度(Cu2+ >100 mg·L-1)水平下脯氨酸含量则成明显的上升趋势,分别比对照组增加了237.65%和242.04%(P<0.01)。在不同浓度Cd胁迫和复合胁迫中麻疯树幼苗体内脯氨酸的含量与对照组相比虽有所增加,但是增加的幅度都很小,说明Cd胁迫和复合胁迫对麻疯树幼苗脯氨酸的积累无明显影响。
2.5 Cu2+、Zn2+、Cd2+单一及复合胁迫对麻疯树幼苗叶片可溶性糖含量的影响
从图5可以看出,随着 Cu2+浓度的增加麻疯树幼苗叶片中可溶性糖的含量也逐渐增加。随着Zn2+浓度的增加,麻疯树幼苗叶片中可溶性糖的含量与对照组相比均有不同程度的增加,Cu2+浓度为100 mg·L-1时达到峰值,Zn2+浓度为25 mg·L-1时达到峰值。Cd2+单一胁迫时随着浓度的增加麻疯树叶片中可溶性糖含量与对照组相比无明显变化。即Cd2+胁迫对麻疯树可溶性糖的累积无明显影响。由不同Cu2+、 Zn2+浓度胁迫麻疯树幼苗测定的叶片脯氨酸含量表明,随着复合胁迫浓度的增加麻疯树幼苗叶片中可溶性糖含量先升后降,在T5组浓度(Cu2+、Zn2+ 为200 mg·L-1、Cd2+为100 mg·L-1)时达到最大值。
2.6 Cu2+、Zn2+、Cd2+单一及复合胁迫对麻疯树幼苗叶片可溶性蛋白含量的影响
植物体内的可溶性蛋白含量是一个重要的生理生化指标。其含量还可以影响细胞渗透性和功能蛋白的数量。图6结果显示,Cu2+、Zn2+、Cd2+单一胁迫时麻疯树幼苗叶片中可溶性蛋白含量随着胁迫浓度的增加而增加,且Cd2+单一胁迫时增加的最为明显(P<0.01)。复合胁迫时麻疯树幼苗叶片内可溶性蛋白含量均维持在一个较高的水平,但受复合胁迫浓度的影响变化不大(P>0.05)。
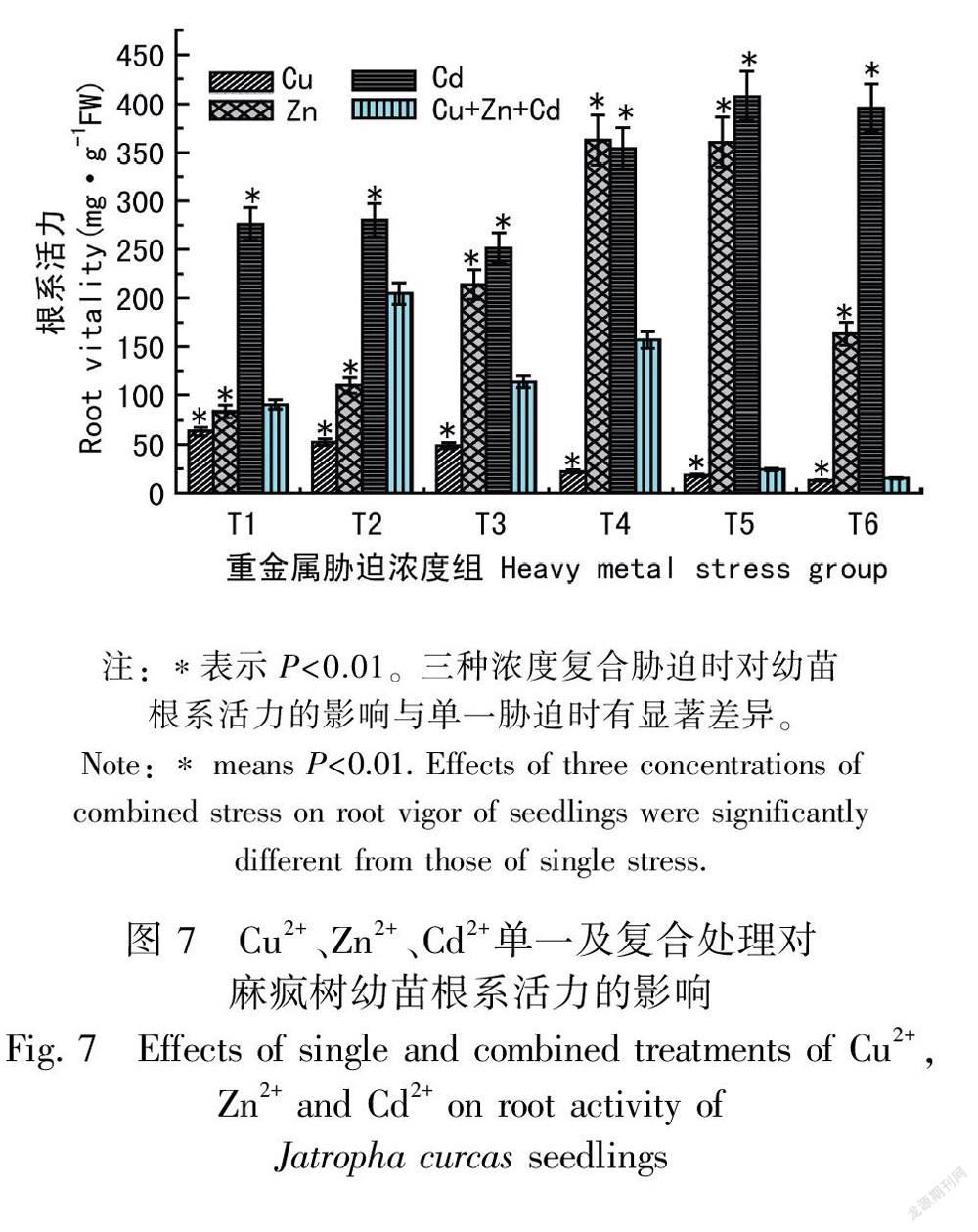
2.7 Cu2+、Zn2+、Cd2+单一及复合胁迫对麻疯树幼苗根系活力的影响
由图7可知,Cu2+、Zn2+、Cd2+单一和复合胁迫对麻疯树幼苗的根系活力都表现出较为显著的影响(P<0.01)。随着Cu2+浓度的增加麻疯树幼苗根系活力逐渐减弱,在高浓度Cu2+胁迫时(Cu2+>200 mg·L-1),根系活力急剧下降基本接近于零即根基本死亡。Zn2+胁迫时,随着Zn2+浓度的增加根系活力先增强后减弱,但根系活力都维持在一个较高水平。Cd2+胁迫对根系活力没有明显的影响,随着Cd2+浓度的增加根系活力与对照组相比虽有不同程度的增减但都维持在较高的水平。复合胁迫时随着复合浓度的增加,麻疯树幼苗根系活力先增强后减弱,在T6组浓度时基本死亡。
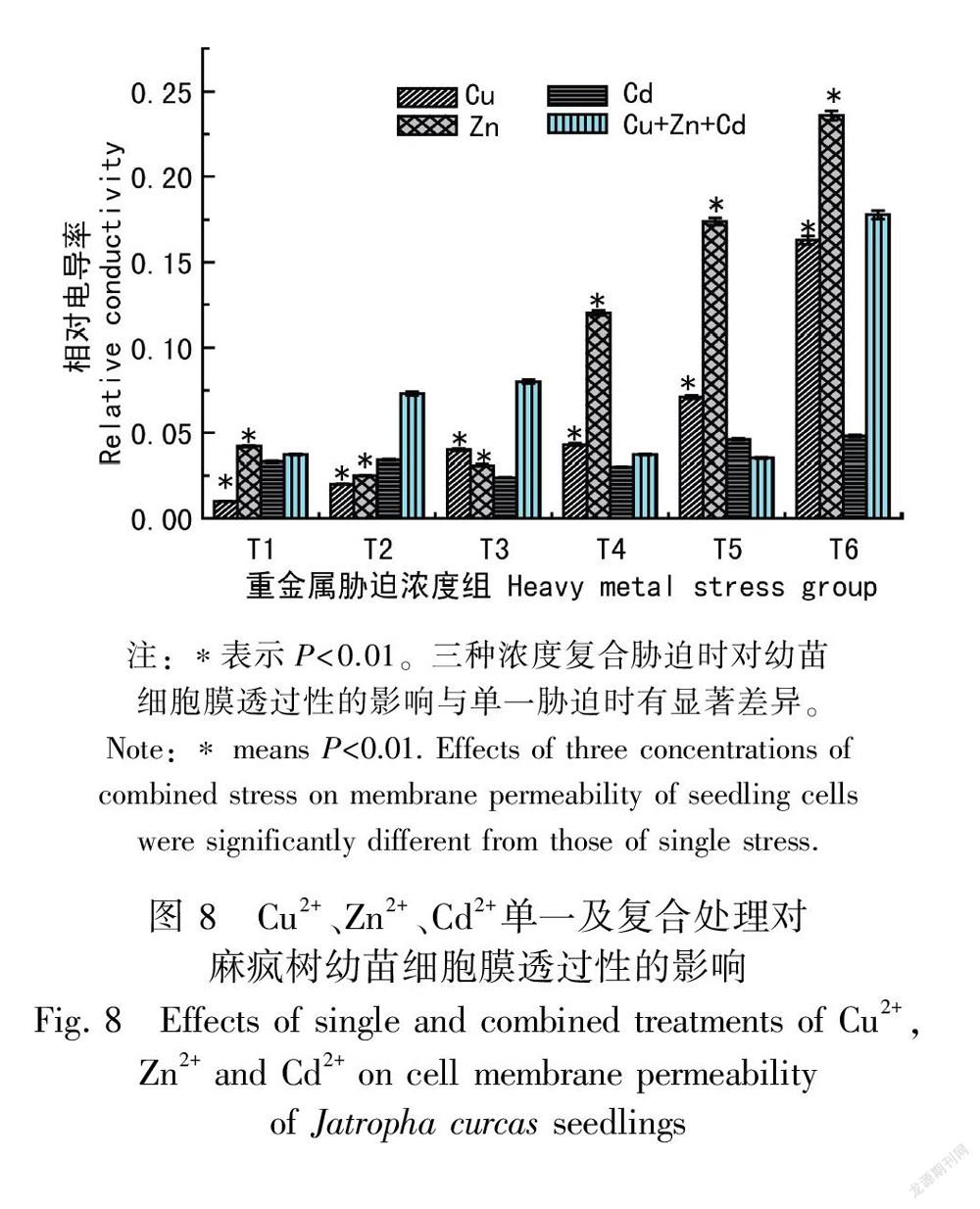
2.8 Cu2+、Zn2+、Cd2+单一及复合胁迫对麻疯树幼苗细胞膜透过性的影响
在正常情况下,细胞膜对物质具有选择透过性,当植物受到逆境影响时,细胞膜遭受破坏,膜透性增大,导致细胞内的电解质外渗,以致植物细胞浸提液的相对电导率增大。可根据相对电导率鉴定植物抗逆性强弱。图8结果显示,随着Cu2+浓度的增加,麻疯树幼苗相对电导率逐渐增加,说明随着Cu2+浓度的增加,细胞膜结构的损伤越严重。Zn2+胁迫时相对电导率随着Zn2+浓度的增加先降低后升高,在T4、T5、T6组浓度时与对照组相比分别增加了307.86%、501.78%、651.21%。Cd2+胁迫时随着Cd2+浓度的变化麻疯树幼苗的相对电导率与对照组相比无明显差异。复合胁迫时在T5组胁迫浓度内麻疯树幼苗的相对电导率变化不大,当达到T6组浓度时相对电导率急剧上升,与对照组相比增加了652.26%。
3 讨论
3.1 重金属Cu胁迫对麻疯树幼苗生理生化特性的影响
重金属对植物生理生化特性的影响过程是较复杂的,会由于外界环境的改变产生不同影响,较严重的不利影响会导致植物生长不良、产生病害、早衰甚至死亡。铜是植物生长发育必需的营养元素,细胞色素氧化酶、多酚氧化酶和抗坏血酸氧化酶的合成及光合电子传递均离不开铜,但由于铜具有累积性,过量的铜会使植物体遭受严重的重金属毒害(王镜岩等,2002)。本研究中,经过不同浓度的Cu2+ 处理,麻疯树幼苗的各项生理指标表现出不同的变化。随着 Cu2+ 浓度的增大,丙二醛含量和相对电导率也逐渐增大表明Cu2+会破坏麻疯树幼苗叶片膜的结构和功能,引起细胞膜透过性升高和MDA含量的升高。随着脯氨酸和可溶性蛋白含量的逐渐增加麻疯树幼苗也体现出对Cu胁迫的抗逆性和适应性。叶绿素、可溶性糖含量和根系活力先增后降,200 mg·L-1时叶绿素含量最大;100 mg·L-1时可溶性糖含量最高;50 mg·L-1时根系活力最强,当浓度达到400 mg·L-1时根系已基本死亡。这表明低浓度的Cu2+对麻疯树幼苗的毒害作用不大,只有当Cu2+浓度达到一定量时,麻疯树幼苗的生长才会受到严重抑制。
3.2 重金属Zn胁迫对麻疯树幼苗生理生化特性的影响
Zn是植物生长的必需元素之一,缺乏Zn元素时植物会出现明显的症状。Zn2+在细胞内超过一定浓度时,也会损害植物细胞。植物吸收过量的Zn2+会导致酶活性降低或丧失,蛋白质空间结构的破坏会引起胞内蛋白质的凝集,细胞代谢平衡失调,细胞塌陷甚至崩解。由本研究生理指标的测定结果可知,随着Zn2+浓度的增加,麻疯树叶绿素含量和过氧化物酶活性逐渐降低,丙二醛含量逐渐升高,说明过量的Zn2+能够破坏麻疯樹幼苗叶片中叶绿素的合成和抑制抗氧化酶的活性,破坏叶片膜结构和功能,导致MDA的大量合成。从可溶性糖、可溶性蛋白和游离脯氨酸含量的逐渐增加可知麻疯树幼苗通过自身的调节来抵抗和适应Zn2+胁迫对自身造成的伤害。由相对电导率和根系活力先升后降可知,低浓度的Zn2+对麻疯树幼苗的生长起到一定的促进作用,高浓度Zn2+则明显地抑制麻疯树幼苗生理生化的指标。
3.3 重金属Cd胁迫对麻疯树幼苗生理生化特性的影响
Cd是植物生长的非必需元素,不参与任何结构组成和生命代谢活动,对于所有生物体都具有毒性,低浓度(0.1~1 mg·kg-1)Cd2+可抑制植物的生长、发育和繁殖,高浓度Cd2+可导致植物死亡(尹国丽等,2013)。研究表明,Cd2+能够导致植物细胞损伤,包括引起植物根损伤(Godbold & Polle,2001)、抑制光合作用和蒸腾作用(Siedlecka & Tadeusz,1993)、束缚自由巯基使蛋白变性或失活(Cobbett & Goldsbrough,2002)、置换不同蛋白包括转录因子和辅酶(Assche & Clijsters,1990)、引起氧化胁迫(Sandalio et al.,2001)、产生活性氧(Shah et al.,2001)等。本研究中,Cd胁迫麻疯树幼苗结果表明,MDA含量随着Cd2+浓度的增加而增加说明Cd2+破坏了麻疯树幼苗体内活性氧代谢的平衡,可溶性蛋白和游离脯氨酸含量的增加减弱了Cd2+对麻疯树幼苗的毒害作用,从而使得Cd2+对叶绿素的合成和根系活力的毒害作用降至最低。当Cd2+浓度大于50 mg·L-1时POD活性和可溶性糖含量均有明显的下降,而相对电导率则明显增高,由此可知当Cd2+浓度大于50 mg·L-1时,Cd对麻疯树幼苗的毒害作用逐渐表现出来。
3.4 重金属Cu、Zn、Cd复合胁迫对麻疯树幼苗生理生化特性的影响
叶绿素是植物光合作用的物质基础,其含量高低直接影响植物光合作用的强度及物质合成速率。当植物受到重金属胁迫时,叶绿素含量显著降低,叶绿体膜结构受到损伤,叶绿体内的光合酶含量降低,叶片气孔关闭,光合作用强度降低(文晓慧,2012)。本研究麻疯树幼苗叶片色素吸收光谱结果表明,随着复合胁迫浓度的增加,其叶绿素含量与对照组相比有不同程度的增减但是变化均不大,即复合胁迫对麻疯树幼苗叶片叶绿素的合成影响不大。本研究结果显示,与对照组相比受胁迫的麻疯树幼苗POD活性有不同程度的降低,由此可知复合胁迫打破了麻疯树幼苗体内正常的活性氧代谢平衡,因过氧化物酶活性的降低引起活性氧的累积,进而导致膜脂过氧化,MDA含量升高。
脯氨酸作为渗透调节物质(卢少云等,2003),可在逆境条件下大量合成。本研究在较低复合胁迫浓度(Cu2+、Zn2+<50 mg·L-1,Cd2+<25 mg·L-1)时脯氨酸含量与对照组相比无明显变化,当复合胁迫浓度较高(Cu2+、Zn2+>100 mg·L-1,Cd2+>50 mg·L-1)时脯氨酸含量急剧增加,可能是由于重金属胁迫时氧自由基的大量累积,从而造成脯氨酸应激性升高,以发挥清除氧自由基的作用。
根系作为植物吸收和运输水分及营养物质的主要器官,根系活力的高低可以直接反应植物的生长状况。本研究结果表明,随着复合胁迫浓度的增加根系活力先增后减说明低浓度的复合胁迫对麻疯树幼苗的生长会起到一定的促进作用,通过叶绿素的合成水平,可看出Cu2+、Cd2+的加入使得Zn2+对叶绿素合成造成的影响减弱,可能是由于Cu、Cd的加入抑制了麻疯树对Zn的吸收,Cu、Cd对Zn的吸收产生了拮抗作用,此外通过其他生理生化指标的变化表明,复合胁迫时对麻疯树的毒害作用小于单一胁迫,这可能是三种离子共存时,会在一定程度上降低植物对彼此的吸收,即复合胁迫下,一种元素的加入将抑制植物对另外元素的吸收,进而减轻毒害。
4 结论
本文研究了麻疯树幼苗生长、生理生化特征对不同浓度的Cu2+、Zn2+、Cd2+单一及复合胁迫下响应机制,得出以下结论:(1)Cu2+主要破坏麻疯树幼苗的根系和细胞膜,对麻疯树的毒害作用最大。(2)Zn2+主要破坏麻疯树幼苗的光合色素的合成和抑制过氧化物酶的活性,但麻疯树可以通过增加蛋白质、脯氨酸、可溶性糖等的含量来对自身进行调节以减轻Zn2+的毒害作用。(3)低浓度的Cd2+对麻疯树幼苗的生长发育无明显影响,浓度大于50 mg·L-1时对麻疯树幼苗的过氧化物酶活性、细胞膜透过性等表现出较大的毒害作用。(4)低浓度复合胁迫可以减轻单金属胁迫对麻疯树幼苗的毒害作用,较高浓度(Cu2+、Zn2+>100 mg·L-1,Cd2+>50 mg·L-1)的复合胁迫可以直接破坏麻疯树幼苗的根系,使根系腐烂、植株脱水死亡。
综上所述,麻疯树对三种重金属的胁迫具有一定的抗性,过高浓度的胁迫会对麻疯树幼苗生长发育造成损伤,但是麻疯树可以通过自身的防御系统使伤害降到最小,以此可以将其作为一种再生能源树种,通過其本身的植物修复作用,来为治理重金属污染提供一些基础依据。
参考文献:
ASSCHE F, CLIJSTERS H, 1990. Effects of metals on enzyme activity in plants [J]. Plant Cell Environ,13(3):195-206.
COBBETT C, GOLDSBROUGH P, 2002. Phytochelatins and metallothioneins:Roles in heavy metal detoxification and homeostasis. [J]. Ann Rev Plant Biol, 53(1):159.
GODBOLD DL, POLLE A, 2001. Cadmium-induced changes in antioxidative systems, hydrogen peroxide content, and differentiation in scots pine roots [J]. Plant Physiol, 127(3):887-898.
GONG Q, KANG Q, WANG L, et al., 2018. Toxicity mechanism of heavy metal copper to plants:A review [J]. J Southern Agric, 49(3):469-475. [公勤, 康群, 王玲, 等, 2018. 重金属铜对植物毒害机理的研究现状及展望 [J]. 南方农业学报, 49(3):469-475.]
GOU Y,HUA J, 2007. Development and prospect of Jatropha resources [J]. Resour Dev Market,23(6):519-522. [苟圆, 华坚, 2007. 麻疯树资源的开发利用现状及前景 [J]. 资源开发与市场, 23(6):519-522.]
LI DX,GUO YX,YUAN HY, et al., 2005. Corn chlorophyll content determination method [J]. Chin Agric Sci Bull,21(6):153-155. [李得孝, 郭月霞, 员海燕,等, 2005. 玉米叶绿素含量测定方法研究 [J]. 中国农学通报, 21(6):153-155.]
LU SY, CHEN SP, CHEN SM, 2003. Changes of proline content and antioxidant enzyme activity in three warm season turfgrass under drought condition [J]. Hortic J,30(3):303-306. [卢少云, 陈斯平, 陈斯曼,等, 2003. 三种暖季型草坪草在干旱条件下脯氨酸含量和抗氧化酶活性的变化 [J]. 园艺学报, 30(3):303-306.]
L XW, 2004. Absorption effect of plants on heavy metals in soil [D]. Nanjing:Nanjing University of Science and Technology. [吕小王, 2004. 植物对土壤中重金属的吸收效应研究 [D]. 南京:南京理工大学.]
QU CX,SHEN SD,WANG XF, 20006. Determination of soluble protein content in crude extracts of plants using Coomassie brilliant blue [J]. J Suzhou Univ(Nat Sci Ed), 22(2):82-85. [曲春香, 沈颂东, 王雪峰, 等, 2006. 用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究 [J]. 苏州大学学报(自然科学版), 22(2):82-85.]
SANDALIO LM, DALURZO HC, GMEZ M, et al., 2001. Cadmium-induced changes in the growth and oxidative metabolism of pea plants [J]. J Exp Bot, 52(364):2115.
SHAH K, KUMAR RG, VERMA S, et al., 2001. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings [J]. Plant Sci, 161(6):1135-1144.
SHI LX,YAN H,2013. Plant physiology experimental guidance [M].Beijing:Higher Education Press. [石连旋, 颜宏, 2013. 植物生理学实验指导 [M]. 北京:高等教育出版社.]
SIEDLECKA A, TADEUSZ B, 1993. Inhibition of electron flow around photosystem I in chloroplasts of Cd-treated maize plants is due to Cd-induced iron deficiency [J]. Physiol Plant, 87(2):199-202.
SUN B, ZHOU SL, ZHAO QG, 2003. Study on compound pollution of heavy metals in soil based on spatial variability analysis [J]. Agro-Environ Sci, 22(2):248-251. [孙波, 周生路, 赵其国, 2003. 基于空间变异分析的土壤重金属复合污染研究 [J]. 农业环境科学学报, 22(2):248-251.]
TANG ZC, 1999. Modern plant physiology experiment guide [M]. Beijing:Science Press. [湯章城,1999. 现代植物生理学实验指南 [M]. 北京:科学出版社.]
WANG JY, ZHU SG, XU CF, 2002. Biochemistry [M]. Beijing:Higher Education Press:465-466. [王镜岩, 朱圣庚, 徐长法, 2002. 生物化学 [M]. 北京:高等教育出版社:465-466.]
WEI SH, ZHOU QX, LIU R, 2005. Utilization of weed resources in heavy metal contaminated soil remediation [J]. Nat Resour, 20(3):432-440. [魏树和, 周启星, 刘睿, 2005. 重金属污染土壤修复中杂草资源的利用 [J]. 自然资源学报, 20(3):432-440.]
WEN XH, 2012. The toxic effects of heavy metal stress on plants [J].Agric Disaster Res,2(11):20-21. [文晓慧, 2012. 重金属胁迫对植物的毒害作用 [J]. 农业灾害研究, 2(11):20-21.]
YANG SL, FAN YQ, SHA YC, et al., 2006. Jatropha carcas resources distribution and prospects of comprehensive development and utilization [J]. SW Chin J Agric Sci,19:447-452. [杨顺林, 范月清, 沙毓沧, 等, 2006. 麻疯树资源的分布及综合开发利用前景 [J]. 西南农业学报,19:447-452.]
YIN GL, SHI SL, KOU JT, et al., 2013. Cd stress on the alfalfa seed germination and physiological and biochemical characteristics of the seedlings [J]. Acta Bot Boreal-Occident Sin, 22(8):1638-1644. [尹国丽, 师尚礼, 寇江涛, 等, 2013. Cd胁迫对紫花苜蓿种子发芽及幼苗生理生化特性的影响 [J]. 西北植物学报, 22(8):1638-1644.]
YIN HX, LI X, MI Q, et al., 2009. Effects of stress of Cadmium, Zinc, and Copper on the growth of early seedlings of sunflower [J]. Plant Genet Resour,10(2):290-294. [殷恒霞, 李霞, 米琴, 等, 2009. 镉、锌、铜胁迫对向日葵早期幼苗生长的影响 [J]. 植物遗传资源学报, 10(2):290-294.]
YU SM, SUN JC, CHEN BT, 2006. Study on the Jatropha curcas resources in Guizhou and its development and utilization [J]. J W For Sci, 35(3):14-17. [于曙明, 孙建昌, 陈波涛, 2006. 贵州的麻疯树资源及其开发利用研究 [J]. 西部林业科学, 35(3):14-17.]
ZHANG ZL, ZHAI WJ, LI XF, 2009. Plant physiology experimental guidance [M]. Beijing:Higher Education Press. [张志良, 瞿伟菁, 李小方, 2009. 植物生理学实验指导 [M]. 北京:高等教育出版社.]
ZHAO FG, LIU YL, ZHANG WH, 2002. Relationship between leaf proline metabolism and salt tolerance in barley seedlings [J]. J Nanjing Agric Univ, 25(2):6-10. [赵福庚, 刘友良, 章文华, 2002. 大麦幼苗叶片脯氨酸代谢及其与耐盐性的关系 [J]. 南京农业大学学报, 25(2):6-10.]
ZHOU GH,HUANG HZ,HE HL, 2002. Phytoremediation and progress of heavy metal polluted soil [J]. Acta Sci Circumst,3(6):33-39. [周国华, 黄怀曾, 何红蓼, 2002. 重金属污染土壤植物修复及进展 [J]. 环境工程学报, 3(6):33-39.]

