蛹虫草液体发酵菌丝体和固体栽培子实体中活性成分的比较
朱丽娜,高新华,刘艳芳,张红霞,周 帅,张 忠,李传华,唐庆九*
(1上海市农业科学院食用菌研究所,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,国家食用菌加工技术研发分中心,上海市农业遗传育种重点开放实验,上海201403;2上海市农业科学院生态环境保护研究所,上海201403)
蛹虫草[Cordycepsmilitaris(L.)Link],又称北虫草、蛹草、北冬虫夏草、蛹草菌等[1],其含有的多糖、核苷、甾醇等多种活性成分具免疫调节、抗癌、抗氧化、抗衰老、抗病毒等作用[2-3]。蛹虫草已实现人工规模化种植,并于2009年被批准为新资源食品,因而蛹虫草子实体成为保健品、食品的重要原料[4]。
固体培养蛹虫草子实体是目前蛹虫草人工培植的主要方式,将蛹虫草菌种接种在大米、小麦等固体培养基上,在一定的温度、湿度和光照条件下,培养45—60 d获得蛹虫草子实体[5]。研究表明,深层发酵菌丝体中存在和子实体的药用作用相同的化学物质[6-8],具有相似的药理作用[9-12]。以往对蛹虫草菌液体发酵的研究主要集中在培养基和发酵条件的优化方面[13-17],关于相同蛹虫草菌株用不同培养方式得到的子实体和菌丝体的活性成分差异还未见报道。本研究拟比较同一蛹虫草菌株获得的子实体和菌丝体在多糖、核苷、游离糖醇和小分子糖类及氨基酸成分方面的差异,以期为今后不同蛹虫草产品的进一步开发利用提供参考。
1 材料与方法
1.1 菌株
蛹虫草菌株(编号CM-H0810)由上海市农业科学院生态环境保护研究所虫草课题组保藏。
1.2 主要试剂与仪器
葡萄糖、半乳糖、甘露糖、阿拉伯糖、果糖、鼠李糖、木糖、岩藻糖、海藻糖、赤藓糖醇、甘露醇为美国Sigma公司产品;普鲁兰多糖标准品(P-82)为日本Shodex公司产品;黄嘌呤、次黄嘌呤、尿嘧啶、胞嘧啶、胞苷、尿苷、胸腺嘧啶、腺嘌呤、腺苷、鸟苷、肌苷、胸苷、虫草素(3’-脱氧腺苷)均为美国Sigma公司产品;2’-脱氧鸟苷和2’-脱氧腺苷购自上海生工生物工程有限公司;N6-(2-羟乙基)腺苷由上海市农业科学院食用菌研究所加工技术与发酵工程研究室分离纯化,经1H-NMR、13C-NMR和ES-MS鉴定;甲醇(色谱纯)为美国Dikma公司产品。
凝胶尺寸排阻色谱-多角度激光光散射-示差折光检测联用系统由Waters 2695高效液相系统(美国Waters公司)、2414示差折光检测器(美国Waters公司)、DAWN 8+激光检测器(美国Wyatt公司),Waters 2998紫外检测器(美国Waters公司)组成。Waters 1525高效液相色谱仪配Waters 2489紫外检测器和Waters 2707自动进样器(美国Waters公司);ICS-2500型高效离子色谱仪(美国Dionex公司);L-8900氨基酸自动分析仪(日本Hitachi公司);KQ-600B型超声清洗器(昆山市超声仪器有限公司);PURELAB ULTRA纯水制备仪(英国Elga公司)。
1.3 蛹虫草的培养
菌种制作:菌株在PDA斜面培养基上活化后,接种于PDB培养基中(50 mL PDB培养基装于150 mL三角瓶),150 r/min、25℃下培养4 d,获得所需要的生产菌种。固体培养子实体:20 g麦仁,33 mL水装入玻璃培养瓶中(直径6.8 cm,高10.5 cm),高压灭菌25 min,冷却后接种,瓶盖中垫上滤纸,在保证透气的同时避免空气交换可能引发的污染,于25℃暗培养3—4 d,当观察到菌丝已明显在培养基表面开始蔓延时,转至光培养,光照强度控制在500 lx左右,培养温度调至22℃,培养17 d左右,子实体原基开始出现,45 d左右子实体成熟并长满全瓶时收获。
液体发酵菌丝体:50 mL PDB培养基装于150 mL三角瓶,接入液体菌种,150 r/min、25℃下培养4 d。过滤收集菌丝体,用蒸馏水清洗后备用。
蛹虫草子实体和菌丝体分别于60℃干燥后经粉碎机粉碎,备用。
1.4 多糖测定
参考文献[18]的方法提取蛹虫草多糖并测定多糖含量。参考文献[19]的方法测定单糖组成。用凝胶尺寸排阻色谱-多角度激光光散射-示差折光检测仪联用分析多糖的HPSEC图谱,考察多糖的分子质量分布情况[20]。色谱条件:色谱柱为TSK-GEL G6000PWXL串联TSK-GEL G4000PWXL;2414示差折光检测器(美国Waters公司),DAWN 8+激光检测器(美国Wyatt公司);流动相为0.15 mol/L的NaNO3和0.05 mol/L的NaH2PO4·2H2O(pH 7.0),流速0.5 mol/L,上样量100μL。用ASTRA 6.1计算分子质量,以5 mg/mL的普鲁兰多糖标准品进行校正,多糖在溶液中的折光指数增量(dn/dc)按照0.146 mL/g计算。每个样品2次重复。
1.5 核苷类成分测定
采用高效液相色谱测定核苷类成分[20]。色谱条件:色谱柱Venusil MP C18柱(5μm,4.6 mm×250 mm)(中国Agela Technologies公司);流动相:水(A相)-甲醇(B相);流速:1 mL/min;洗脱程序为0—5 min:100%A,5—10 min,95%A,10—30 min:70%A,30—40 min:95%A,40—45 min:100%A;UV检测器检测,检测波长:254 nm;柱温:40℃;进样量:10μL。每个样品3次重复。
1.6 游离糖醇及小分子糖类成分测定
采用高效阴离子色谱测定游离糖醇及小分子糖类成分[20]。色谱条件:CarboPac MA1阴离子交换柱(4 mm×250 mm)(美国Dionex公司),流动相为480 mmol/L NaOH,流速0.40 mL/min,上样量25μL,柱温30℃。每个样品3次重复。
1.7 氨基酸测定
样品委托上海交通大学分析测试中心根据GB/T 5009.124—2003测定氨基酸组成,氨基酸测定方法参考文献[21]。
2 结果与分析
2.1 多糖
表1为相同蛹虫草菌株获得的子实体和菌丝体中多糖含量和其单糖组成及摩尔分数。经苯酚硫酸法测定蛹虫草菌丝体中多糖含量比子实体高25.1%。两种培养方式得到的子实体和菌丝体中多糖的单糖组成中均由葡萄糖、甘露糖、半乳糖和阿拉伯糖组成,但组成比例有差异,子实体多糖的单糖组成中葡萄糖所占摩尔分数最高为67.87%,其他单糖所占摩尔分数为2.75%—17.18%,而菌丝体中葡萄糖所占摩尔分数最高为37.87%,其次为甘露糖占33.22%、半乳糖占26.91%。

表1 多糖含量和单糖组成比较Table 1 Com parison of polysaccharide content and monosaccharide com position %
对多糖的分子质量分布图谱进行测定可以反映不同样品间的多糖差异。用多角度激光光散射仪测定聚合物和蛋白质等生物高聚物的绝对分子质量,无需进行任何色谱柱标定和对照品参考,分子质量测定范围广,可检测获得数均和重均分子质量。对培养获得的子实体和菌丝体中多糖进行HPSEC-MALLSRI联用分析,其HPSEC图谱见图1。根据HPSEC图谱上的出峰情况和紫外吸收情况,经检测0—44 min无紫外吸收,44 min后在280 nm波长下有明显的紫外吸收峰,说明44 min后出峰的组分中混有蛋白类物质,因此将图谱上的多糖分为3个组分,多糖各组分的分子质量分布特征见表2,其中蛹虫草子实体的多糖主要在Fraction 1和Fraction 2这两个组分,其重均分子质量Mw为1.702×106—4.092×107g/mol,多分散系数(Mw/Mn)为1.185—1.619,说明这两个组分的Mw分布范围窄,而菌丝体的多糖主要在Fraction 3组分中,其重均分子质量为1.105×105g/mol。
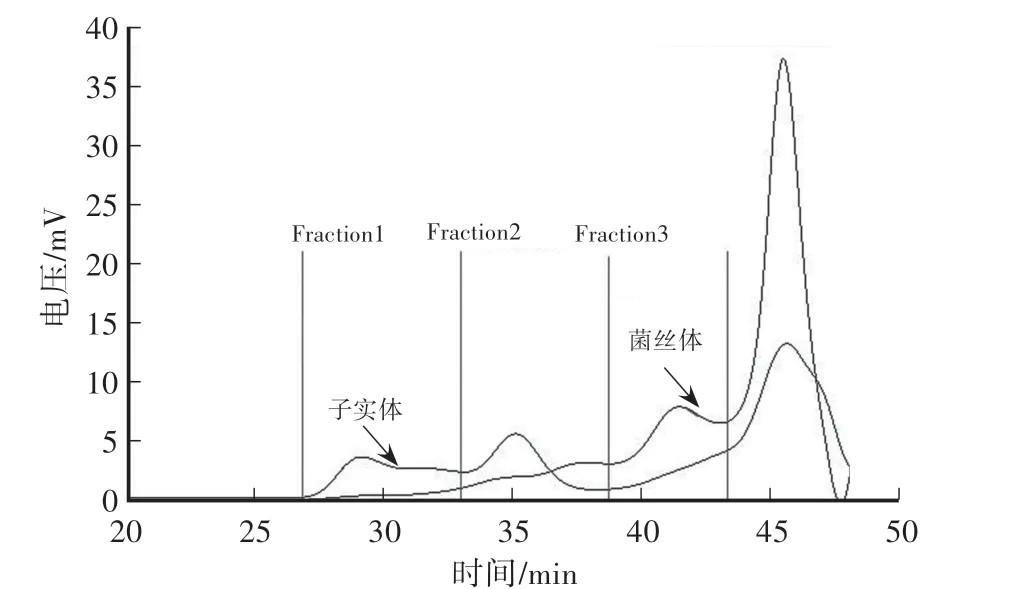
图1 多糖的HPSEC图谱比较Fig.1 Comparison of high-performance size exclusion chromatography profile of polysaccharides

表2 多糖分子质量分布特征的比较Table 2 Comparison ofmolecular characterizations of polysaccharides
2.2 核苷
用HPLC对核苷类成分进行分析,其HPLC图谱见图2,用“中药色谱指纹图谱相似度评价系统A版”软件分析固体培养和液体培养获得的子实体和菌丝体中核苷类成分HPLC图谱的相似度。结果表明,子实体和菌丝体中均含有多种核苷类成分,HPLC图谱的相似度为0.886。HPLC图谱表明,固体培养子实体中尿苷、鸟苷、腺苷、虫草素及N6-(2-羟乙基)腺苷的峰较高,为主要的核苷类成分,而液体培养菌丝体中主要的核苷类成分是尿苷、鸟苷、腺苷、虫草素。各核苷类成分含量见表3,子实体和菌丝体中腺苷含量无显著差异,但子实体中的虫草素和N6-(2-羟乙基)腺苷含量与菌丝体差异显著。
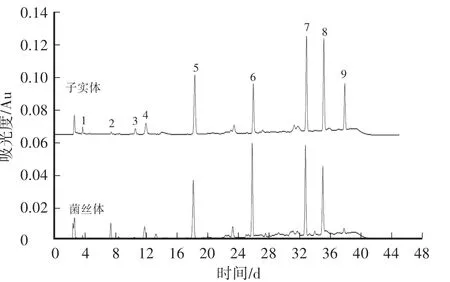
图2 核苷类成分HPLC色谱图比较Fig.2 Comparison of HPLC chromatography profiles of nucleosides

表3 核苷类成分的含量比较Table 3 Com parison of nucleoside contents mg·g-1
2.3 游离糖醇及小分子糖类成分
甘露醇也是虫草类真菌中的有效成分之一,具有利尿脱水、提高血浆渗透压、镇喘祛痰、抗自由基等药理作用,并且对多种疾病有一定的疗效[22]。研究表明,除甘露醇外,蛹虫草中还含有其他糖醇及游离的单糖、寡糖,它们不仅是有机体的组成和代谢产物,也是化学工业、商业和医药上的重要物质。由表4可知,蛹虫草菌丝体中甘露醇较高,但没有海藻糖,而子实体中海藻糖含量高达20.07%。

表4 游离糖醇、小分子糖类含量比较Table 4 Comparison of contents of free alditol and low molecular weight sugar %
2.4 氨基酸
由表5可见,蛹虫草子实体和菌丝体中均含有丰富的氨基酸,与子实体相比,菌丝体的必需氨基酸总量高17.1%,且必需氨基酸与非必需氨基酸的比值、必需氨基酸与氨基酸总量的比值较为理想,分别为0.62和0.38,接近FAO/WHO提出的理想蛋白质必需氨基酸(E%)应达总量40%左右以及E/N值应在0.6以上的要求[23]。
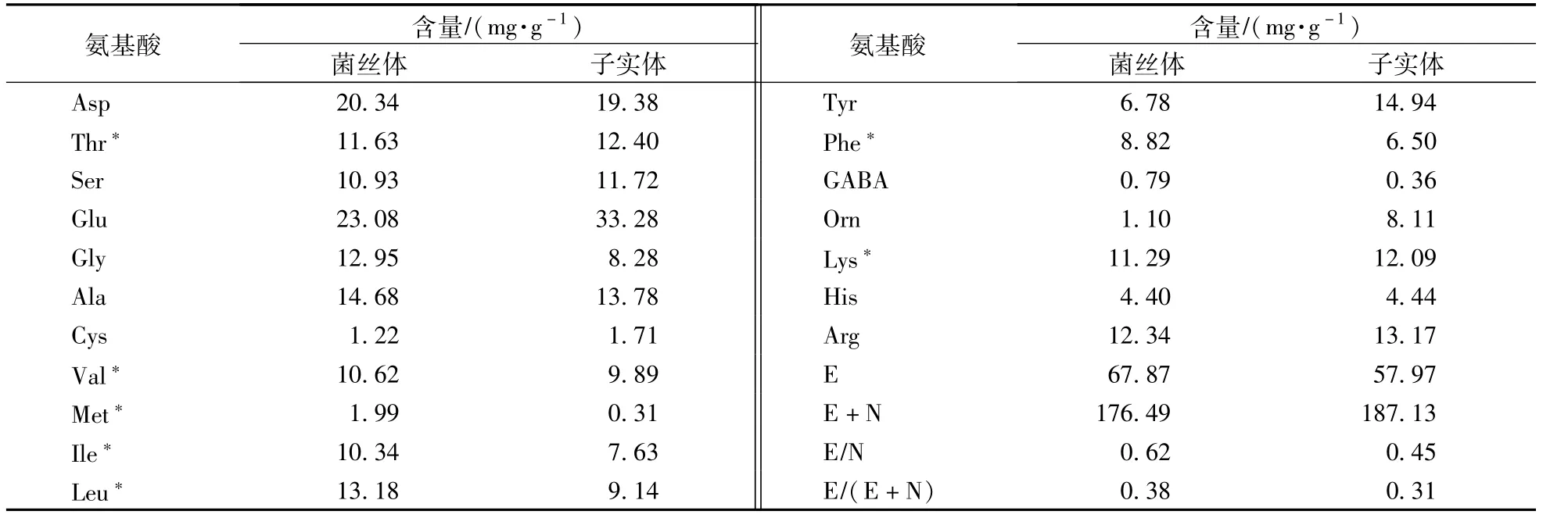
表5 氨基酸含量比较Table 5 Comparison of am ino acid contents
3 讨论
固体培养子实体比液体深层发酵经历的生理过程复杂,且周期长。液体发酵具有发菌速度快(周期短)、生产效率高并且成本低、污染率低等优点,发酵的液体培养基中会产生大量具有经济价值的菌丝体。虽然目前市场上蛹虫草的产品形式为固体培养得到子实体,但蛹虫草菌丝体也具有很高的开发和应用价值。本研究比较相同菌株通过固体培养获得的子实体和液体培养获得的菌丝体之间多糖、核苷、游离糖醇及小分子糖类、氨基酸组成方面的差别,发现子实体和菌丝体中这些活性成分有所差异,说明子实体和菌丝体的生物活性也不尽相同,在今后应用上也应区别对待,对蛹虫草是否可以作为子实体的替代品仍需做大量的研究工作。蛹虫草菌丝体虽然在多糖含量上高于子实体,但其单糖组成的摩尔分数及多糖分子质量分布不同。由于多糖的活性与其结构和分子质量有密切关系[23-24],因此需要对蛹虫草子实体和菌丝体中的多糖进一步分离纯化并对其生物活性进行研究,为今后蛹虫草多糖产品的开发应用奠定基础。蛹虫草子实体或发酵菌丝中核苷类化合物种类较多,虫草素是虫草属真菌中特有成分,该成分具有抗肿瘤、抗炎、免疫调节等多种生物活性[25],是蛹虫草中发挥药理作用的主要活性成分之一。除虫草素外,蛹虫草中的另一种核苷类成分N6-(2-羟乙基)-腺苷,具有较好的镇痛、Ca2+拮抗、抗肿瘤作用[26-27],它在蛹虫草子实体中的含量也较高,但在菌丝体中的含量很低,因此如果今后针对蛹虫草中N6-(2-羟乙基)-腺苷这一成分进行分离纯化和活性研究应选择蛹虫草子实体为原料。海藻糖在高温、高寒、高渗透压及干燥失水等恶劣环境条件下细胞表面能形成独特的保护膜,有效保护蛋白质分子不变性失活,从而维持生命体的生命过程和生物特征。这一独特的功能特性,使得海藻糖除了可以作为蛋白质药物、酶、疫苗和其他生物制品的优良活性保护剂以外,还是保持细胞活性、保湿类化妆品的重要成分,更可作为防止食品劣化、保持食品新鲜风味、提升食品品质的独特食品配料[28]。蛹虫草子实体中海藻糖含量高达20.07%,这为蛹虫草开发相关功能产品提供了有利的物质基础,而蛹虫草发酵菌丝体中游离糖醇组成和子实体不同,且其中甘露醇含量远远高于子实体中的,这其中的代谢转化都值得深入研究。此外,本研究中对蛹虫草子实体和菌丝体多糖的HPSEC图谱、核苷类成分HPLC图谱和游离糖醇小分子糖类成分的分析结果也可为今后蛹虫草两种不同产品形式的辨别提供一定的科学依据。

