大豆分离蛋白-杏鲍菇多糖共价结合物对RAW264.7细胞的免疫调节作用
吴怡亮,仲 磊,马 宁,裴 斐,马高兴,胡秋辉,*
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.南京农业大学食品科技学院,江苏 南京 210095)
免疫调节与各种生理和病理状况密切相关,如炎症、癌症和肿瘤的发生等[1]。作为人体内的一种重要防御,巨噬细胞释放的免疫介质在抗原入侵时发挥重要作用[2]。当人体受到病理或机械损伤刺激时,激活的巨噬细胞吞噬能力增强,可以产生一氧化氮(NO)并分泌肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)和IL-6等一系列细胞因子抵御病原体入侵,从而保护宿主免受病原体的侵害[3-6]。因此,巨噬细胞激活是宿主提高免疫能力的重要机制。随着人们健康意识的提高,膳食营养已经成为社会关注的焦点。作为传统主食,谷物在我国膳食系统中占有重要地位。其中,谷物蛋白资源丰富、价格低廉,具有改善心血管疾病、降低胆固醇水平和减少癌症发病率等生理功能,被广泛用于食品工业中[7-8]。
大豆是中国最重要的谷物粮食之一,大豆中的蛋白质含量高达40%左右,并且氨基酸组成全面,是优质植物蛋白的重要来源[9]。大豆分离蛋白(soybean protein isolate,SPI)是一种廉价、高营养的谷物蛋白,但较差的功能性质削弱了其生理活性[10-11]。杏鲍菇多糖(Pleurotus eryngii polysaccharide,PEP)是一种生物反应调节物,具有降血压、降血脂、抗炎症和抗肿瘤等生理功能[12-14]。此外,它能诱导巨噬细胞分泌细胞因子,增强细胞吞噬病原体的能力,从而实现机体免疫调节作用[15-17]。糖基化是一种基于美拉德反应的化学修饰方法,能使蛋白与糖类共价结合,从而改善蛋白质的功能性质和生物活性[18]。Jing等[19]利用美拉德反应制备了一种酪蛋白-葡萄糖共价结合物,与单一的酪蛋白或葡萄糖及两者的混合物相比,这种结合物的还原能力和自由基清除活性更强,具有出色的抗氧化活性。张小沛等[20]发现五味子叶多糖与氨基酸共价结合物的抗氧化能力与糖基化反应时间在一定范围内成正比。此外,研究表明,基于美拉德反应的蛋白-多糖共价结合物具有抑制肿瘤细胞增殖的作用[21]。在前期研究中,本课题组利用美拉德反应制备了一种大豆分离蛋白-杏鲍菇多糖共价结合物(soybean protein isolate-P. eryngii polysaccharide conjugate,W-PP),发现这种结合物具有较强的蛋白功能性质——乳化性、水溶性和热稳定性。然而,关于W-PP的生物活性——免疫调节作用还未深入研究。
小鼠巨噬细胞系RAW264.7是体外研究功能成分免疫调节作用的理想模型,本实验基于RAW264.7细胞,以脂多糖(lipopolysaccharides,LPS)为阳性对照,SPI、PEP和大豆分离蛋白-杏鲍菇多糖混合物(mixture of soybean protein isolate and P. eryngii polysaccharide,PP)为样品对照,研究W-PP对巨噬细胞的活力、中性红吞噬活性、NO释放量、细胞因子分泌及其mRNA表达的影响,进而评价这种共价结合物的免疫调节活性,以期为后续进一步的深入研究提供参考。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕 西亚化工有限公司;杏鲍菇超微粉 江苏芝庆堂生物科技有限公司;小鼠巨噬细胞系RAW264.7 上海瑞鹿生物科技有限公司复旦IBS细胞资源中心;RPMI1640 美国Gibco公司;0.25%胰蛋白酶、双抗(青、链霉素)、胎牛血清、LPS、二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)和1×磷酸盐缓冲液(phosphate buffered saline,PBS) 北京索莱宝公司;中性红试剂盒、NO检测试剂盒 上海碧云天生物技术有限公司;酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测试剂盒(TNF-α、IL-6、IL-1β) 南京建成生物工程研究所。
1.2 仪器与设备
SpectraMax-190酶标仪 美国Biorad公司;T18高速分散机 德国IKA公司;J-50气流粉碎机 意大利Tenologia Meccanica公司;Allegra 21R台式高速冷冻离心机美国Beckman公司;TP600型梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 日本Takara公司;Lightcycle K荧光定量PCR仪 杭州BIOER公司。
1.3 方法
1.3.1 SPI的提取
S P I制备工艺:低温脱脂豆粕打粉,2 0 0 目过筛得到低温脱脂豆粉。将豆粉和水按照1∶10(m/V)的比例溶解豆粕,用2 mol/L NaOH溶液调节pH值至8.0,常温搅拌2 h,离心(10 000×g、20 min、4 ℃)得到上清液,用2 mol/L HCl溶液调节pH值至4.5。在4 ℃下5 000 ×g离心5 min得到质量分数5%~10%干物质,再用2 mol/L NaOH溶液调节pH值至7.0,4 ℃透析24 h,冷冻干燥后得到自制SPI。
1.3.2 PEP的提取
取杏鲍菇超微粉,按液料比10∶1~50∶1(V/m)加入蒸馏水,在60~100 ℃水浴加热条件下浸提3 h。浸提液4 000 ×g离心20 min取上清液,然后采用Sevag试剂(V(三氯甲烷):V(正丁醇)=4∶1)法去上清液蛋白,离心(10 000×g、10 min)向上清液中加入4 倍体积无水乙醇,在4 ℃下沉淀过夜,4 500×g离心10 min取沉淀,冷冻干燥,得到样品PEP。
将SPI和PEP按照质量比1∶1混合得到大豆分离蛋白-杏鲍菇多糖混合组(PP)。
1.3.3 湿热法处理SPI和PEP
将前期制备好的SPI和PEP按照质量比1∶1混合并配成质量浓度为5 g/100 mL的溶液,磁力搅拌器混合均匀,在4 ℃下水化过夜。然后将样品置于80 ℃水浴锅中加热3 h,并在4 ℃条件下10 000×g离心10 min。取上清液,冷冻干燥,获得W-PP。于-20 ℃下贮存,待作进一步分析。
1.3.4 RAW264.7细胞培养
小鼠巨噬细胞系RAW264.7于RPMI1640完全培养液(含10%胎牛血清、100 U/mL链霉素和100 U/mL青霉素)中生长,细胞培养瓶置于37 ℃、5% CO2培养箱中培养。当细胞铺满培养瓶底部80%时进行传代,将培养至对数生长期的细胞用于后续实验。
1.3.5 MTT法检测细胞活力
采用MTT法[22]检测细胞活性。将对数生长期的RAW264.7细胞按照约1×106个/mL的密度接种于96 孔板中,100 μL/孔,置于CO2培养箱培养至80%细胞贴壁后,吸去旧培养基,设置不接种细胞的空白组,对照组加入100 μL完全培养液,样品组分别加入不同样品溶液各100 μL。其中,样品组包括不同质量浓度(0~400 μg/mL)的SPI、PEP、PP和W-PP溶液(以单纯的RPMI1640为溶剂配制),每组设置6 个复孔,24 h后弃去上清液,每孔加入30 μL MTT(5 mg/mL)工作液,继续培养4 h后弃去MTT工作液,每孔加入DMSO 100 μL,于摇床避光摇晃15 min,用酶标仪在570 nm波长处测定吸光度,实验重复3 次。按照下式计算细胞活力。
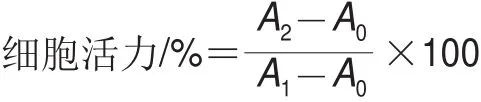
式中:A0为空白组吸光度;A1为对照组吸光度;A2为样品组吸光度。
1.3.6 中性红法检测细胞吞噬能力的测定
将RAW264.7细胞以1×106个/mL的密度接种于96 孔板中培养7 h,设置不含样品的空白对照组(200 μL的RPMI1640完全培养液)、LPS组(1 μg/mL,200 μL),并基于1.3.5节的实验结果设定细胞活力最佳的3 个质量浓度梯度(25、50、100 μg/mL,200 μL)的样品组(SPI、PEP、PP和W-PP)。培养12 h后,按照中性红试剂盒的操作方法,弃去上清液,每孔加入100 μL体积分数为0.075%中性红溶液染色,继续培养3 h弃去上清液,PBS洗涤3 次后每孔加入100 μL细胞裂解液,室温摇床裂解10 min,在540 nm波长处测定吸光度。
1.3.7 NO释放量的测定
取对数生长期的RAW264.7细胞,以1×106个/mL密度接种于96 孔板,每孔加100 μL细胞悬液,置于37 ℃恒温培养箱内,待80%以上细胞贴壁后,吸去完全培养液并用PBS清洗3 次。空白对照组加入200 μL的RPMI1640完全培养液,阳性对照组加入200 μL LPS溶液(1 μg/mL),样品组分别加入25、50、100 μg/mL的SPI、PEP、PP和W-PP溶液各200 μL,每组设6 个复孔,培养24 h后收集上清液,按照NO测定试剂盒的操作说明测定细胞NO释放量。
1.3.8 TNF-α、1L-1β和IL-6浓度的测定
取对数生长期的RAW264.7细胞,以1×106个/mL的密度接种于96 孔细胞培养板,每孔加100 μL细胞悬液,按1.3.7节中的方法处理各组后培养24 h,收集上清液,参照IL-6、1L-1β和TNF-α的ELISA试剂盒说明书步骤检测细胞上清液中各细胞因子的浓度。
1.3.9 TNF-α、1L-1β和IL-6的mRNA水平测定
取对数生长期的RAW264.7细胞,调整细胞悬液浓度为1×106个/mL,接种于6 孔板,每孔2 mL细胞悬液,置于37 ℃恒温培养箱内,待80%以上细胞贴壁后,吸去完全培养液并用PBS清洗3 次。空白对照组加入2 mL的RPMI1640完全培养液,LPS组加入2 mL LPS溶液(1 μg/mL),样品组分别加入2 mL 25、50、100 μg/mL的PEP和W-PP。细胞培养箱内培养24 h后,弃去上清液,用PBS洗涤细胞沉淀1 遍,收集细胞提取RNA。采用实时荧光PCR法测定细胞中TNF-α、1L-1β和IL-6的mRNA水平。具体操作步骤如下[23-24]。1)组织匀浆:向各样品中加入1 mL的TRIzol试剂,用移液器反复吹打;2)将上述匀浆液室温放置5 min,待核酸和蛋白充分解离。向匀浆液中加入0.2 mL氯仿,盖紧管盖,手动剧烈振摇15 s,然后室温静置2~3 min;3)4 ℃、10 000×g离心10 min;4)小心吸取上层水相(无色)加入到新试管中,同时记录所吸取的水相体积;5)加入所吸取水相等体积预冷的异丙醇,盖紧管盖,轻轻摇匀;6)室温静置10 min,待RNA充分沉淀;7)4 ℃、10 000×g离心10 min;8)将上清液弃除,保留沉淀,每管加入1 mL体积分数为75%乙醇溶液润洗,盖紧管盖,轻轻晃动离心管,以去除残留的异丙醇和盐分。4 ℃、7 500×g离心5 min;9)将上清液弃除,打开管盖,将RNA沉淀干燥(室温挥发或真空干燥)。注意RNA沉淀不可完全干燥,否则难以溶解;10)将RNA沉淀溶解于适量的无RNase水中。采用1%琼脂糖凝胶进行电泳,并用GelStain染色。
1.4 数据处理
使用SPSS 18.5软件进行单因素方差分析,实验结果用平均值±标准差表示,且P<0.05表示数据有显著性差异。
2 结果与分析
2.1 W-PP对RAW264.7细胞活力的影响

图1 SPI、PEP、PP和W-PP对RAW264.7细胞活力的影响Fig. 1 Effects of SPI, PEP, PP and W-PP on cell viability in RAW 264.7 cells
如图1所示,与空白对照组相比,不同样品对RAW264.7细胞的活力产生一定影响。当质量浓度为2~50 μg/mL时,SPI、PEP、PP和W-PP 4 种样品对细胞活力均无显著影响(P>0.05),表明4 种样品质量浓度在2~50 μg/mL时对细胞没有毒性。SPI、PEP、PP质量浓度为100~400 μg/mL,W-PP质量浓度为200~4 0 0 μ g/m L时,细胞活力呈显著降低的趋势(P<0.05),表明过高质量浓度的样品对细胞毒性较大,从而降低其活力[25]。因此,综合细胞活力实验结果,选择25、50 μg/mL和100 μg/mL这3 个质量浓度梯度对细胞进行后续实验处理,并在此质量浓度下,评价W-PP对RAW264.7细胞的免疫调节作用。
2.2 W-PP对RAW264.7细胞中性红吞噬活性的影响

图2 SPI、PEP、PP和W-PP对RAW264.7细胞中性红吞噬活性的影响Fig. 2 Effects of SPI, PEP, PP and W-PP on phagocytic activity in RAW264.7 cells
中性红法可以用来评价RAW264.7细胞的吞噬功能[26]。如图2所示,LPS组作为阳性对照,经LPS刺激后,RAW264.7细胞中性红吞噬能力显著加强(P<0.05)。随着质量浓度的上升,SPI对RAW264.7细胞的中性红吞噬能力无显著影响,PEP、PP的中性红吞噬活性在质量浓度为50、100 μg/mL时分别达到最大值。而W-PP对细胞中性红吞噬活性呈显著促进作用(P<0.05),在100 μg/mL质量浓度时中性红吞噬活性达到空白对照组的2.05 倍,说明糖基化SPI可以增强巨噬细胞对外来物质的吞噬作用,从而保护机体免受病原体侵蚀,提高机体免疫力。
2.3 W-PP对RAW264.7细胞NO浓度的影响

图3 SPI、PEP、PP、W-PP对RAW264.7细胞NO浓度的影响Fig. 3 Effects of SPI, PEP, PP and W-PP on the production of nitric oxide in RAW 264.7 cells
研究表明,巨噬细胞被激活后生成NO,并与超氧阴离子自由基反应形成过氧亚硝基阴离子,协助机体对抗外来抗原,实现免疫调节作用[27-28]。如图3所示,与空白对照组相比,RAW264.7细胞经LPS刺激后NO分泌量显著增加(P<0.05)。与空白对照组相比,SPI和PEP处理后细胞NO释放量无显著差异(P>0.05)。而当PP、W-PP在质量浓度为50 μg/mL和100 μg/mL时,NO释放量随着质量浓度的升高而上升,并且都在100 μg/mL时达到最大值,说明PP、W-PP样品在一定质量浓度下可激活并提高巨噬细胞RAW264.7分泌NO的能力。
2.4 W-PP对RAW264.7细胞TNF-α、IL-1β和IL-6质量浓度及其mRNA表达水平的影响


图4 SPI、PEP、PP、W-PP对RAW264.7细胞TNF-α(A)、IL-1β(B)和IL-6(C)分泌量的影响Fig. 4 Effects of SPI, PEP, PP and W-PP on the secretion of TNF-α (A),IL-1β (B) and IL-6 (C) in RAW 264.7 cells
RAW264.7细胞总RNA提取电泳结果如图5所示。LPS、PEP、W-PP各组RNA条带清晰,表明成功提取RNA。

图5 RAW264.7细胞总RNA提取电泳图Fig. 5 Electropherogram of total RNA extracts from RAW264.7 cells
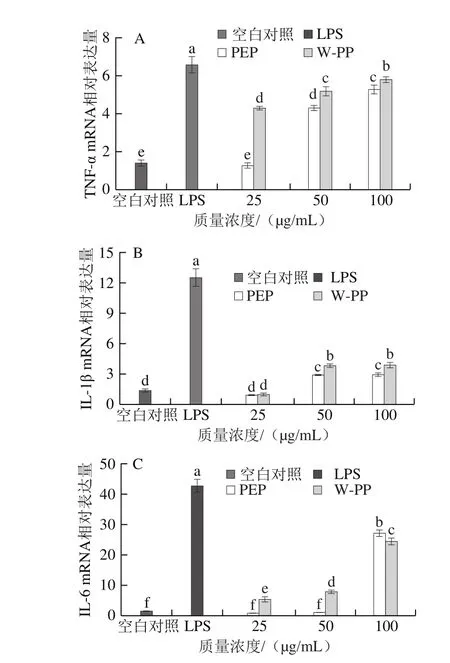
图6 PEP和W-PP对RAW264.7细胞TNF-α(A)、IL-1β(B)和IL-6(C) mRNA相对表达量的影响Fig. 6 Effects of PEP and W-PP on gene expression of TNF-α (A),IL-1β (B) and IL-6 (C) in RAW 264.7 cells
巨噬细胞受到刺激后会产生细胞因子,它是一类具有调控免疫系统、细胞生长和损伤组织修复等功能的小分子可溶性蛋白[29-31]。巨噬细胞被激活后可以分泌白细胞介素和肿瘤坏死因子传导并调控免疫通路[32]。如图4所示,与空白对照组相比,LPS组的TNF-α、IL-1β和IL-6质量浓度显著上升。与空白对照组相比,SPI和PP对细胞因子分泌量没有显著影响(P>0.05),而PEP在较高质量浓度下对TNF-α(>50 μg/mL)和IL-1β、IL-6(>100 μg/mL)的质量浓度具有显著促进作用。PEP组的TNF-α、IL-1β和IL-6质量浓度较PP组更高,说明在高质量浓度下PEP对细胞因子的分泌有促进作用。W-PP对RAW264.7细胞因子分泌具有较强的促进作用且存在剂量依赖效应,质量浓度为100 μg/mL时表现出最佳的免疫调节活性(P<0.05)。此外,与空白对照组相比,在一定质量浓度下PEP和W-PP均能显著提高IL-1β、IL-6和TNF-α的mRNA相对表达量,且存在剂量依赖效应(图6),其中共价结合物上调细胞因子表达的能力最强。
在非炎症巨噬细胞模型中,细胞因子的分泌水平可以作为评估免疫激活和调节能力的指标[33]。其中,白细胞介素(IL-1β和IL-6)和TNF-α能够辅助机体清除外源性抗原和异常细胞,并与T细胞协同作用,调节机体免疫应答[34-35]。与W-PP相比,单一的SPI及其与PEP的混合物在培养液中的溶解度较低,导致它们在细胞中的转运吸收效率下降,影响其免疫调节作用。此外,美拉德反应引入的PEP稳定了SPI的空间结构,糖链的引入提高了SPI的溶解性和抗氧化活性,从而增强巨噬细胞的免疫调节作用[36-38]。由此可知,W-PP能通过提高RAW264.7细胞的IL-1β、IL-6和TNF-α的分泌量及其mRNA表达水平来实现免疫调节作用。
3 结 论
本实验研究了W-PP对RAW264.7细胞活力、中性红吞噬活性、NO释放量、细胞因子分泌及其mRNA表达水平的影响。结果表明,W-PP在25~100 μg/mL范围变化时,能显著增强RAW264.7细胞中性红吞噬能力、NO释放量和细胞因子(IL-1β、IL-6和TNF-α)质量浓度。此外,PEP和W-PP能显著提高这3 种细胞因子的mRNA水平,其中100 μg/mL W-PP对细胞因子mRNA水平的上调作用最强。由此可得,W-PP具有较强的免疫调节作用,说明糖基化反应可以增强SPI的生物活性。

