安徽地区腹泻患者感染肠致病大肠埃希氏菌的耐药特征
李 春, 俞俊岭
致泻大肠埃希氏菌是我国腹泻病门诊重要病原菌之一。张子科等[1]统计2012-2015年在我国27省(直辖市、自治区)170家医院门、急诊4万多例腹泻患者中致泻大肠埃希氏菌的总检出率为7.7%,且各地区也存在着差异,其中安徽、浙江、江苏和河南等地的检出率>10.5%。流行菌型以EAEC、EPEC和ETEC为主,不同地区,不同年龄人群、不同季节的流行特征存在差异。
我国关于致泻大肠埃希氏菌的药敏监测及耐药情况的分析较少,关于耐药机制的研究就更为稀少。其耐药状况也不容忽视,石挺丽等人[2]2016年报道过广州地区腹泻儿童和健康儿童分离出的DEC耐药及多重耐药率较高,其中多重耐药率高达50.5%。本次研究主要针对安徽省近5年来临床分离EPEC的药敏检测结果及耐药机制进行研究分析。EPEC的检出率占DEC的第2位,由于EPEC的致病性较强,流行较广,作为本次重点研究对象。
1 材料与方法
1.1 材 料
1.1.1菌株来源 2013年1月至2017年12月,从安徽省7个地市10家哨点医院6 000例临床腹泻患者粪便标本中分离出的致泻大肠埃希氏菌331株。
1.1.2主要仪器与试剂 VITECK-2(生物梅里埃公司),ABI7500(AB公司),DNA扩增仪 (PTC-200)为MJ公司产品(U.S.A.),凝胶成像仪Gel-DocXR为Bio-RAD公司产品(U.S.A.),5种致泻大肠埃希氏菌多重实时荧光PCR检测试剂盒购自硕士生物科技股份有限公司和卓成惠生生物技术有限公司(A2418),GoTaq®Green Master Mix (Promega公司)。Thermo Scientific SensititreTM革兰氏阴性菌MIC药敏板。
1.2 方 法
1.2.1菌株鉴定分型。
1.2.1.1DNA模板的制备 挑取 5 个以上大肠埃希氏菌可疑菌落分别接种 TSI和营养琼脂,置于36 ℃培养 18 h。刮取营养琼脂平板上的过夜新鲜培养物 1~2 环,至装有1 mL 0.85%灭菌生理盐水的 Eppendorf 管内,混匀。4 ℃,12 000 r/min 离心 15 min,弃去上清。沉淀加入 500 μL 灭菌去离子水中,混匀。100 ℃煮沸 10 min,12 000 r/min 离心 5 min,上清即为 PCR 扩增模板。
1.2.1.2多重实时荧光PCR检测 配制25 μL 反应体系,使用ABI 7500 PCR仪进行检测,荧光PCR循环条件:95 ℃,15 min;(95 ℃,10 s;55 ℃,40 s/采集荧光),共40个循环。
1.2.1.3结果分析与判定 EPEC结果判定:FAM、VIC、ROX和CY5荧光通道出现S型曲线且Ct≤30为阳性结果,毒力基因escV、bfp和内参基因uidA阳性,判定为典型EPEC,毒力基因escV和内参基因uidA阳性,判定为非典型EPEC[3]。
1.2.2艾伯特埃希氏菌鉴定 艾伯特埃希氏菌escV或eae阳性、 不发酵乳糖、 不发酵木糖、 动力阴性。同时携带特异管家基因clpX、lysP和mdh。
1.2.2.1生化检测 将疑似菌株接种麦康凯培养基于36 ℃,培养18 h,进行乳糖发酵试验筛查,同时接种MIU 做动力试验。选GN卡 用VITECK-2进行生化试验,做蔗糖和木糖发酵试验。
1.2.2.2多重PCR检测 采用clpX、lysP和mdh建立的多重PCR检测方法, 对实验菌株和对照菌株进行检测[4]。反应条件:预变性 94 ℃ 5 min,变性94 ℃ 30 s, 退火58 ℃ 30 s, 延伸72 ℃ 30 s, 35次循环, 最后72 ℃总延伸5 min。PCR反应体系:在25 μL 体系中, 2×Taq MasterMix 12.5 μL, 10 μmol/L上、 下游引物各 1 μL, DNA 模板 1 μL, 去离子水9.5 μL。
1.2.3药敏检测 采用微量肉汤稀释法,方法参照CLSI-2017。质控菌株:ATCC 25922和ATCC 35218。
1.2.3.1挑取新鲜纯菌落3~5个,用 4 mL 无菌生理盐水充分混匀,调整菌悬液浓度至 0.5 麦氏单位,细菌浓度约为 1.5×108CFU/mL。取 50 μL 稀释于 10 mL CAMHB肉汤中,充分混匀,15 min 内使用。
1.2.3.2将制备好的菌悬液加至1 个无菌平皿中。每块 96 孔药敏板对应一株待测菌。用多道移液器向96 孔药敏板中加入菌悬液,每孔 100 μL。将接种后的 96 孔药敏板加盖,置于湿盒中,36 ℃培养 18 h,读取MIC值。
1.2.4超广谱β内酰胺酶(ESBLs)检测 方法参照CLSI-2017,用无菌蒸馏水配成0.5 OD值菌悬液,均匀涂抹在MH平皿上,待干燥后,将头孢他定(30 μg)、头孢他啶-克拉维酸(30/10 μg)、头孢噻肟(30 μg)、头孢噻肟-克拉维酸(30/10μg)按要求贴在平皿上,36 ℃培养 18 h。结果判定参照Table 3A。
1.2.5超广谱β内酰胺酶基因型检测TEM、SHV和CTX-Mgroup1、CTX-Mgroup2、CTX-Mgroup9、CTX-Mgroup8/25分别采用多重PCR进行检测,引物序列参照下表1,具体方法参照文献进行[5]。
1.2.6喹诺酮类耐药基因检测qnrA、qnrB和qnrS采用多重PCR进行检测,aac-(6′)-Ib-cr、qepA、oqxAB采用普通PCR单个扩增,上述5种基因PCR产物测序后在GENEBAN 进行比对确认。gyrA和parC基因PCR产物测序后用DNAMAN 8软件进行比对分析,查找基因突变位点及对应的氨基酸改变。所用的引物序列参照下表2。
表1 检测ESBLs基因型的多重PCR引物
Tab.1 Multiplex PCR-specific primers for ESBLs gene detection
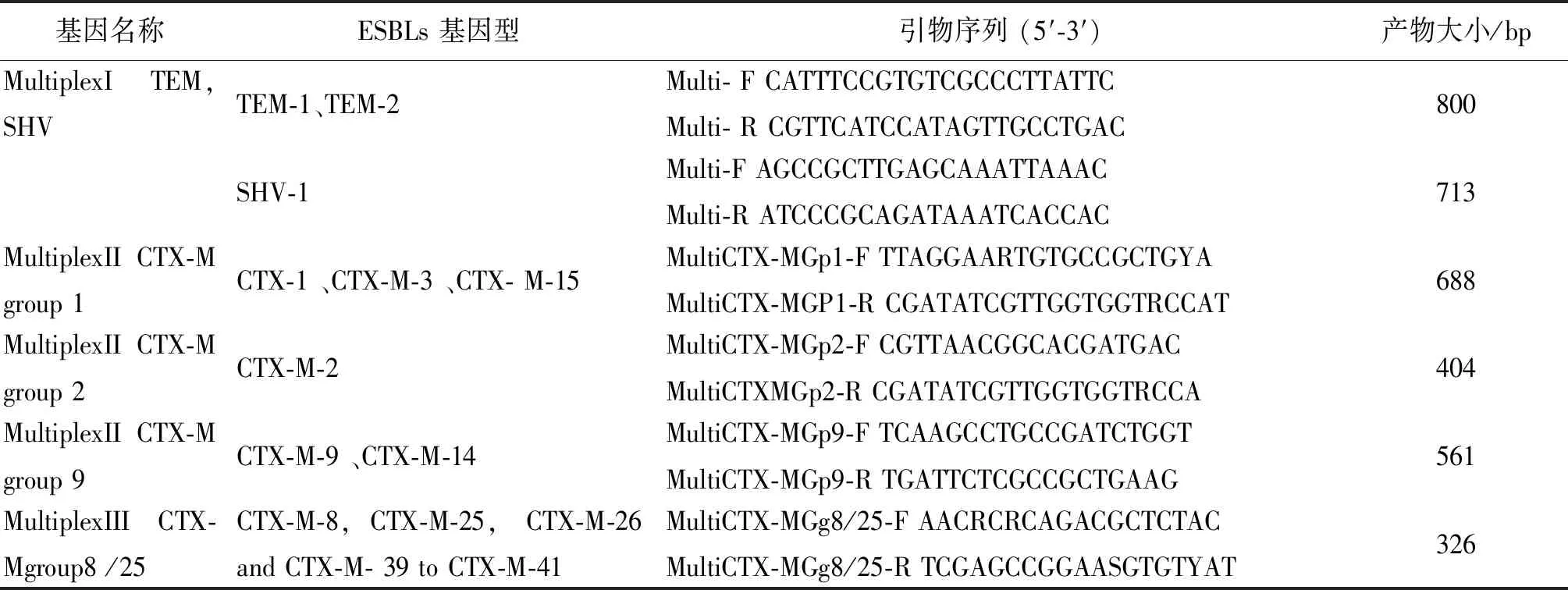
基因名称ESBLs 基因型引物序列 (5′-3′)产物大小/bpMultiplexI TEM,SHVTEM-1、TEM-2Multi- F CATTTCCGTGTCGCCCTTATTCMulti- R CGTTCATCCATAGTTGCCTGAC800SHV-1Multi-F AGCCGCTTGAGCAAATTAAACMulti-R ATCCCGCAGATAAATCACCAC713MultiplexII CTX-M group 1CTX-1 、CTX-M-3 、CTX- M-15MultiCTX-MGp1-F TTAGGAARTGTGCCGCTGYAMultiCTX-MGP1-R CGATATCGTTGGTGGTRCCAT688MultiplexII CTX-M group 2CTX-M-2MultiCTX-MGp2-F CGTTAACGGCACGATGACMultiCTXMGp2-R CGATATCGTTGGTGGTRCCA404MultiplexII CTX-M group 9CTX-M-9 、CTX-M-14MultiCTX-MGp9-F TCAAGCCTGCCGATCTGGTMultiCTX-MGp9-R TGATTCTCGCCGCTGAAG561MultiplexIII CTX-Mgroup8 /25CTX-M-8,CTX-M-25, CTX-M-26 and CTX-M- 39 to CTX-M-41MultiCTX-MGg8/25-F AACRCRCAGACGCTCTACMultiCTX-MGg8/25-R TCGAGCCGGAASGTGTYAT326
表2 检测喹诺酮类耐药基因的PCR引物
Tab.2 PCR Primers for Quinolones resistance genes

基因名称引物序列产物大小/bp参考文献gyrA-F5′ AAATCTGCCCGTGTCGTTGGT 3′343[6]gyrA-R5′ GCCATACCTACGGCGATACC 3′parC-F5′ AAACCTGTTCAGCGCCGCATT 3′395[6]parC-R5′ GTGGTGCCGTTAAGCAAA 3′aac(6′)Ib-cr-F5′ TTGCGATGCTCTATGAGTGGCTA 3′482[7]aac(6′)Ib-cr-R5′ CTCGAATGCCTGGCGTGTTT 3′qnrA-F5′ AGAGGATTTCTCACGCCAGG 3′580[8]qnrA-R5′ TGCCAGGCACAGATCTTGAC 3′ qnrB-F5′ GGMATHGAAATTCGCCACTG 3′264[8]qnrB-R5′ TTTGCYGYYCGCCAGTCGAA 3′qnrS-F5′ GCAAGTTCATTGAACAGGGT 3′428[8]qnrS-R5′ TCTAAACCGTCGAGTTCGGCG 3′ qepA-F5′ CGTGTTGCTGGAGTTCTTC 3′403[9]qepA-R5′ CTGCAGGTACTGCGTCATG 3′oqxA-F5′ CTCGGCGCGATGATGCT 3′392[10]oqxA-R5′ CCACTCTTCACGGGAGACGA 3′oqxBs5′ TTCTCCCCCGGCGGGAAGTAC 3′512[10]oqxBa25′ CTCGGCCATTTTGGCGCGTA 3′
2 结 果
2.1检测结果 从331株致泻大肠埃希氏菌中检出非典型EPEC 85株,典型EPEC 1株,艾伯特埃希氏菌1株。10家哨点医院统计数据显示EPEC在腹泻患者中的检出率为1.4%(86/6 000),EPEC占致泻大肠埃希氏菌的26.0%(86/331)。艾伯特埃希氏菌分离自马鞍山市第二人民医院。
2.2药敏结果 87株致病菌对氨苄西林、四环素和红霉素耐药率均超过50%,对亚胺培南、头孢他定、头孢西丁和环丙沙星耐药率均在10%以下,头孢噻肟的耐药率为20.7%。其中对环丙沙星耐药7株,中介耐药1株,耐药率达6.9%,全部为非典型EPEC。见图1。
2.387株致病菌中检测出产ESBLs 18株,检出率为20.7%,其中头孢噻肟/克拉维酸抑菌圈直径比头孢噻肟≥5 mm 14株,头孢他啶/克拉维酸抑菌圈直径比头孢他啶≥5 mm 1株,两者同时阳性是3株。
2.4超广谱β内酰胺酶基因检测结果 临床分离的18株产ESBLs肠致病大肠埃希氏菌检测出的基因型以TEM和CTX-Mgroup9型为主,其次是CTX-Mgroup1型,SHV未检出,见表3。
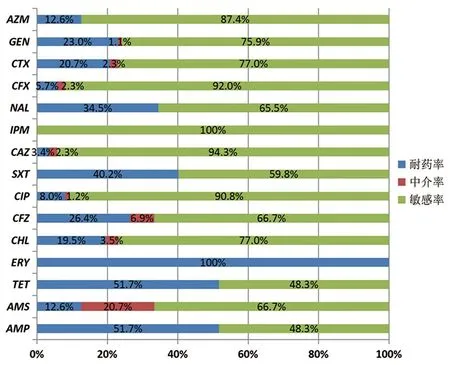
图1 87株分离菌药敏测试结果Fig.1 Drug sensitivity results of 87 isolates
表3 ESBLs耐药基因型检测结果
Tab.3 Results of ESBLs resistance genes

序列号TEMSHVCTX-M group 1CTX-M group 2CTX-M group 8/25CTX-M group 9菌株数1+-----32--+---33-----+14+-+---35+--+--16+---+-17+----+58+---++1合计140612718
2.5喹诺酮类耐药基因检测结果 根据药敏结果从87株菌中筛出7株对环丙沙星耐药,1株中介。这8株菌对萘啶酸100%耐药。8株菌中有7株出现gyrA基因突变,第248位碱基C突变为T,对应第83位氨基酸Ser替换为Leu,7株中有3株同时出现第259位碱基G突变为A,对应第87位氨基酸Asp替换为Asn。有3株出现parC基因突变,第241位碱基G突变为T,对应第80位氨基酸Ser替换为Ile。质粒介导的耐药基因qnrB阳性2株,qnrS阳性3株,aac(6′)-Ib阳性1株,其中qnrS和aac(6′)-Ib同时阳性1株。药物外排泵基因qepA和oqxAB阳性各1株。7株菌同时出现以上2种甚至是3种耐药机制并存, 1株以上3种耐药机制均阴性。各株菌的耐药机制详见表4。
表4 喹诺酮类耐药基因检测结果
Tab.4 Results of Quinolone resistance genes

CIPqnrAqnrBqnrSaac(6′)-IbqepAoqxA/BgyrAparC氨基酸突变基因突变氨基酸突变基因突变4-+----S-83→LTCG-248→TTG8-+----S-83→LD-87→NTCG-248→TTGGAC-259→AACS-80→IAGC-241→ATC4--+--+S-83→LTCG-248→TTG8------>8----+-S-83→LD-87→NTCG-248→TTGGAC-259→AACS-80→IAGC-241→ATC2------S-83→LTCG-248→TTG8--+---S-83→LTCG-248→TTGS-80→IAGC-241→ATC8--++--S-83→LD-87→NTCG-248→TTGGAC-259→AAC
注:环丙沙星(CIP)R≥4,I=2,S≤1;S(Ser):丝氨酸,L(Leu):亮氨酸,D(Asp)天冬氨酸:,N(Asn):天冬酰胺,I(Ile):异亮氨酸。带下划线的碱基为突变碱基。
3 讨 论
10家哨点医院近5年的监测数据显示EPEC是本地区引起腹泻病的重要肠道致病菌之一。此次分离出艾伯特埃希氏菌1株,国外相关研究显示艾伯特埃希氏菌与胃肠道疾病存在相关性,是一种重要的潜在食源性病原菌,在家畜、家禽和野生鸟类等动物宿主中广泛存在[11-12]。由于该菌易误诊为EHEC、EPEC或其他肠道致病菌,造成对该类菌株流行情况、致病性及临床意义等认识的低估和忽视。此次发现证实了安徽地区存在伯特埃希菌对人的感染和发病。
本研究主要是对临床分离的EPEC进行药敏试验及耐药机制检测,主要涉及ESBLs及基因型的检测分析和喹诺酮类耐药基因的检测分析。目前关于本地区EPEC耐药情况的文献较少,从本次药敏试验的结果来看虽然对头孢类和喹诺酮类保持较高的敏感性,但有部分菌株出现多重耐药现象,对氨苄西林/舒巴坦、头孢唑林和阿奇霉素呈现耐药性增强的趋势。国内外对大肠埃希氏菌的耐药性监测和研究的比较多,但对致泻大肠埃希氏菌耐药性监测报道的较少,因为该致病菌的分离鉴定比较困难,在临床上很容易被漏诊或误诊。本研究开展EPEC药敏监测和耐药性检测分析具有一定的临床参考价值,尤其是对于感染防控具有重要指导意义。
从AMS和AMP药敏结果的比较来看,加酶抑制剂的抗生素能够明显降低检测菌株的耐药率,说明产生青霉素或头孢菌素类的水解酶是产生耐药的主要机制之一。ESBLs检测结果证实了以上判断,18株对头孢噻肟或头孢他啶耐药的菌株100%产ESBLs。本地区分离的DEC产生的ESBLs的基因型以TEM(TEM-1、TEM-2)和CTX-Mgroup9 (CTX-M-9 、CTX-M-14)为主,其次是CTX-Mgroup1(CTX-M-1、CTX-M-3、CTX-M-15),具体分型需要后续基因测序比对分析。Yong Huang等报道[13]中国华南地区儿童腹泻患者分离的EPEC检出的 ESBLs基因型是TEM、CTX-M-1和CTX-M-9。区别是他们检出了SHV而本地区未检出。据悉CTX-M型ESBLs广泛分布在世界各地,并呈快速传播趋势[14-16],希望能够通过本课题的研究了解安徽地区临床分离的EPEC产ESBLs的状况,能有效的预防和控制耐药克隆株的传播。
研究已发现gyrA、parC基因突变位点集中发生在 N 端核苷酸序列为199~318的区间内,即所谓氟喹诺酮耐药决定区(QRDR)[17],本次试验有7株EPEC对喹诺酮类耐药性的产生与QRDR突变有关。其中gyrA的突变发生在第248位碱基C→T,对应的氨基酸改变为Ser-83→Leu,第259位碱基G→A,对应的氨基酸改变为Asp-87→Asn。parC的突变发生在第241位碱基G→T, 对应的氨基酸改变为Ser-80→Ile。检测结果与国外文献报道相吻合[6,18]。证实本地区临床分离的EPEC对喹诺酮类耐药与药物靶位及编码基因的突变相关,主要体现在DNA促旋酶GyrA亚基和DNA拓扑异构酶Ⅳ ParC亚单位的基因突变。
本次试验质粒介导氟喹诺酮类耐药以Qnr蛋白家族中的QnrB和QnrS为主,少数菌株aac-(6′)-Ib-cr基因和药物外排泵基因(qepA、oqxAB)阳性。提示本地区临床分离的EPEC对喹诺酮类耐药不单是药物靶位及编码基因突变的作用,其中质粒介导的耐药机制和药物外排泵机制也在分离菌株中被证实,本次分离的耐药株几乎是药物靶位及编码基因的突变、质粒介导的耐药和药物外排泵这3种机制中的2种甚至3种共同作用的结果。其中有1株菌以上3种耐药机制全部为阴性,其耐药机制需要进一步研究。喹诺酮类药物是临床治疗细菌性腹泻的首选药物,其耐药率的变化需要监测,耐药机制需要进一步的研究分析。
利益冲突:无

