膜联蛋白A8 在小鼠早期妊娠子宫中表达研究
任 杰,崔云凤,于浩楠,吴 浩,倪 华
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
胎生哺乳动物在正常生理状态下,胚泡植入母体子宫进行下一步的发育生长,即胚胎着床。胚胎着床过程对于妊娠能否顺利进行至关重要,成功的胚胎着床依赖于同步发育的子宫和胚胎之间精确的相互作用[1]。畜牧动物繁殖性能的高低是影响养殖行业发展的重要瓶颈,胚胎着床率低是动物繁殖力低下的主要原因之一。胚胎工程技术中,体外操作过的胚胎着床和发育到期比率更低。因此,关于胚胎着床机制的研究具有理论意义和潜在的经济价值。
膜联蛋白-A8(Annexin A8,ANXA8)属于膜联蛋白超家族(Annexins)[2]。目前,在高等脊椎动物中发现至少12 种膜联蛋白,它们可以钙依赖性方式与阴离子磷脂结合,介导某些特定蛋白分子在膜上的定位,从而调节这些蛋白的功能[3-4]。ANXA1[5]、ANXA2[6]、ANXA4[7]被证明与人和小鼠胚胎着床相关。ANXA8 与多种癌症发生有关,ANXA8 是口腔鳞状细胞癌检测的分子标记物[8];ANXA8 是胰腺癌中过表达的4 种基因之一[9];ANXA8 在子宫鳞状细胞癌中显著上调[10];ANXA8 的表达对乳腺癌细胞的生存有显著影响[11]。ANXA8 与小鼠视网膜上皮细胞的分化有关[12]。在猪子宫内膜细胞中,ANXA8 可上调着床关键因子(Leukemia Inhibitory Factor,LIF)的mRNA 表达,提示ANXA8可能通过调节LIF 影响猪的胚胎着床[13],受实验动物和实验手段的限制,这部分工作是在体外培养细胞中进行,关于ANXA8 在小鼠和其他动物围着床期子宫中的表达和作用机制尚无报道。由于小鼠是模式动物,具有研究胚胎着床的体内模型和体外细胞模型,便于深入开展ANXA8 研究。本研究采用原位杂交、实时荧光定量PCR、免疫组织化学的方法,从RNA 和蛋白水平检验ANXA8 在小鼠早期妊娠胚胎着床中的表达,在体外培养的小鼠基质细胞及诱导蜕膜中,研究ANXA8 的作用,为阐明ANXA8 在动物胚胎着床中的作用机制提供实验依据,为研究ANXA8 在大动物胚胎着床中的机制提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 实验动物为C57BL/6J 品系小鼠。小鼠于人工控制条件下饲养,室温为19~23℃,光照周期分为光照黑暗各12 h,自由采食和饮水,定期更换垫料、添补食物和水。
1.2 实验动物模型
1.2.1 早期妊娠 将自然发情的成年雌鼠与成年可育雄鼠按2:1 合笼。次日早晨检查发现阴道栓记为妊娠第1天,分别于每天09:00 收集小鼠妊娠第1~8 天子宫。收集小鼠妊娠第2~4 天子宫时,须从输卵管或子宫中冲出胚胎以确定妊娠。收集小鼠妊娠第5 天子宫时,尾静脉注射1%的芝加哥蓝以确定着床位点。将子宫切成适当大小,一部分组织经液氮速冻后放入-80℃冰箱冻存。另一部分用固定液固定进行石蜡包埋处理。
1.2.2 人工诱导蜕膜化 雌鼠在假孕第4 天上午,在小鼠右侧子宫靠近输卵管的部分注射芝麻油25 μL 诱导蜕膜化,另一侧不注射,作为对照。在假孕第8 天上午处死小鼠,按以上方法取子宫角。利用形态变化及称重来分辨是否发生蜕膜化,取材方法同上。
1.3 实验方法
1.3.1 小鼠 ANXA8 基因片段克隆及探针的制备 根据GenBank 相关序列设计小鼠ANXA8 基因的上、下游引物(上游引物:5'-GCGGGTGAGAAGATTATGGGA-3';下 游 引 物:5'-AAGTAGCTGTGGACGTTCCG -3'),以小鼠子宫 cDNA 为模板进行PCR 扩增,使用Magen凝胶回收试剂盒纯化产物。将回收的产物与pGEM-T载体连接,连接产物转化到DH5α 感受态细胞中,挑取单菌落进行摇菌,得到的菌液送交哈尔滨博仕生物技术有限公司进行测序,将测序结果进行BLAST 同源性比对,将测序正确的ANXA8 基因片段,利用Roche 公司的地高辛标记试剂盒进行探针标记。
1.3.2 原位杂交 将10 µm 冰冻切片放入4% 多聚甲醛(PFA,pH 9~10)中固定1 h,1% TritonX-100 溶液处理切片20 min 后室温下预杂交15 min(5×SSC,50%甲酰胺)。弃去预杂交液,后滴加杂交液(5×SSC,50%甲酰胺,0.02% BSA,10%硫酸葡聚糖,1 mg/mL变性的地高辛标记的ANXA8 RN 探针)于55℃杂交24 h。将切片分别在含有50% 甲酰胺和5×SSC、2×SSC、0.2×SSC 的溶液中55℃摇床洗涤15、30、30 min,再将切片放入0.2×SSC 溶液中,于室温下静置洗涤5 min。经缓冲液Ⅰ(100 mmol/L Tris-Cl,150 mmol/L NaCl,pH 7.5)平衡5 min 后在1% Blocking solution 中封闭1 h,封闭后加碱性磷酸标记的地高辛抗体(1:5 000;Roche)4℃孵育过夜。切片洗涤后,再滴加显色液(0.4 mmol/L 5-溴-4-氯-3- 吲哚磷酸,0.4 mmol/L 硝基四唑氮蓝和2 mmol/L 左旋咪唑),避光显色过夜,出现阳性信号后,停止显色。1%甲基绿复染,显微镜下观察并拍照。
1.3.3 实时荧光定量PCR 取小鼠子宫组织50~100 mg,提取组织总RNA,并将总RNA 反转录为cDNA,以cDNA为模板进行PCR,ANXA8(序列号:NM-013473.4)引物序列:上游引物5'-GCGGGTGAGAAGATTATGGGA-3',下游引物5'-AAGTAGCTGTGGACGACGTTCCG-3',由哈尔滨博仕生物公司合成。反应体系10 µL:SYBR Premix Ex Taq(2×)5 μL,Rox ReferenceDye Ⅱ 0.2 μL,上游引物0.2 μL(10 μmol/L),下游引物0.2 μL(10 μmol/L), RNA 4.4 μL (8.8 μmol/L)。反应条件:95℃30 s;95℃5 s、60℃30 s,40 个循环后收集荧光信号。使用 Amplied Biosystems®7500 Real-Time PCR System 操作,由仪器自动绘制熔解曲线,采用 2-ΔΔCt法计算目的基因相对表达量。
1.3.4 免疫组织化学 取得小鼠子宫组织,固定包埋后,切成5 µm 厚的切片。切片脱蜡至蒸馏水,0.01%柠檬酸缓冲液修复、3% H2O2阻断内源性过氧化酶、10%马血清封闭后,加入Annexin Ⅷ Rabbit polyclonal antibody(1:80,proteintech),4℃过夜。用辣根过氧化物酶标记的山羊抗兔抗体(1:200,ab6721,abcam),37℃孵育90 min。DAB 显色剂显色,苏木精染色液复染,脱水,封片,显微镜下观察并拍照。
1.3.5 统计分析 荧光定量PCR 实验的数据结果都通过 t 检验进行评估,定量结果按x±s 的形式由 Graphpad Prism 软件进行绘图处理,并用 2-ΔΔCt进行数据分析。
1.3.6 原代小鼠子宫内膜基质细胞的培养和诱导蜕膜化处理 将妊娠第4 天小鼠的子宫角纵向切开,用HBSS(含P/S)(Gibco)彻底洗涤后,将子宫组织置于含有1%胰蛋白酶(Sigma)的HBSS(含P/S)中,4℃下1 h,室温下15 min,37℃下15 min,轻轻摇动装有小鼠子宫组织的三角瓶以移除上皮细胞,弃去含有上皮细胞的上清液后,用HBSS(含P/S)冲洗剩余的组织3 次,并在含有0.5 mg/mL 胶原酶Ⅱ(Biotopped)的HBSS(含P/S)中37℃温育30 min,将消化的子宫剧烈摇动直至上清液混浊。然后将上清过滤后,在1 000 r/min 离心5 min。细胞沉淀用HBSS(含P/S)洗涤2 次,并重悬于由DMEM/F-12(Sigma)和10% 活性炭吸附过的胎牛血清组成的完全培养基中;1×106个细胞接种到35 mm 直径培养盘中,培养30 min 后,更换培养基以除去游离的漂浮细胞,在37℃、5%CO2条件下培养[14]。
小鼠基质细胞长到70%~80%时开始诱导蜕膜化,更换新鲜培养液,加入10 nmol/L 雌激素(Sigma)和1 μmol/L 孕酮(Sigma),对照组中按体积比1:1 000加入无水乙醇。分别收集处理后24、48、72 h 的细胞及对照细胞,提取RNA。蜕膜化标志分子采用小鼠蜕膜催乳素相关蛋白(Decidual Prolactin-related Protein, Dtprp),实时荧光定量PCR 检测DTPRP 和ANXA8 mRNA 的表达。
2 结 果
2.1 ANXA8 mRNA 在早期妊娠第1~8 天与人工蜕膜化子宫中的表达 原位杂交结果表明,ANXA8 mRNA 在小鼠早期妊娠第1~4 天子宫腔上皮和腺上皮有微弱表达(图1-A~D)。随着妊娠的进行,胚胎在第4 天子夜着床,并且在着床位点周围形成初级蜕膜区。ANXA8 mRNA在第5、6 天的初级蜕膜区(图1-E、F)表达,随后初级蜕膜区的基质细胞继续增殖分化成次级蜕膜区,ANXA8 mRNA 在第7、8 天的次级蜕膜区(图1-G、H)表达,并逐渐增强。人工蜕膜化模型中ANXA8 mRNA表达在蜕膜区(图1-I)。
2.2 ANXA8 蛋白在早期妊娠与人工蜕膜化子宫中的表达 免疫组织化学结果显示,早期妊娠第1~4 天的腔上皮和腺上皮有ANXA8 蛋白表达(图2-A~D),早期妊娠第5~8 天中ANXA8 蛋白表达方式与mRNA 类似,第5、6 天初级蜕膜区(图2-E、F)与第7、8 天的次级蜕膜区(图2-G、H)有表达;在人工蜕膜化模型中,对照一侧子宫腔上皮和腺上皮(图2-J)检测到ANXA8 蛋白的存在,人工蜕膜子宫的蜕膜区(图2-I)有ANXA8 蛋白表达。
2.3 ANXA8 mRNA 在体外诱导蜕膜化小鼠子宫基质细胞中的表达 随着诱导时间的增加,蜕膜化标志分子DTPRP 的表达逐渐升高,并显著高于对照组,表明诱导蜕膜化成功( 图3-A)。随着诱导时间的增加,ANXA8 的表达逐渐升高,并显著高于对照组(图3-B)。

图1 ANXA8 在早期妊娠与人工蜕膜化子宫中的mRNA 表达
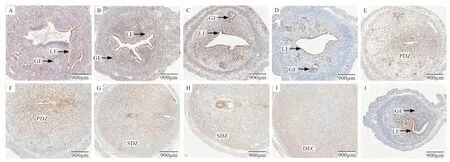
图2 ANXA8 在小鼠早期妊娠与人工蜕膜化子宫中的蛋白表达

图3 ANXA8 在体外诱导蜕膜化小鼠子宫基质细胞中的mRNA 表达
3 讨 论
Jiang 等[13]研究发现,ANXA8 在妊娠第11~13 天的猪子宫内膜细胞中的表达水平较高。在培养的猪子宫内膜细胞中,过表达ANXA8 会上调LIF 和表皮生长因子(Epidermal Growth Factor,EGF),促进蛋白激酶 B(Protein Kinase B,AKT)的磷酸化,活化AKT 信号通路,促进猪子宫内膜细胞的增殖;向小鼠子宫角灌注ANXA8 的siRNA 会减少胚胎的着床数量[13]。虽然ANXA8 降低会影响小鼠胚胎着床结局,但是ANXA8在小鼠围着床期子宫中的表达变化未知,siRNA 干涉导致胚胎的着床数量减少机制未知。基于以上体外实验结果,本实验检测了ANXA8 在小鼠胚胎着床中表达与调节,结果表明,在小鼠早期妊娠第1~4 天,ANXA8 定位于子宫的腔上皮和腺上皮,LIF 主要在小鼠子宫腔上皮和腺上皮以及部分基质细胞中表达,小鼠围着床期子宫腔上皮和腺上皮中 ANXA8 可能作为LIF 上游调控分子,参与小鼠胚胎着床过程。本研究与猪子宫内膜细胞中研究[13]相对一致。
本实验还检测到ANXA8 在小鼠妊娠第5~6 天定位于初级蜕膜区域中,第7~8 天强表达于次级蜕膜区域中;第8 天在注射芝麻油的人工诱导蜕膜化小鼠子宫中,蜕膜区也发现ANXA8 信号,实时荧光定量PCR也进一步验证了以上结果。体内实验表明,除子宫腔上皮外,ANXA8 定位于蜕膜组织,而且随蜕膜化的进行,ANXA8 表达增强,提示ANXA8 参与子宫基质细胞的蜕膜化过程。鉴于小鼠子宫蜕膜中含蜕膜细胞、免疫细胞等多种细胞,为了明确ANXA8 是否参与子宫基质细胞的蜕膜化过程,本研究体外培养小鼠子宫基质细胞并诱导蜕膜化,在72 h 内,蜕膜化标志分子DTPRP显著上升,表明细胞的确向蜕膜细胞分化。在这个过程中,ANXA8 表达明显升高,这说明ANXA8 在小鼠子宫基质细胞蜕膜化中发挥作用。目前,ANXA8 在胚胎着床中的研究只有Jiang 等[13]的1 篇报道。由于猪和小鼠胚胎着床方式不同,本实验结果发现ANXA8 在子宫腔上皮中的定位与子宫接受性建立有关,并且证明ANXA8 参与小鼠子宫基质细胞蜕膜化过程。
蜕膜是胚胎早期发育的微环境,蜕膜化起始时类似于炎症反应,然后转入免疫耐受以维持蜕膜中的免疫平衡保证胚胎正常发育[14]。蜕膜化过程中,伴随大量的免疫细胞募集,这些免疫细胞在蜕膜中分化,分泌细胞因子,维持蜕膜中独特的免疫环境,并且促进血管发生,为胎盘发育奠定基础。有研究表明,ANXA8 在白细胞募集中发挥作用,P- 选择素作为白细胞受体可以在炎症激活的血管内皮表面募集白细胞和血小板,P- 选择素在内皮细胞表面被CD63 稳定。在人脐静脉内 皮 细 胞(Human Umbilical Vein Endothelial Cells,HUVECS)中,干扰ANXA8 后细胞表面的CD63 和P-选择素的表达明显下降,并显示出白细胞迁移和粘附的缺陷[15]。小鼠子宫蜕膜中高表达ANXA8,ANXA8 是否参与免疫细胞的招募值得进一步研究。
有研究表明,ANXA8 参与血管内皮生长因子(Vascular Endothelial Growth Factor,VEG) 促 进 的血管发生。在HUVECS 中,干扰ANXA8 表达导致内皮细胞迁移和粘附到β1 整合素连接的细胞外基质蛋白的能力受到损害,导致VEGF 促进的血管发生削弱。ANXA8 促进CD63 在细胞表面的呈现促进CD63/VEGFR2/β1 复合物的形成,进而促进内皮细胞的迁移和粘附[16]。小鼠子宫蜕膜中表达VEGF,并且进行血管发生。本研究推测蜕膜中高表达ANXA8 可能与蜕膜中血管形成及血管重塑有关。
在Hela 细胞中,ANXA8 特异性地与晚期内体和F-肌动蛋白(F-actin)结合。改变细胞内ANXA8 水平并显著影响晚期内体的形态和细胞内分布,进而影响晚期内体介导的内吞和溶酶体降解。例如,ANXA8 降低会减弱EGF 和表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)通过溶酶体的降解,导致EGF 诱导的促分裂原活化蛋白激酶(Mitogen-activated Protein Kinase,MAPK)激活的延长,从而引起不平衡的信号传导[17]。EGF 是胚胎植入过程中关键因子[18],ANXA8有可能通过调节EGF 信号通路影响小鼠胚胎着床。
4 结 论
本实验中,ANXA8 mRNA 在早期妊娠第1~4 天的腔上皮与腺上皮和部分基质细胞中表达,在第5~8 天的蜕膜区表达并逐渐增高,在人工蜕膜化模型中人工蜕膜侧高于对照侧。ANXA8 蛋白的表达与ANXA8 mRNA表达类似,并且在体外培养的小鼠子宫内膜基质细胞中,随着诱导蜕膜化天数的增加ANXA8 也呈上升趋势,证明ANXA8 在小鼠胚胎着床和蜕膜化过程发挥重要作用。本研究首次揭示了ANXA8 在小鼠围着床期子宫中的表达规律,证明ANXA8 在小鼠胚胎着床和蜕膜化过程发挥重要作用,为后续在家畜中的研究奠定基础。

