绵羊CCCH 型锌指蛋白基因ZC3H10 的mRNA 表达研究
李宝钧,刘少贞,任有蛇,乔利英,刘建华,王伟伟,刘文忠
(山西农业大学动物科技学院,山西太谷 030801)
“锌指”是一种小的蛋白结构基元,可以结合1 个或几个锌离子保持其结构稳定。锌指蛋白包括众多不同结构的蛋白家族,如CCHH 型、C4 型、C6 型和CCCH型等[1],锌指蛋白的典型功能是与DNA、RNA、蛋白以及其他分子结合。CCCH 型锌指蛋白(Cys-Cys-Cys-His,Cys 为半胱氨酸,His 为组氨酸)包括1~6 个CCCH 型锌指基元。CCCH 型锌指基元氨基酸序列最初被定义为C-X6-14-C-X4-5-C-X3-H,X 表示其他氨基酸,目前被定义为C-X4-15-C-X4-6-C-X3-H[2],其中最常见的形式是C-X7-C-X5-C-X3-H 和C-X8-C-X5-C-X3-H。与其他类型锌指蛋白相比,CCCH 锌指蛋白的研究较少。
家畜中胴体脂肪含量决定肉类产品的嫩度、汁液含量和风味。调控体内脂肪沉积,生产脂肪含量适中的羊肉是肉羊育种的主要目标之一。成体动物的脂肪沉积主要为脂肪细胞的增加或脂肪体积的增加,而成体动物脂肪细胞的增加则由脂肪组织中前体脂肪细胞的增殖和分化来实现。因此,探明前体脂肪细胞分化的分子机制对于调控绵羊的脂肪沉积非常重要。前体脂肪细胞的分化由众多转录因子和相关蛋白所调控。本课题组前期已经对部分绵羊脂肪沉积相关蛋白基因进行了组织表达研究[3-5]。最新研究表明,ZC3H10 促进肌肉细胞的分化,而ZC3H10 的纯合突变子表现为脂肪含量升高和体内脂肪分布改变[6]。因此,ZC3H10 可能在脂肪细胞分化或脂肪代谢过程中发挥作用。本实验旨在研究绵羊ZC3H10 在不同脂肪组织部位和其他主要器官组织的mRNA 表达,以及在体外绵羊脂肪细胞分化模型中研究ZC3H10 随细胞分化的mRNA 表达规律,为研究ZC3H10 在绵羊脂肪沉积中的作用提供参考。
1 材料与方法
1.1 实验材料 本实验中屠宰程序和饲养管理按照中华人民共和国饲料卫生标准(GB 13078-2017)、畜类屠宰加工通用技术条件(GB/T 17237-2008)和无公害食品肉羊饲养兽药使用准则(NY 5148-2002)进行。选取4 只10 月龄小尾寒羊去势公羊(饲养条件相同)进行屠宰,并分别采集皮下脂肪组织以及心脏、肾、肝、肺、脾、小肠和肌肉(背最长肌)等组织样品,快速用铝箔纸包裹,置于液氮中,随后带回实验室保存于-80℃,用于实时荧光定量PCR。
考虑到方便取材,采用1 周龄晋中绵羊作为细胞培养的实验动物。绵羊前体脂肪细胞的分离、培养与分化参照赵艳艳等[7]的方法。如图1-A 所示,分离培养的前体脂肪细胞呈现纺锤形、星形、三角形等形态。如图1-B 所示,分化10 d 的脂肪细胞,其间有白色透亮的脂滴聚集。在绵羊前体脂肪细胞分化的0、2、4、6、8、10 d 分别收集细胞,每个时间点3 个重复,用于实时荧光定量PCR。
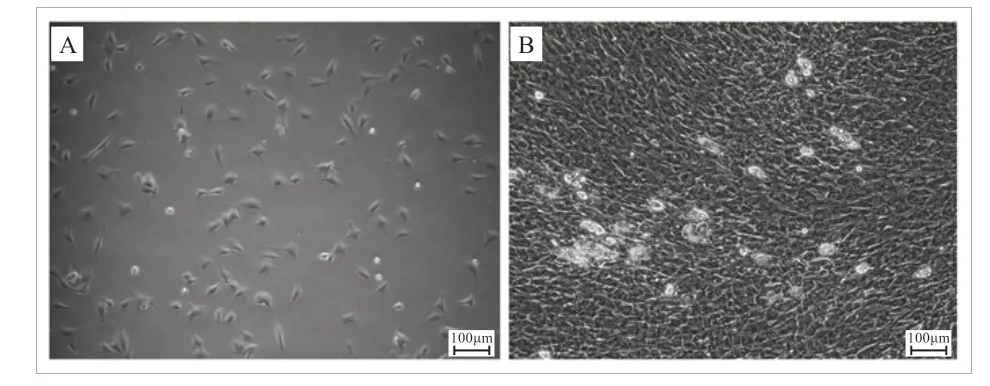
图1 培养的绵羊前体脂肪细胞(A)和分化10 d 的脂肪细胞(B)
1.2 生物信息学在线平台 使用SMART 工具(http://smart.embl-heidelberg.de)对绵羊ZC3H10 基因翻译的氨基酸序列进行结构域分析。使用Nucleotide BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析绵羊ZC3H10 基因与其他物种的序列同源性;进化树构建平台为Phylogeny.fr(http://www.phylogeny.fr/)。进行同源性分析和进化树的各物种序列信息:绵羊(XM_027967606.1)、爪蟾(NM_001008144.2)、斑马鱼(NM_207098.1)、家鼠(XM_006513013.2)、鸡(XM_015300307.2)、牛(NM_001097993.1)、 猪(XM_003126269.6) 和人(NM_001303124.1)。基因表达热图在Omicshare平台完成(http://www.omicshare.com/tools/Home/Soft/heatmap)。以上分析均采用默认参数完成。
1.3 总RNA 提取 绵羊各组织和培养细胞的总RNA 按照Trizol(TaKaRa 公司,美国)试剂盒说明书进行提取。RNA 浓度用NanoDrop 公司的核酸浓度测定仪检测,样品的OD260/280值在1.8~2.0。RNA 完整性通过1.2%凝胶电泳检测,28S 条带亮度约为18S 条带亮度的2 倍。提取的总RNA 保存于-80℃。
1.4 转录组测序 转录组数据来源于Li 等[8]文献。用于转录组测序的肾周、皮下、尾部脂肪组织来自4 只10 月龄小尾寒羊去势公羊,同1.1。
1.5 反转录与实时荧光定量PCR 根据TaKaRa 公司PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书合成cDNA 第一链。荧光定量PCR 仪为Applied Biosystems 公司的7500 Fast Real-Time PCR System,荧光定量PCR 试剂盒为TaKaRa 公司的SYBR Premix Ex Taq Ⅱ kit。反应体系:SYBR Premix Ex Taq Ⅱ(2×)10.0 μL,PCR 正反向引物各0.8 μL,Rox Reference Dye Ⅱ 0.4 μL,cDNA 模板2.0 μL,去RNA 酶超纯水6.0 μL。反应程序:预变性95℃ 30 s; 95℃ 5 s 和60℃ 34 s,45 个循环;熔解曲线阶段为95℃ 15 s,60℃ 1 min,再以每10 s 0.5℃的速率从60℃上升到95℃。每个样品进行3 次技术重复。RPL13A 由于表达稳定而作为内参基因。特异性引物通过在线工具Primer-BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)设计而成,引物序列见表1。基因的mRNA 相对表达量由2-ΔΔCT方法计算得出。
1.6 统计分析 运用SPSS 19.0 软件中单因素方差分析检验ZC3H10 基因在绵羊各种不同组织间或绵羊前体脂肪细胞分化的各时间点的表达差异性,各组织或各时间点基因表达量间的差异采用Duncan´s 法进行多重比较。P<0.05 表示差异显著。结果以平均值±标准误表示。
2 结果与分析
2.1 绵羊ZC3H10 基因序列的生物信息学分析 ZC3H10基因(NCBI ID:114108653)位于绵羊3 号染色体,含有3 个外显子。绵羊ZC3H10 基因序列与各物种同源序列间具有较高的保守性,其mRNA 序列与爪蟾、斑马鱼、鸡、小鼠、猪、牛和人的一致性(Identities)分别为67.32%、71.62%、73.27%、82.85%、88.73%、97.23%和90.86%,其中与牛的序列一致性最高。ZC3H10 基因编码的蛋白质基元序列非常保守,称为“CCCH 锌指”;绵羊ZC3H10 基因翻译的氨基酸序列在128~154、167~190 和226~252 位 置 有3 个CCCH 锌 指。ZC3H10基因进化树显示(图2),斑马鱼和非洲爪蟾与其他物种亲缘关系远,各列为一支;鸡与其他家畜及家鼠形成分支;家鼠与其他家畜形成分支,猪和人列为一支,牛和羊列为一支。
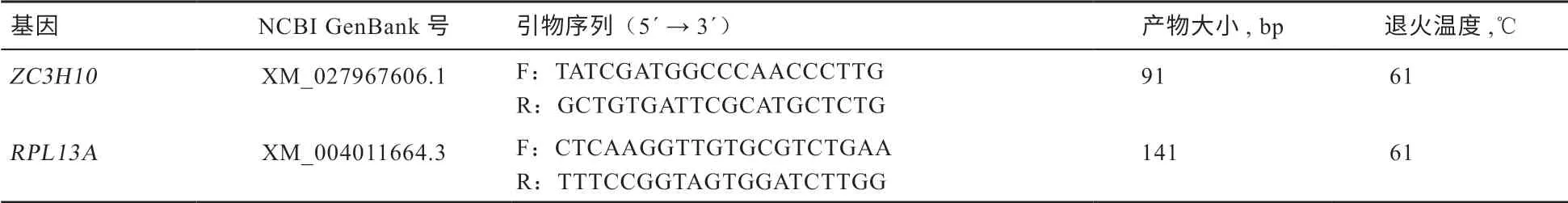
表1 实时荧光定量PCR 所用引物
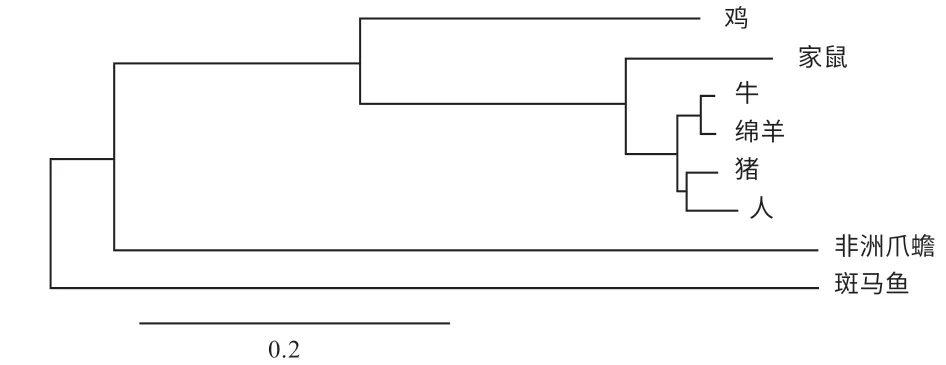
图2 ZC3H10 基因进化树
2.2 ZC3H10 基因在绵羊不同部位脂肪组织的mRNA 表达 根据Li 等[8]的转录组数据,按照mRNA 表达水平高低将所有检测到的基因进行排序,ZC3H10 基因在绵羊肾周脂肪、皮下脂肪和尾部脂肪转录组所有基因中的排名分别为第20、16、18。这说明ZC3H10 基因在这3 种脂肪组织中均有很高的mRNA 表达水平。将3 个脂肪组织转录组中表达量最高的前20 个基因进行交集,获得12 个基因,包括TMSB4、FABP4、ADIPOQ、VIM、ZC3H10 基因和7 个核糖体蛋白基因,即RPLP1、RPS12 、RPS8、RPS11、RPL27a、RPL31 和RPS24。根据这12 个基因在3 种脂肪组织中的mRNA表达丰度,将其进行聚类分析。如图3 所示,所有基因被分为4 组,FABP4、ADIPOQ 和ZC3H10 聚为一组,其他7 个核糖体蛋白基因聚为一组,TMSB4(Thymosin β4,胸腺素β4)和VIM(Vimentin,波形蛋白)各为一组。
2.3 ZC3H10 基因在绵羊各器官组织的mRNA 表达 图4 表明, ZC3H10 在绵羊皮下脂肪、心脏、肾、肝、肺、脾、小肠和肌肉等器官组织中均有表达。ZC3H10 在肌肉组织中的mRNA 表达最高,显著高于其他组织。ZC3H10在肾中的表达仅次于肌肉,与心、肝、脾和小肠中的表达差异不显著,但显著高于脂肪和肺。ZC3H10 在脂肪中的mRNA 表达显著高于肺,显著低于肌肉和肾,与心脏、肝、脾、小肠间的表达差异不显著。ZC3H10 在肺中的mRNA 表达最低,且显著低于其他各组织。
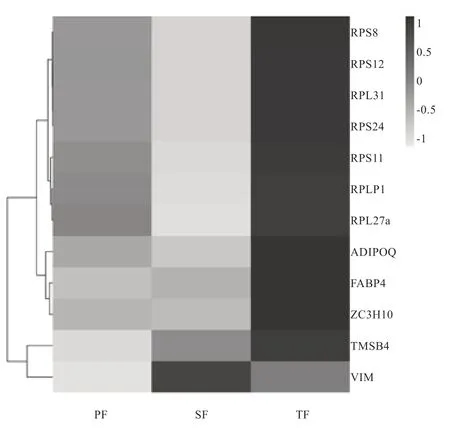
图3 12 个高表达基因在脂肪组织中的mRNA 表达热图
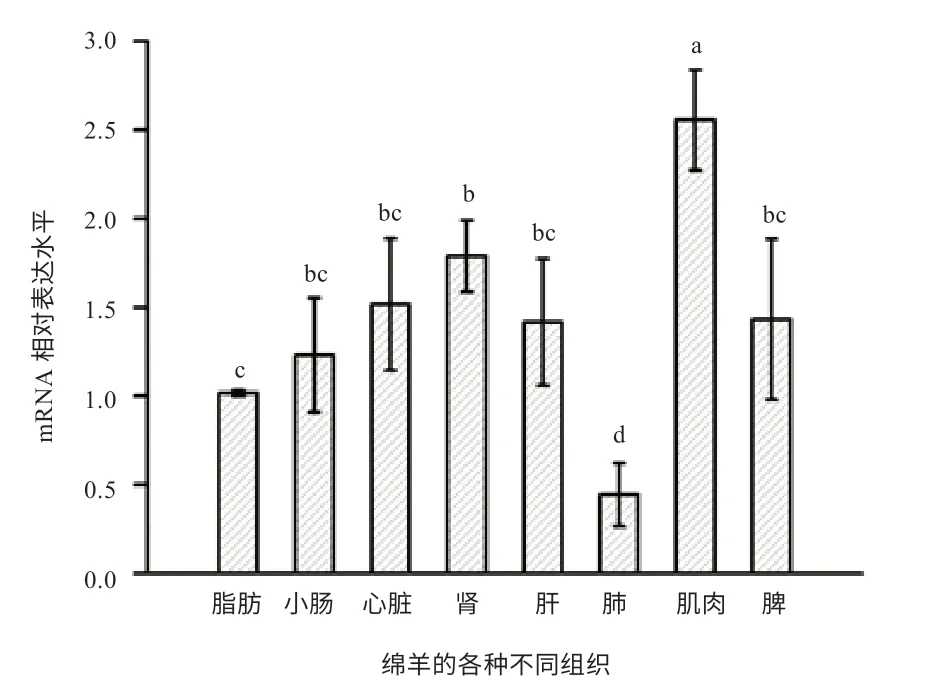
图4 绵羊ZC3H10 mRNA 的组织表达
2.4 ZC3H10 基因在绵羊体外前体脂肪细胞分化过程中的mRNA 表达 由图5 可知,随着前体脂肪细胞分化的进行,绵羊ZC3H10 基因mRNA 的表达呈下调趋势。ZC3H10 在前体脂肪细胞(分化0 d)中的mRNA 水平显著高于分化过程中的任何时期。ZC3H10 在前体脂肪细胞分化2 d 的mRNA 表达显著高于4、6、8、10 d;而前体脂肪细胞分化4、6、8 d 的mRNA 表达差异不显著。细胞分化10 d 的ZC3H10 mRNA 表达在所有检测的时间点中表达最低,且显著低于其他时期。
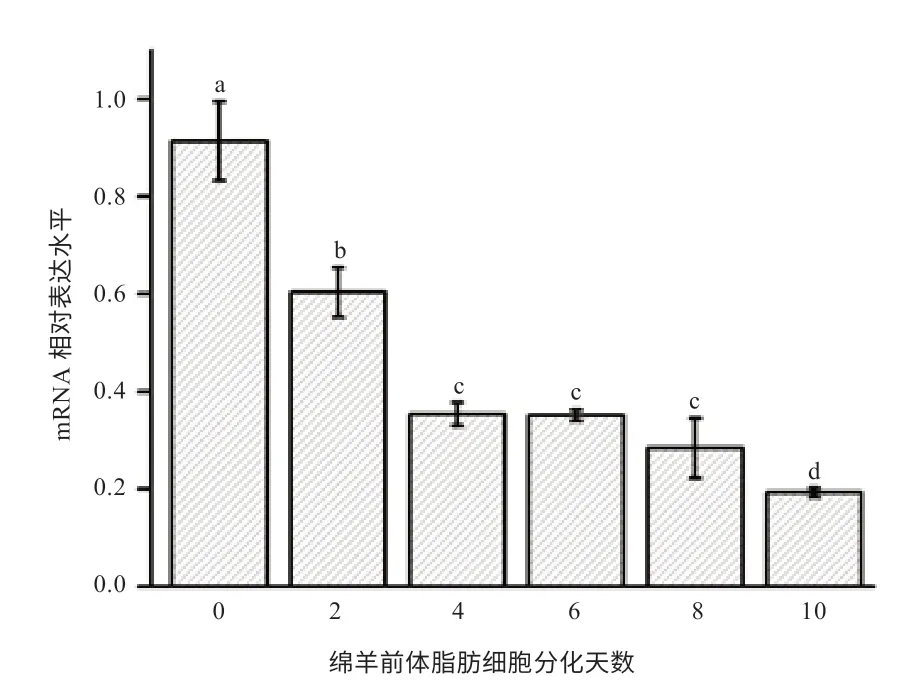
图5 ZC3H10 基因在绵羊前体脂肪细胞分化过程中的mRNA 表达
3 讨 论
3.1 ZC3H10 基因的表达与功能 本研究表明, 绵羊ZC3H10 在不同器官组织中均有表达,且在肌肉中表达最高,在肺中表达最低。人ZC3H10 基因在脂肪、心脏、肾、肝、肺、脾、小肠等28 种组织中均有表达[9]。小鼠ZC3H10 基因在胚胎的神经、脑、肢等器官组织以及成体的心、肾、肺和脂肪等组织中表达[10]。这些研究显示ZC3H10 基因的mRNA 广泛表达于各种组织,但其表达有种属差异性,在同一物种中也存在组织差异性。
锌指结构具有与核酸作用的能力。在Hela 细胞中的研究表明,ZC3H10 可做为RNA 结合蛋白与mRNA结合[11]。 Treiber 等[12]研究表明,ZC3H10 可结合到多种细胞系的microRNA。ZC3H10 在哺乳动物癌细胞系MCF-7 中可作为肿瘤抑制因子[13]。Audano 等[6]研究显示,ZC3H10 在C2C12 肌肉细胞分化过程中表达上调,ZC3H10 过表达促进了肌母细胞的分化,敲除ZC3H10 则导致肌母细胞分化的抑制。人ZC3H10 突变的纯合子呈现身体质量指数和脂肪含量的升高和脂肪分布改变[6]。这些结果提示ZC3H10 在脂肪代谢中可能发挥作用。本研究发现,ZC3H10 在绵羊不同部位的脂肪组织中均有很高的mRNA 表达,且与脂肪沉积相关基因脂肪酸结合蛋白(Fatty Acid Binding Protein 4,FABP4)和脂联素(Adiponectin,ADIPOQ)有相似的表达模式。这说明ZC3H10 基因可能与这2 个基因有相似的功能。FABP4 在脂肪酸转运和动物脂肪沉积中发挥作用。FABP4 多态性与牛的脂肪沉积显著相关[14]。ADIPOQ 是脂肪细胞分泌的主要脂肪细胞因子,调控葡萄糖的代谢与脂肪酸氧化[15]。ADIPOQ 的多态性与牛肉的大理石花纹显著相关[16]。因此,ZC3H10 可能在脂肪代谢中发挥作用。发育生物学研究显示,脂肪细胞和肌肉细胞的发育来源相同,均来自于发育早期中胚层细胞,一些促进肌肉细胞分化的基因往往抑制脂肪细胞的分化,如SIRT1[17]、Wnt10b[18]等。本研究表明,ZC3H10 的表达随着绵羊前体脂肪细胞的分化而下调,所以绵羊ZC3H10 可能抑制脂肪细胞的分化。
3.2 锌指蛋白在脂肪细胞分化中的作用 PPARγ 和C/EBP是脂肪细胞分化和基因表达的主控因子[19]。目前研究发现不少锌指蛋白通过作用PPARγ 或C/EBP 促进或者抑制脂肪细胞的分化。在脂肪细胞分化中起正调控作用 的CCHH 型 锌 指 蛋 白KLFs(Krupel-like factors)有KLF4、KLF5、KLF6 和KLF15;起负调控作用的CCHH 型锌指蛋白有KLF2、KLF3 和KLF7[20]。CCHH型锌指蛋白638(Zinc Finger Protein 638,Zfp638)和SNAIL2 均促进脂肪细胞的分化。而C2C2 型锌指蛋白GATA2 和GATA3 是脂肪细胞分化的负调控因子[21]。本研究中的ZC3H10 有望成为影响脂肪细胞分化的新的锌指蛋白成员。
4 结 论
本实验结果显示,CCCH 型锌指蛋白基因ZC3H10在绵羊主要器官组织均有mRNA 表达,在不同脂肪部位有较高的mRNA 表达。在体外绵羊前体脂肪细胞分化过程中,ZC3H10 mRNA 的表达呈现下调趋势。需要进一步开展功能丧失或功能获得等实验研究,继续探明ZC3H10 基因在脂肪细胞分化和代谢中的功能以及作用机制。

