探究气体浓度的变化对化学平衡移动的影响
王 芬
(陕西省白河高级中学 725899)
一、提出问题

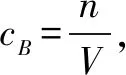
那平衡移动的结果是什么呢?这决定了达到平衡时二氧化碳的浓度.根据勒夏特列原理:改变影响平衡移动的条件之一,平衡将向着能够减弱这种改变的方向移动.如果只是减弱而不抵消的话,本题中达到平衡时二氧化碳的浓度应该是增大的,可是根据平衡常数K=c(CO2),温度不变,K值不变,那c(CO2)的应该是不变的.再次回到课本选修四《化学反应原理》的第二章化学反应速率和化学平衡的第16页“一些现象明显、便于观察的实验,使我们能够对化学反应原理有一些感性的认识.当我们页必须清醒地认识到,他们只是原理所覆盖的成千上万个化学反应中的个例,所提供的信息往往是不完全的.”和第28“法国化学家勒夏特列总结出的一条经验规律”,说明不是所有的可逆反应都符合勒夏特列原理,像这种有固体反应生成纯净气体的可逆反应就不符合勒夏特列原理,也就是说,充入二氧化碳后平衡逆移,到达新平衡时充入的二氧化碳可以被消耗完,所以c(CO2)与原平衡相同.
二、得出结论
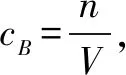

(1)该平衡常数表达式K=____.
(2)若反应体系的体积不变,升高温度,则p(CO2)将____(填“增大”“减小”或“不变”).
(3)若反应温度T不变,将反应体系的体积缩小至原来的一半,则p(CO2)变化范围为____.
答案:(1)K=c(CO2);(2)增大;(3)4 MPa≤p(CO2)<8 MPa.
例2某温度下,将一定量BaO2放入密闭的真空容器中,发生反应

并达到平衡.若保持温度不变,缩小体积,则下列结论不正确的是( ).
A.当氧气的浓度不再变化时,反应重新达到平衡状态
B.在达到平衡过程中,逆反应的变化如图所示
C.当体系重新达到平衡时,容器内压强增大
D.当体系重新达到平衡时,BaO 的质量减小
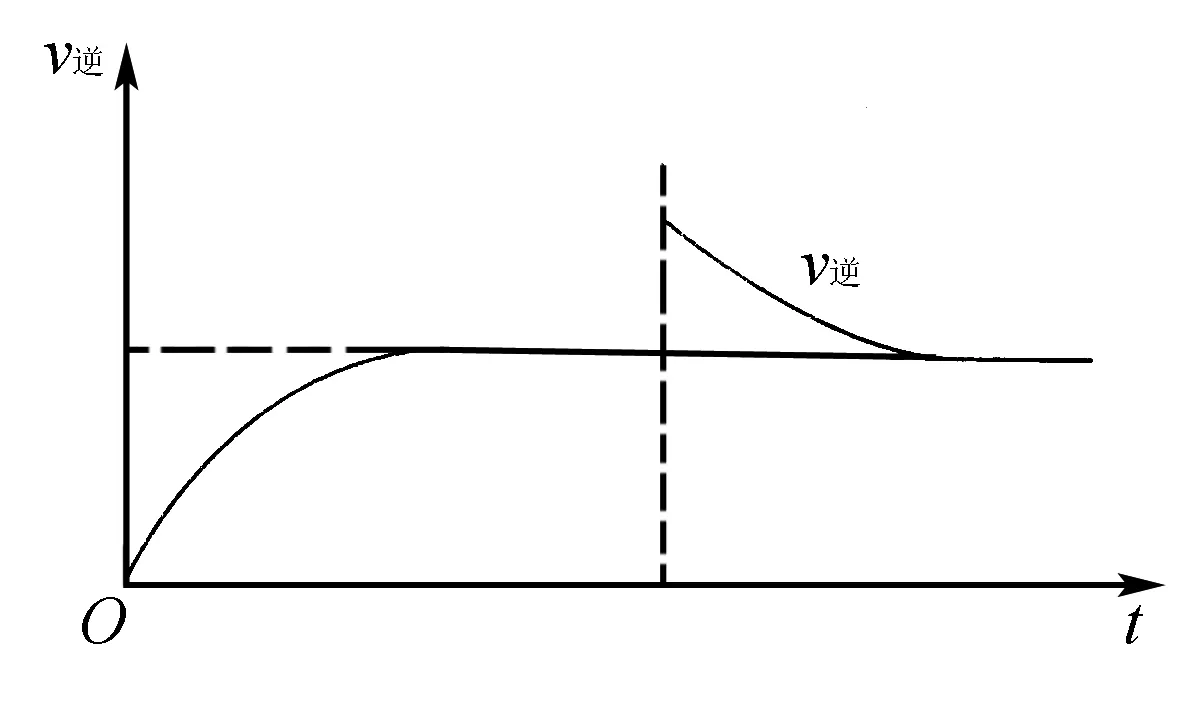
解析只有O2是气体,其他物质为固体,温度不变缩小体积,c(O2)增大,逆反应速率突然增大后逐渐减小,C错误;平衡逆向移动,c(O2)不再变化时反应重新达到平衡状态,c(O2)且与原平衡相同,A正确;压强与原平衡相同,B均正确;平衡逆向移动,BaO的质量减小,D正确.答案:C

