同时性结直肠癌原发灶和肝转移灶中KRAS基因突变的一致性分析
林 奇,周鹏扬,庄奥博,许剑民
复旦大学附属中山医院普通外科,上海 200032
约25%的结直肠癌(colorectal cancer, CRC)患者在首诊时即发现有同时性肝转移,15%~25%的患者会发生异时性肝转移[1-2]。无法手术切除的结直肠癌肝转移(colorectal liver metastasis, CRLM)患者的中位生存时间仅为2.3~21.3个月[3],而手术切除是患者获得治愈的唯一途径,约25%~50%的患者获得手术切除后能存活超过5年[2, 4-5]。但是,即使获得R0切除的患者也有超过2/3会在2年内再次复发,从而无法获得长期生存[1, 6-7]。
转移性结直肠癌(metastatic colorectal cancer, mCRC)在临床表现和生物学方面均存在高度异质性[8],因此需要对患者进行分层治疗。目前,包括肝转移灶大小和数目、原发灶术后发生肝转移的间隔时间、糖类抗原(CEA)水平和原发灶分期在内的临床风险评分(clinical risk score, CRS)已无法精确判断术后mCRC复发率和决定手术选择[9-11]。因此,有必要纳入更多的分子标志物,以提高疗效预测的准确性。
KRAS基因作为RAS基因家族(包括KRAS、NRAS和HRAS)的成员,在上皮生长因子受体(epidermal growth factor receptor, EGFR)信号通路的下游发挥作用,促进mCRC的发生和进展[12-13]。32%~40%的mCRC肿瘤组织中存在KRAS突变,其中85%~90%的突变位于密码子12和13,密码子61和146各占5%[12]。目前KRAS突变已成为不能获得抗EGFR治疗疗效的标志[12-15]。同时,已有研究[9, 16-17]表明KRAS的突变还可以作为CRLM切除术后的预后因素。但是目前缺乏对于初始可切除同时性结直肠癌肝(synchronous colorectal liver metastases,SCRLM)转移同期切除术后的预后研究。本研究比较了SCRLM患者原发灶和转移灶中KRAS基因突变的差异,同时分析了KRAS突变对于初始可切除SCRLM患者同期切除术后预后的影响。
1 资料与方法
1.1 入组标准 收集2003年7月至2013年7月在复旦大学附属中山医院行同期切除的139例同时性结直肠癌肝转移患者的临床资料。入组标准[18]:(1)原发灶和肝转移灶初始可以切除,肝外转移灶可获得R0切除;(2)术后肝容量≥ 50%;(3)保留肝脏解剖功能。术前接受过肝切除或者射频消融治疗的患者排除出组。所有患者术前均经结直肠多学科团队根据患者的一般情况和检查结果进行评估,决定具体治疗方案。具体手术由固定的结直肠外科和肝外科手术小组共同完成。
1.2 数据收集及随访 患者的基本情况、临床病理数据、手术过程、手术死亡率以及术后短期疗效(术后并发症)和长期疗效(术后生存情况)的数据和资料均录入结直肠癌肝转移数据库。由专职人员负责随访,每半年随访1次,随访截止时间为2014年12月31日。随访采用门诊、电话、书信形式。随访内容包括肿瘤指标、胸X线片、彩超、CT和MRI等,必要时行PET-CT检查。无瘤生存时间(disease-free survival, DFS)是自手术切除至发现复发或转移的时间;总生存时间(overall survival, OS)是自手术切除至最后1次随访或因该疾病死亡的时间。
1.3 基因突变检测 选取结直肠癌原发灶和转移灶石蜡标本,采用基因科技(上海)有限公司“GTpure FFPE组织DNA提取试剂盒”,从石蜡切片中抽提基因组,制备DNA模板,PCR扩增后行Pyrosequencing焦磷酸测序。检测KRAS基因12、13、61和146密码子突变情况[13]。
1.4 统计学处理 应用SPSS 16.0统计软件进行分析,计数资料的比较采用χ2检验(或校正χ2检验),计量资料的比较采用t检验,原发灶和转移灶突变率的差异采用配对样本的非参数检验(Wilcoxon)。存活率采用寿命表法进行推算,用Kaplan-Meier法绘制生存曲线,并采用log-rank法进行比较。多因素分析用Cox比例风险回归模型。检验水准(α)为0.05。
2 结 果
2.1 患者的临床病理特征 139例行结直肠癌原发灶和肝转移灶同期切除患者中58.3%(81/139)的患者为男性,60.0%(89/139)的患者年龄小于60岁,69.8%(97/139)的患者肿瘤原发部位在结肠,肝转移灶数目为1.0~7.0(1.85±1.14)个,最大转移灶的直径为(3.79±2.32) cm (0.5~15 cm,表1)。
2.2 手术方式及术后并发症 139例患者均获得了原发灶和肝转移灶R0切除,28.1%(39/139)的患者出现并发症,发生率较高的是少量腹腔积液(7.2%,10/139),膈下积液(5.8%,8/139),胸腔积液(5.0%,7/139),并发症较重的为胆漏(1.4%,2/139),以及吻合口漏(1.4%,2/139),这些并发症均经胸腹腔引流、抗炎支持治疗等非手术治疗措施获得治愈或明显缓解。

表1 KRAS基因状态和临床病理特征的相关性
a因2例KRAS野生型患者未查CEA,仅纳入137例分析
2.3 KRAS突变在原发灶和转移灶中的一致性分析及其与临床病理因素的关系 139例患者的原发灶中,KRAS突变占28.8%(40/139),其中22.3%(31/139)为密码子12突变,6.5%(9/139)为密码子13突变。原发灶和转移灶均完成KRAS突变检测者有95例(44例患者因资料不全未完成相应配对检测),28例患者原发灶和转移灶中均有突变,其突变位完全一致;均无突变者65例;仅有2例患者原发灶中无突变,而在转移灶中检测到了KRAS突变。采用配对样本的非参数检验发现,原发灶[29.5%(28/95)]和转移灶[31.6%(30/95)]的突变率,差异无显著统计学意义(P=0.157)。
经过χ2检验,KRAS的突变和年龄、性别、原发灶位置、组织学类型、肿瘤分化、T分期、N分期、血管浸润、神经浸润、肝转移灶数目、肝转移灶最大直径以及CEA水平等临床病理因素之间均无显著相关性(表1)。
2.4 生存分析 截至随访日期,139例患者的5年OS为50.0%,5年DFS为36.0%。其中28.8%(40/139)的患者已经死亡,49.6%(69/139)的患者出现肿瘤复发,35.3%(49/139)的患者仅有肝内复发,6.5%(9/139)的患者仅有肺内转移。Kaplan-Meier曲线生存分析(图1)发现,KRAS突变野生型患者OS没有显著差异(P=0.213),KRAS突变患者的DFS明显短于野生型患者(P=0.041)。多因素分析发现,转移灶数≥ 4(P=0.005)和KRAS突变(P=0.012)是短DFS的独立预后因素(表2)。
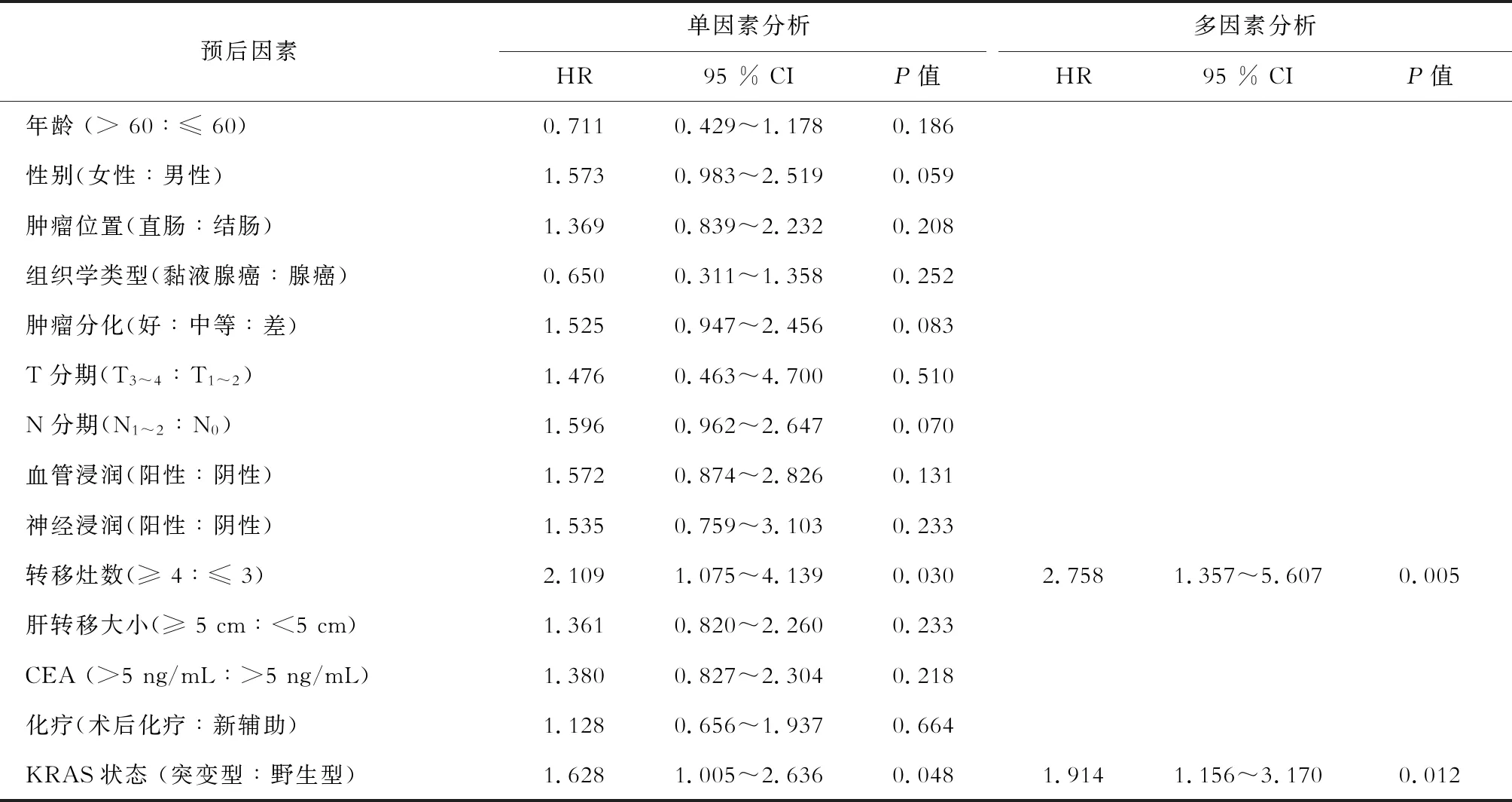
表2 DFS相关因素分析
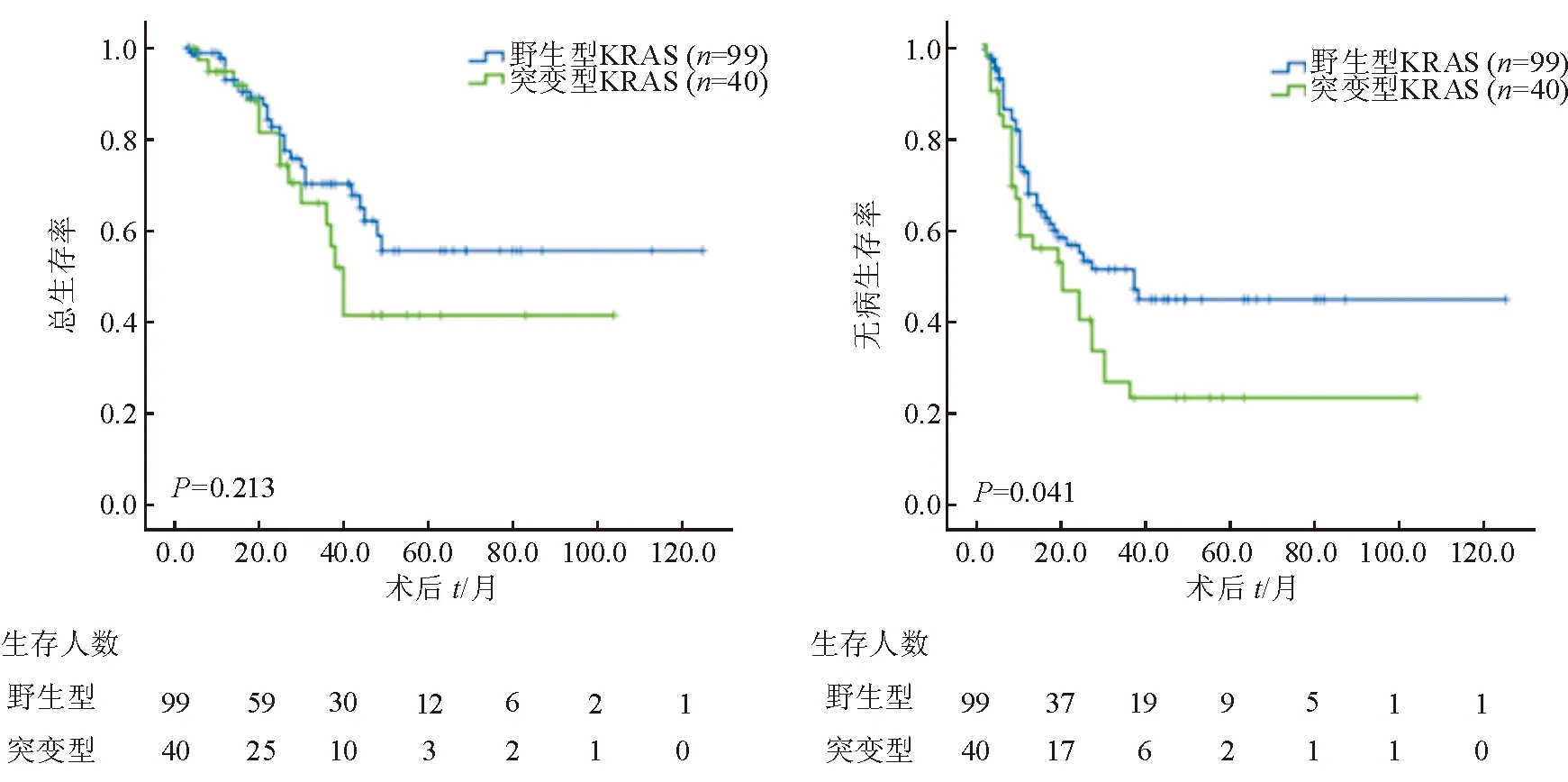
图1 KRAS突变和OS及DFS的相关性
3 讨 论
同期切除结直肠原发灶和肝转移灶曾被认为会增加手术并发症和围手术期死亡率[19-20],但是随着手术、麻醉和重症监护等技术的进步,近年来肝切除(包括半肝切除)的并发症发生率和死亡率逐渐下降,同期切除原发灶和肝转移灶逐渐得到了开展[4, 21-23]。和分期切除相比,同期切除后5年OS和DFS也无明显差异[3-4, 24]。同期切除不仅能减少住院费用和减轻患者二次手术的精神负担,重要的是避免肿瘤进展或化疗导致的肝损伤贻误手术时机[3]。本研究结果显示:围手术期死亡率为0%,虽然28.1%的患者出现了术后并发症,但均经非手术治疗后获得治愈或明显缓解,充分说明同期切除结直肠癌肝转移是安全可行的。同时,这些患者的5年OS达到了50.0%,5年DFS为36.0%,这些生存数据也从肿瘤学角度说明同期切除的可行性。但是肝转移灶术后的高复发率(本研究复发率为49.6%)仍然是外科医生面临的难题。既往的临床病理因素评估体系已经不能精确判断预后,需要从分子水平寻找更多的疗效预测标志物,用于筛选病例,避免不必要的手术。
目前KRAS突变已成为不能获得抗EGFR治疗疗效的标志[12-15],临床意义重大。但是因为肿瘤的高异质性,还不能确定原发灶和转移灶之间KRAS突变率是否存在差异。本研究结果显示:原发灶和转移灶之间KRAS突变差异无统计学意义,对原发灶中基因突变的检测可以代表转移灶中基因突变情况,这和既往的一些研究[25-28]结果一致。本研究发现,2例患者原发灶中无突变,转移灶中检测到了KRAS突变。Vakiani等[27]研究表明仅有2.4%(2/84)的患者在原发灶中KRAS无突变,而在转移灶中发现突变,且研究者怀疑可能由多原发肿瘤导致;也有研究中多达6%(5/83)的患者原发灶中存在KRAS突变,而在转移灶中未发现突变[25]。而研究[28]发现,11.3%的mCRC患者原发灶肿瘤为KRAS突变型,而转移灶为野生型。这些研究充分说明了原发灶和转移灶之间的异质性。另外靶向治疗可导致KRAS基因型的改变[28],这提醒临床治疗效果不佳时,需要考虑行病灶的重新穿刺活检或液态活检进一步明确基因状态,适时调整治疗方案。本研究的缺陷为:对于存在多个转移灶的患者,没有检测所有转移灶的突变情况。
目前已有一些研究得出KRAS突变和肝脏转移灶切除术后短OS[16, 29-31]和DFS[16-17, 29, 31-34]相关,同时KRAS突变是短OS[16, 30, 35-36]和DFS[31, 33-35]的独立预后因素。本研究仅发现KRAS突变和短DFS相关,且是DFS的独立预后因素,表明KRAS突变的患者术后容易复发,在决定同期手术决策时需要考虑KRAS状态。

