骆马湖夏季浮游植物群落结构变化及其驱动因子分析
覃宝利,唐金玉,王宣朋,吴 春,叶建勇,丁辰龙
(江苏省农业科学院宿迁农科所,江苏 宿迁 223800)
骆马湖(34°00′~34°11′ N,118°06′~118°18′ E)是淮河流域第3大湖泊,江苏省第4大湖泊,对南水北调东线工程具有重要的调蓄作用,同时也是宿迁市的重要饮用水源地,承担着宿迁市区供水功能[1]。骆马湖北面通过京杭大运河与山东南四湖相连,南与洪泽湖相连,继而与长江水系相通。入湖河流主要有沂河水系、南四湖水系和邳苍地区共40多条支流,出流有3处,分别经嶂山闸入新沂河,经皂河闸入中运河,经洋河滩闸入六塘河。据统计,骆马湖年水位变幅为1.90~5.73 m,年换水10次左右,属典型过水性湖泊。近年来,无序采砂、不合理养殖和入湖污染物增加等状况导致骆马湖湖泊生态系统遭到破坏,水环境发生变化,生物多样性降低[1],使得骆马湖生态环境问题日益严重。
浮游植物作为湖泊生态系统中的初级生产者,具有较短的生长周期和较强的扩散能力,不同种类浮游植物对栖息地、营养物质和光照强度等的需求不同。种群密度对水质、水动力和气候条件等变化非常敏感,故通常被用于指示水体环境变化,特别是营养盐水平的变化[2]。欧盟水框架协议、海洋战略框架指令等国际政策法规[3-4]均提出将浮游植物群落作为水质评价的重要指标,通过其生物量、群落组成和丰富度等指标来反映水体特征和水生态状况。水体的温度、光照、营养盐及水动力等环境因子又易影响浮游植物群落结构的变化[5]。因此,进行浮游植物群落特征及其影响因子的研究,对于了解整个湖泊生态系统的结构、功能及维护生态平衡具有重要意义。
近年来,众多学者对骆马湖水质及富营养化程度进行研究,认为骆马湖处于中富营养化水平,这些研究大多数集中于富营养化评价等方面[6-7],有关骆马湖浮游植物群落结构变化及其驱动因子的报道不多。该文旨在通过对骆马湖进行采样调查,分析浮游植物群落结构变化及其驱动因子的影响,以期为骆马湖生态环境保护与管理提供数据支持。
1 研究方法
1.1 水样的采集和鉴定
于2017年8—9月年进行野外调查,每月初采样1 次,共设置20个采样点(图1)。采用GPS(集思宝G120BD)现场测定样点位置,采用YSI 85溶氧仪测定水体温度(T)和溶解氧(DO)浓度,采用YSI60 pH计测定pH,采用塞氏盘测定透明度。用5 L采水器采集表层、中层和底层水样,现场混匀后取5 L水样冷藏带回实验室分析总氮(TN)和总磷(TP)浓度等[8]水质指标。叶绿素a和藻蓝蛋白(phycocyanin,PC)浓度采用丙酮提取法测定[9]。每个采样点水样混合后另外保留1 000 mL,立即加入鲁哥试剂固定用于分析浮游植物样品,在稳定的实验台上固定24~36 h,用细小虹吸管移出上清液,最后定容到30 mL。取浓缩后的0.1 mL样品利用放大400 倍的显微镜鉴定浮游植物种类并计数。计数方法为目镜视野法,一般随机计数30~50个视野,使得细胞数在300以上。由于浮游植物的相对体积质量接近1,故可直接将浮游植物的体积换算成生物量(以湿重计),即生物量为各自丰度乘以各自平均体积,单位为mg·L-1,单细胞生物量主要根据浮游植物个体形状测量得到。上述实验方法主要参见《淡水浮游生物研究方法》[10]。
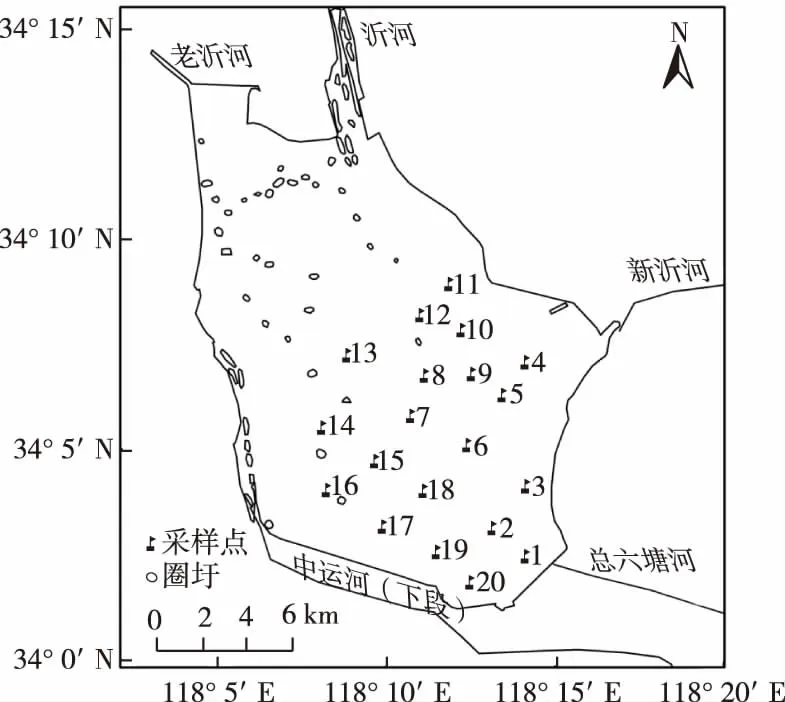
图1 骆马湖采样点位分布
1.2 数据分析
利用Excel 2003、Origin 8.5和SPSS 12软件制图并分析。利用Canoco 4.5软件的冗余分析(redundacy analysis,RDA)计算浮游植物组成与环境因子的相关性,RDA分析中环境因子和种群组成数据均经过lg (x+1)转换[11],利用软件中的预筛选功能(forward selection)筛选对群落组成影响显著的环境因子,采用499次非限制性蒙特卡罗排列(Monte Carlo permutations)对计算结果的显著性进行验证,排序结果用表征种类、样品和环境因子关系的三序图表示。
浮游植物优势种用优势度(Y)来判定,其计算公式为
Y=(ni/N)·fi。
(1)
式(1)中,fi为物种i在采样点的出现频率;ni为第i个物种的密度;N为所有物种总个数。物种优势度Y≥0.02即定为优势种[12]。
浮游植物多样性采用SPADE(species prediction and diversity estimation)软件进行计算,多样性指数[13]包括Shannon-Wiener指数(H)、Simpson指数(M)和Pielou指数(J),其中,Shannon-Wiener指数受物种丰富度影响较大,Simpson指数较多地反映物种优势度,Pielou指数则是物种均一性的度量。H、M和J计算公式为
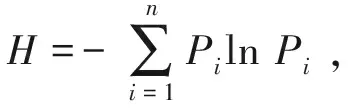
(2)

(3)

(4)
式(2)~(4)中,Pi为第i个浮游植物种数量;S为每个采样点的浮游植物物种总数。
2 结果与分析
2.1 采样点位
根据环境保护部门在骆马湖设立的省控监测点位[14]和邹伟等[15]对骆马湖区生境特征的划分,采样点划分情况如下:9~12#为戴场(围网养殖),6~8、13#为三场(采砂区),4~5#为嶂山闸,14~18#为骆马湖乡(围网养殖),1~3、19~20#为洋河滩闸(船只停靠、渔货销售、生活及游乐场所)。其中,9~12#区域水深为3.4~3.9 m,pH为8.1~8.7,透明度为60~105 cm,COD为10.9~14.1 mg·L-1;6~8、13#区域水深为4.8~5.4 m,pH为8.0~8.5,透明度为52~75 cm,COD为11.0~14.6 mg·L-1;4~5#区域水深为3.6~4.3 m,pH为8.0~8.3,透明度为65~80 cm,COD为9.0~13.0 mg·L-1;14~18#区域水深为3.8~4.1 m,pH为8.5~8.8,透明度为60~110 cm,COD为8.9~15.4 mg·L-1;1~3、19~20#区域水深为2.8~4.3 m,pH为8.3~8.7,透明度为70~100 cm,COD为9.4~14.3 mg·L-1。1~3、19~20#区域底质水草较多,6~8、13#区域底质为砂质,其他区域底质大部分为淤泥或黏土。
2.2 浮游植物群落组成及分布
此次调查鉴定到包括绿藻门、蓝藻门、硅藻门、裸藻门、甲藻门和隐藻门共计32属。其中,绿藻门11属,蓝藻门7属,硅藻门6属,裸藻门5 属,甲藻门2属,隐藻门1 属。此次调查鉴定到的绿藻门属数最多,优势属(括号内数字为优势度)有盘星藻(0.04)、小球藻(0.03)、十字藻(0.02)和栅藻(0.01);硅藻门优势属有直链藻(0.01);蓝藻门优势属有浮游蓝丝藻(0.59)、微囊藻(0.03)、鱼腥藻(0.02)、颤藻(0.01)和螺旋藻(0.01);隐藻门优势属有隐藻(0.01)等,优势属点位分布见表1。
表1 骆马湖夏季浮游藻类优势属空间分布
Table 1 Distribution of dominant phytoplankton species in summer in Luoma Lake
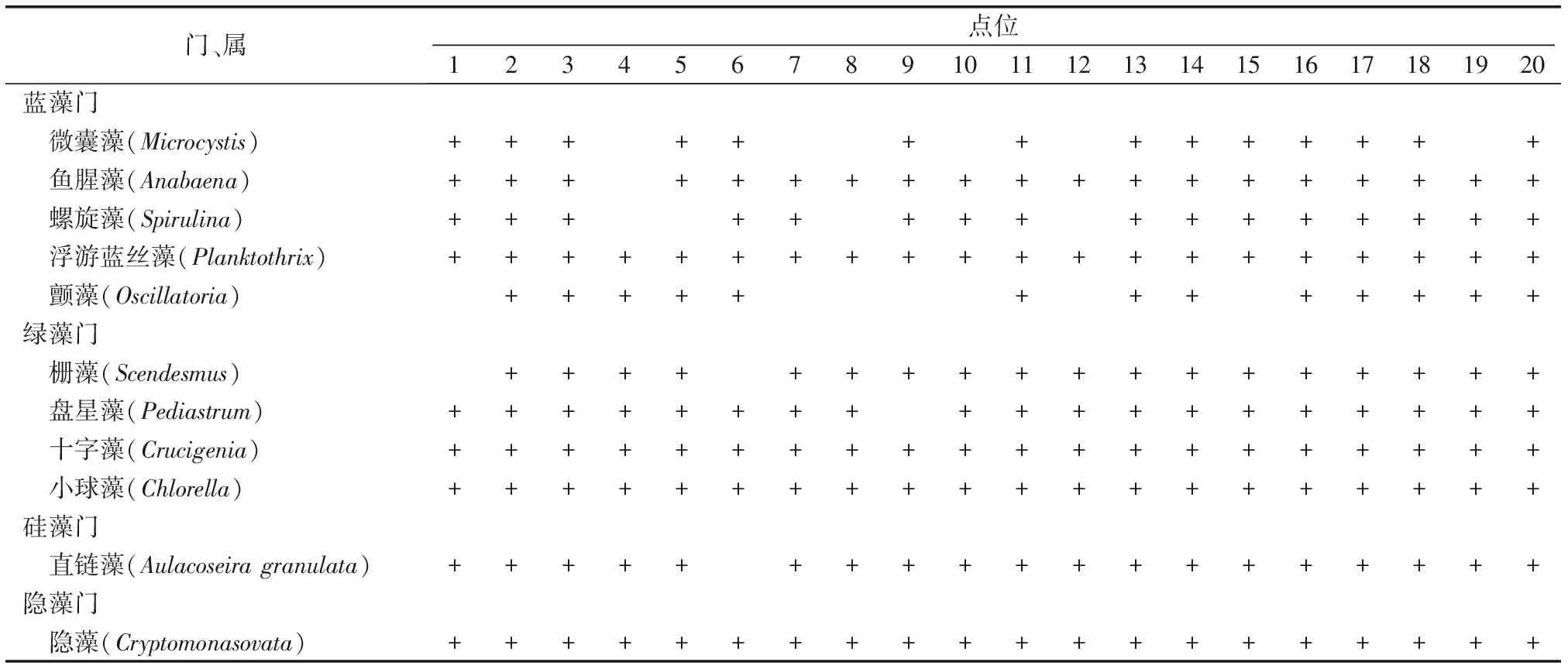
门、属点位1234567891011121314151617181920 蓝藻门 微囊藻(Microcystis)++++++++++++++ 鱼腥藻(Anabaena)+++++++++++++++++++ 螺旋藻(Spirulina)++++++++++++++++ 浮游蓝丝藻(Planktothrix)++++++++++++++++++++ 颤藻(Oscillatoria)+++++++++++++ 绿藻门 栅藻(Scendesmus)++++++++++++++++++ 盘星藻(Pediastrum)+++++++++++++++++++ 十字藻(Crucigenia)++++++++++++++++++++ 小球藻(Chlorella)++++++++++++++++++++ 硅藻门 直链藻(Aulacoseira granulata)+++++++++++++++++++ 隐藻门 隐藻(Cryptomonasovata)++++++++++++++++++++
“+”表示所列属优势度Y≥0.01。
8—9月骆马湖全湖浮游植物丰度在2.63×105~2.85×107cells·L-1之间,平均为1.50×108cells·L-1,其中,蓝藻门丰度占总丰度的82.2%,为绝对优势门,其后依次为绿藻门和硅藻门,分别占15.3%和1.2%。9月浮游植物总丰度为8月的87.4倍,蓝藻门总丰度是8月的9.5倍。从时间分布来看,9月浮游植物总生物量显著高于8月(P<0.05)(图2),8月绿藻门最多(11.803 mg·L-1),9月蓝藻门最多(19.134 mg·L-1)(图2)。
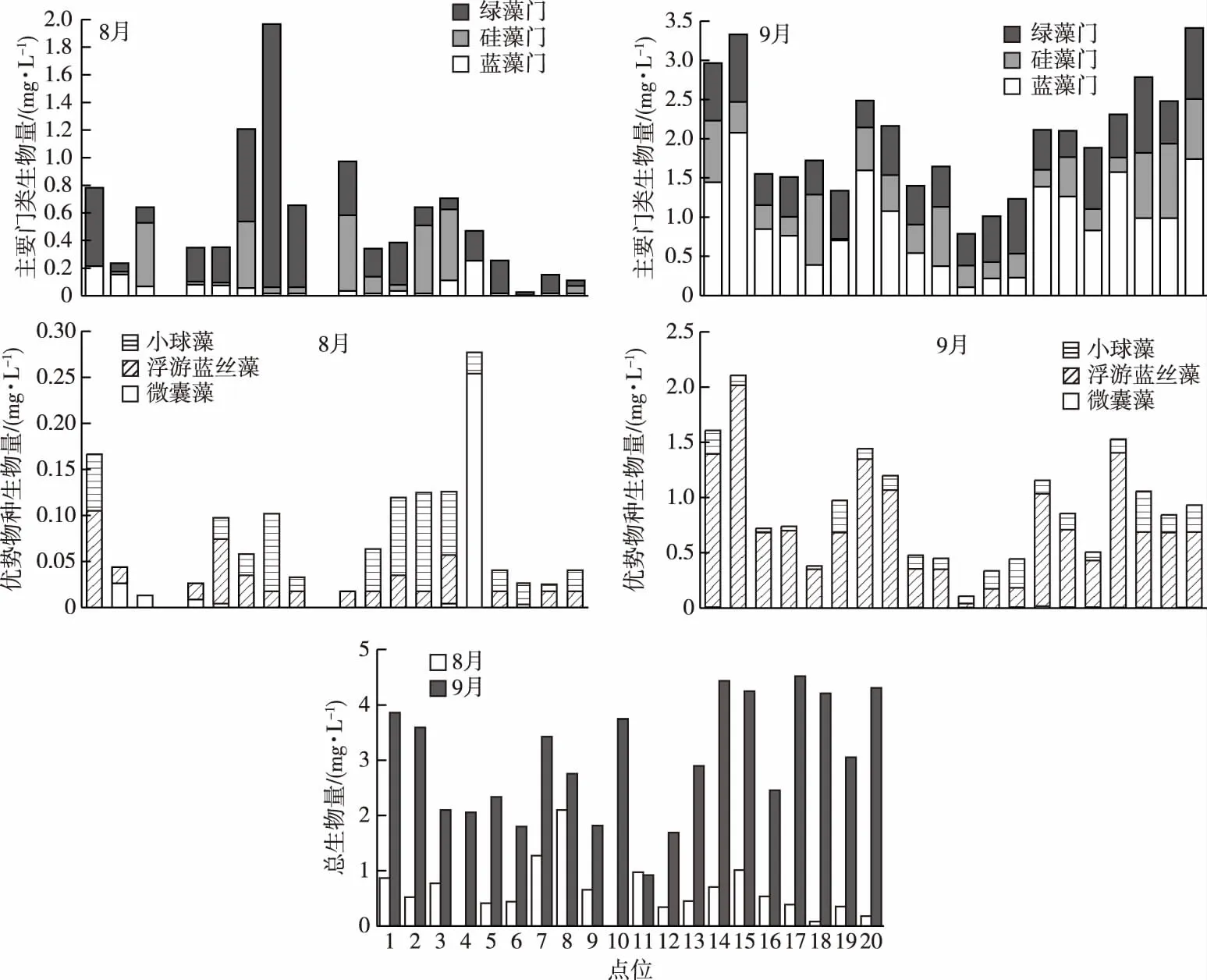
图2 不同月份骆马湖浮游植物总生物量、主要门类生物量和优势物种生物量分布Fig.2 Phytoplankton distribution of total biomass,main species biomass and dominant species biomass in different months in Luoma Lake
8月小球藻生物量(0.613 mg·L-1)> 浮游蓝丝藻(0.473 mg·L-1)> 微囊藻(0.314 mg·L-1),优势属间生物量相差不大,但9月优势属生物量相差较大,浮游蓝丝藻生物量最高(14.91 mg·L-1),小球藻次之(2.882 mg·L-1),微囊藻最少(0.074 mg·L-1)(图2)。从空间分布来看,8月全湖浮游植物分布差异较大,其中,3~15#点位绿藻门、硅藻门生物量较高,2、16#点位微囊藻属生物量明显高于其他点位。9月绿藻门、硅藻门生物量分布差异不大,蓝藻门生物量大体上为1~3、7~8、14~20#点位较高,4~6、9~13#点位较低,浮游蓝丝藻属生物量分布与之类似。
2.3 浮游植物多样性指数及NMDS分析
骆马湖8—9月浮游藻类Shannon-Wiener指数在0.60~2.60之间,平均值为1.75,Simpson指数在0.26~0.78之间,平均值为0.74,Pielou指数在0.37~0.96之间,平均值为0.79(图3)。
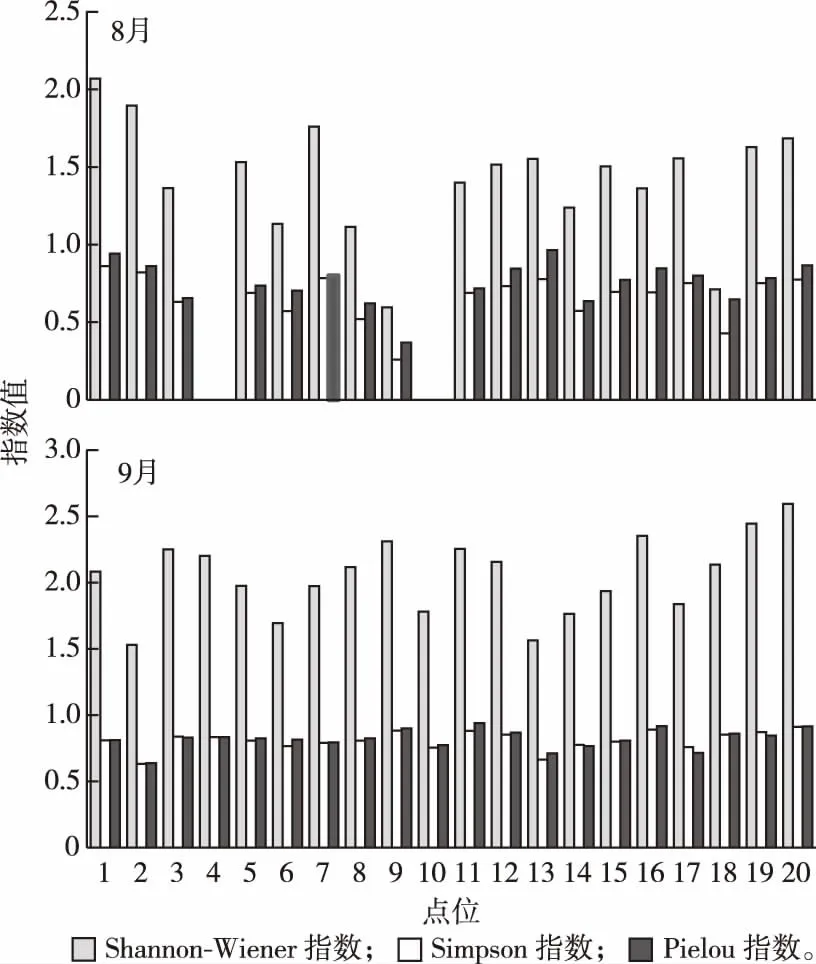
图3 骆马湖夏季藻类多样性时空分布Fig.3 Temporal and spatial distribution of algal diversityin summer in Luoma Lake
9月Shannon-Wiener指数显著高于8月(P<0.05),Simpson指数个别点位显著高于8月(P<0.05),Pielou 指数与8月相比无显著差异(P>0.05)。全湖各采样点位之间Shannon-Wiener指数、Simpson指数和Pielou指数均无显著差异(P>0.05),但3者之间均呈显著相关(P<0.05)。
图4显示,8、9月骆马湖各点位浮游藻类组成差异明显,9月各点位藻类组成相似性较大,分布较集中,8月各点位藻类组成相似性更小,分布较分散。
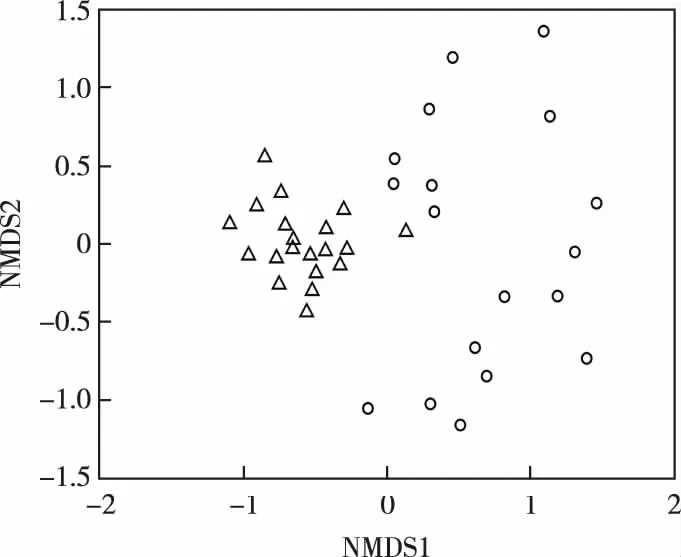
圆圈表示8月点位,三角形表示9月点位。
2.4 浮游植物与环境因子的关系
2.4.1骆马湖夏季主要环境因子差异分析
通过方差分析和多重比较发现,骆马湖8月(28.9 ℃)、9月(25.4 ℃)平均水温有显著差异(P<0.05),但空间上无显著差异。ρ(DO)在时间和空间上均无显著差异。9月透明度(75.25±12.92)显著低于8月(88.45±22.96)(P<0.05)。ρ(TN)平均值在8、9月之间无显著差异,在空间上1~6#点位显著低于7~20#点位(P<0.05)(图5)。9月ρ(TP)平均值〔(0.38±0.12) mg·L-1〕显著高于8月〔(0.23±0.12) mg·L-1〕(P<0.05),在空间上无显著差异(图5)。

图5 夏季骆马湖不同点位总氮(TN)和总磷(TP)浓度
2.4.2浮游植物藻蓝蛋白(PC)和TP浓度及总氮总磷比〔ρ(TN)∶ρ(TP)〕的变化关系
浮游植物PC与氮磷比和TP相关性见图6。
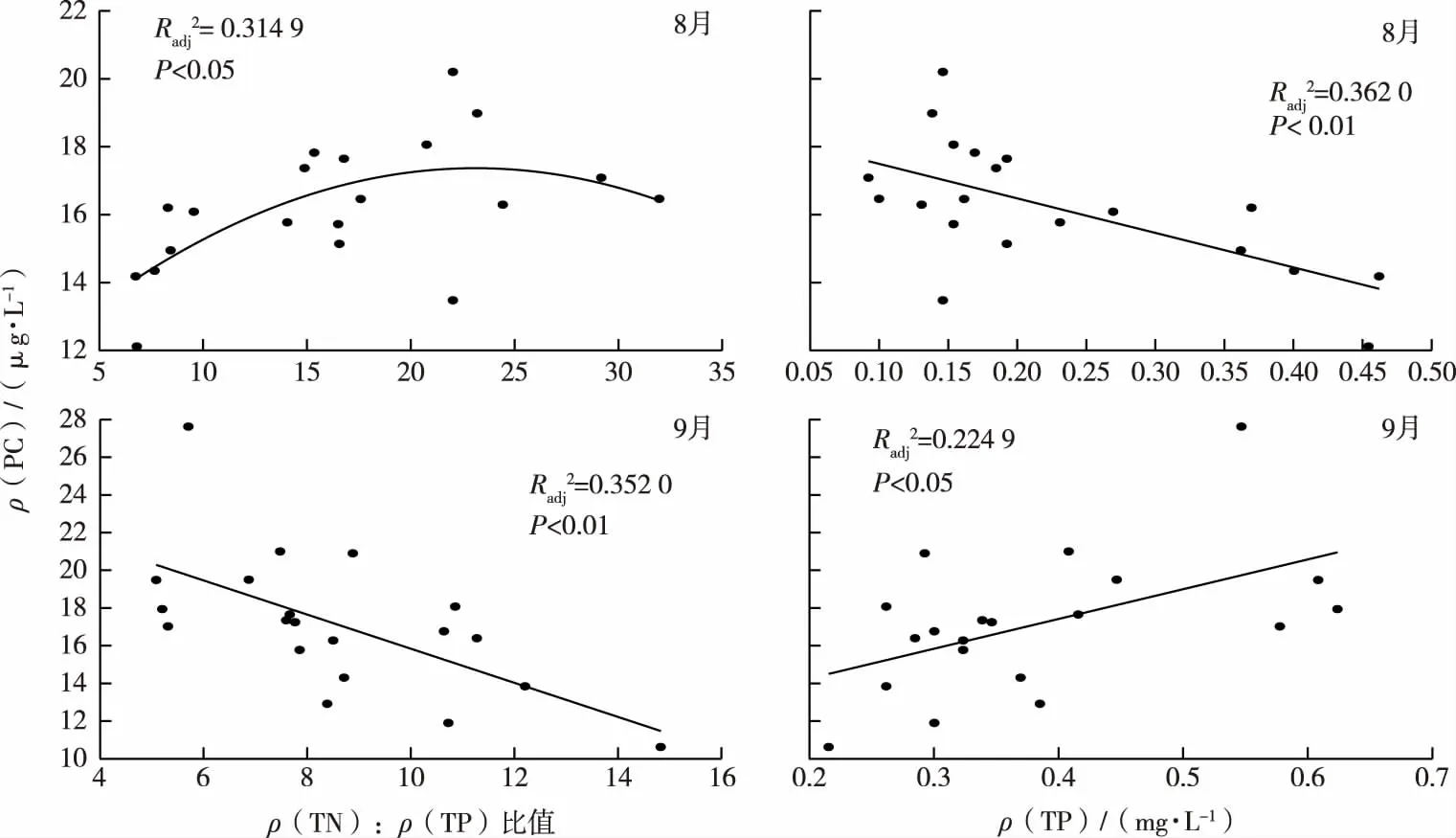
图6 夏季骆马湖藻蓝蛋白与ρ(TN)∶ρ(TP)比值和TP浓度的相关性
如图6所示,8月全湖不同点位PC浓度分别与ρ(TN)∶ρ(TP)比值和TP浓度呈显著正相关(P<0.05)和显著负相关(P<0.01),9月不同点位PC浓度分别与ρ(TN)∶ρ(TP)比值和TP浓度呈显著负相关(P<0.01)和显著正相关(P<0.05)。
2.5 浮游植物群落与环境因子的RDA分析
通过RDA分析(图7)发现,在选取的主要环境因子中,经蒙特卡罗检验,有3个因子与浮游植物分布显著相关(P<0.05)。3个显著的环境因子(箭头表示)共同解释了浮游植物群落变化的28.16%。RDA1和RDA2分别解释了浮游植物群落变化的18.9%和5.1%。
3 讨论
3.1 骆马湖浮游植物群落组成与生物量变化
自20世纪以来,骆马湖富营养化程度正在加剧[6],浮游植物丰度在逐年增加(表2)。浮游植物细胞密度越高,表明湖泊营养化程度越高。优势类群占比可以用于指示湖泊的污染状态[16],如中等营养水平湖泊中蓝藻、绿藻、硅藻和隐藻都占有一定比例,富营养型湖泊则常以绿藻、蓝藻类占优势[13]。
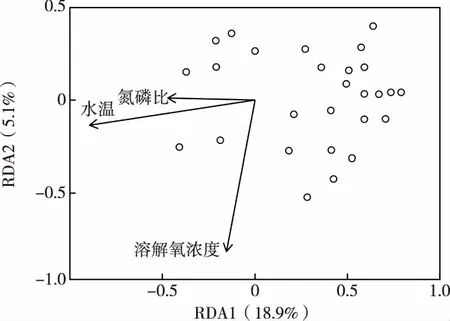
图7 骆马湖夏季环境因子与浮游植物组成的 RDA排序图
表2 近年来骆马湖浮游植物调查结果比较
Table 2 Comparison of phytoplankton survey of Luoma Lake in recent years
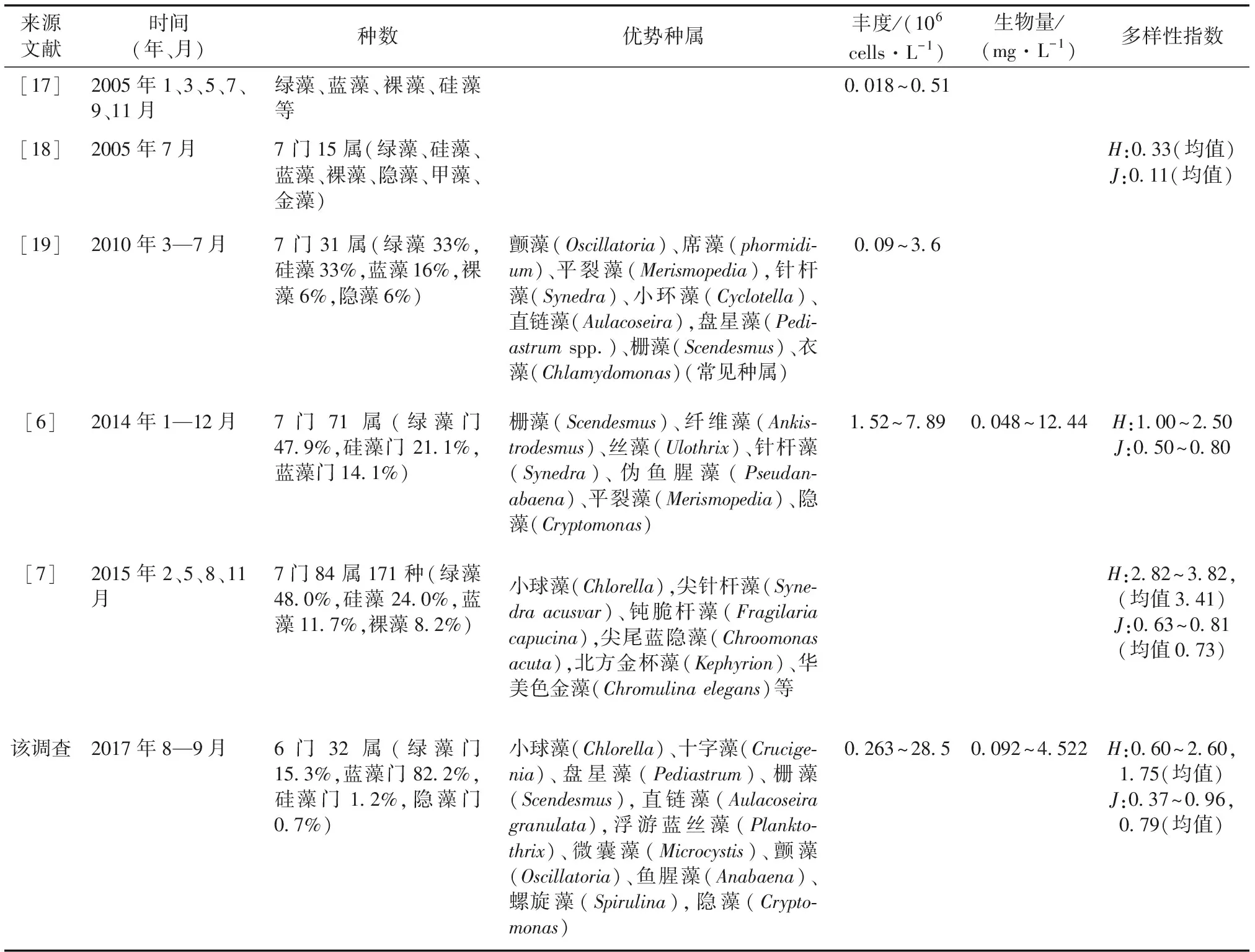
来源文献时间(年、月)种数优势种属丰度/(106 cells·L-1)生物量/(mg·L-1)多样性指数 [17]2005年1、3、5、7、9、11月绿藻、蓝藻、裸藻、硅藻等0.018~0.51[18]2005年7月7 门15属(绿藻、硅藻、蓝藻、裸藻、隐藻、甲藻、金藻)H:0.33(均值)J:0.11(均值)[19]2010年3—7月7 门31属(绿藻33%,硅藻33%,蓝藻16%,裸藻6%,隐藻6%)颤藻(Oscillatoria)、席藻(phormidi-um)、平裂藻(Merismopedia),针杆藻(Synedra)、小环藻(Cyclotella)、直链藻(Aulacoseira),盘星藻(Pedi-astrum spp.)、栅藻(Scendesmus)、衣藻(Chlamydomonas)(常见种属)0.09~3.6[6]2014年1—12月7门71属(绿藻门 47.9%,硅藻门 21.1%,蓝藻门14.1%)栅藻(Scendesmus)、纤维藻(Ankis-trodesmus)、丝藻(Ulothrix)、针杆藻(Synedra)、伪鱼腥藻(Pseudan-abaena)、平裂藻(Merismopedia)、隐藻(Cryptomonas)1.52~7.890.048~12.44H:1.00~2.50J:0.50~0.80[7]2015年2、5、8、11月7门84属171种(绿藻48.0%,硅藻24.0%,蓝藻11.7%,裸藻8.2%)小球藻(Chlorella),尖针杆藻(Syne-dra acusvar)、钝脆杆藻(Fragilaria capucina),尖尾蓝隐藻(Chroomonas acuta),北方金杯藻(Kephyrion)、华美色金藻(Chromulina elegans)等H:2.82~3.82,(均值3.41)J:0.63~0.81(均值0.73) 该调查2017年8—9月6门32属(绿藻门 15.3%,蓝藻门82.2%,硅藻门1.2%,隐藻门0.7%)小球藻(Chlorella)、十字藻(Crucige-nia)、盘星藻(Pediastrum)、栅藻(Scendesmus),直链藻(Aulacoseira granulata),浮游蓝丝藻(Plankto-thrix)、微囊藻(Microcystis)、颤藻(Oscillatoria)、鱼腥藻(Anabaena)、螺旋藻(Spirulina),隐藻(Crypto-monas)0.263~28.50.092~4.522H:0.60~2.60,1.75(均值)J:0.37~0.96,0.79(均值)
H为Shannon-Wiener指数;J为Pielou指数。
此次调查得到的浮游植物生物密度均高于以往调查结果(表2[6-7,17-19]),藻类优势属种类数也与以往调查结果不同,如2014年骆马湖夏、秋两季优势属为裸藻、伪鱼腥藻、纤维藻和隐藻[6],此次调查优势属为浮游蓝丝藻、微囊藻、小球藻和十字藻(Y≥0.02),且丝状蓝藻明显增多。因此,与以往调查结果中优势属和浮游植物细胞密度做对比,结果表明骆马湖富营养化程度仍然在加剧。
骆马湖8月总生物量、主要门类生物量及优势属生物量分布没有明显规律。9月总生物量呈西南区域明显高于东北区域的趋势,与杨士建[14]的调查结果相似。9月浮游植物总丰度为8月的87.4倍,这主要是由于9月浮游蓝丝藻大量增殖所致,且此次调查表明丝状蓝藻占比较以往调查结果明显增加。浮游蓝丝藻是水华蓝藻的重要常见种属。浮游蓝丝藻属(又称浮丝藻属)是1988年ANAGNOSTIDIS等从颤藻(Oscillatoria)中分离出来的,以阿氏浮丝藻(Planktothrixagardhii)〔阿氏颤藻(Oscillatoriaagardhii)〕作为模式种[20]。而在中国一直未见有关浮游蓝丝藻属的报道,直到2003年陈宇炜等[21]介绍了包括Planktothrix的3个浮游蓝藻属的国际最新分类系统,并将Planktothrix称为浮游蓝丝藻属。在欧洲的很多水体,浮游蓝丝藻常年处于优势地位,且产生很高毒素,带来众多环境问题,是目前欧洲学者蓝藻研究中的重点之一。关于浮游蓝丝藻的报道主要集中在欧洲,且研究重点在其毒素方面[20]。近年来,在我国各地也有发现,很多水体中浮游蓝丝藻占据优势地位。目前,这些水体的毒素监测报道很少。由于骆马湖是宿迁市的重要饮用水源地,承担着宿迁市区供水功能。此次调查到的骆马湖中浮游蓝丝藻是否产毒,还需后续研究。
3.2 骆马湖浮游植物群落多样性
通过方差分析和多重比较,发现骆马湖夏季生物多样性指数不存在显著的空间差异(P>0.05)。9月骆马湖Shannon-Wiener指数显著高于8月(P<0.05),说明在夏季骆马湖生物多样性增加,种类明显增多,丰富度明显增加。此与NMDS分析结果一致。Simpson指数和Pielou 指数均变化不大,且两者相关系数为0.817,说明骆马湖夏季全湖浮游植物种类分布比较均匀。Shannon-Wiener指数与Simpson指数和Pielou指数的相关系数分别为0.945和0.630,由此可以推测,骆马湖夏季物种多样性指数的变动,可能更多地是由于种类数的变动而非均匀度的变化。
典型浮游植物的Shannon-Wiener指数基本在2.4~2.6之间[22]。此次调查中骆马湖Shannon-Wiener指数处于0.60~2.60之间,说明有些点位浮游植物Shannon-Wiener指数明显偏低。该调查结果与彭凯等[6]对骆马湖的调查结果相似,与田家怡等[23]于2005年的调查结果相比偏高,与张小明等[7]于2015年对骆马湖北部的调查结果相比偏低,可能与调查点位不同有关。与其他湖泊相比,与邻近的南四湖[24]相似,与云贵高原13个湖泊的Shannon-Wiener指数[13]相差较远,比洪泽湖浮游植物的Shannon-Wiener指数[6]偏低。
3.3 环境因子对骆马湖浮游植物组成的影响
影响浮游藻类种群的因素有很多,如水流速度、水温、营养盐、生物因素等。在河流、湖泊和水库中,水力滞留时间的长短决定了浮游藻类的种类组成和生物量[18]。此次调查结果表明8月骆马湖湖区北部绿藻门、硅藻门占比较高,其中,绿藻门盘星藻、空球藻和实球藻较多,硅藻门直链藻属较多,而相对体积质量较小的蓝藻门占比较低,彭凯等[8]也发现类似现象。骆马湖来水主要为上游的沂河水系,皂河闸由于常年处于关闭状态,出水以新沂河-嶂山闸为主,南部地区水流相对较为平缓[8]。由于硅藻个体较大,适合生长在水力滞留时间短、水流流速快的水体中,而蓝藻适合在水力滞留时间长的水体中生长[18]。因此,8月骆马湖藻类群落构成主要与水体水力滞留时间短和流速较大有关。9月主要是蓝藻门的分布差异较大,其中,1~3#(洋河闸)、7~8#(采砂区)、14~20#(围网养殖)点位蓝藻门生物量较高,说明这些区域水体营养物质含量较高,水质较差。采砂导致沉积物中蓄积的营养物质释放至水体中,养殖投饵也会增加水体的营养负荷,而洋河闸水质较差可能受捕鱼船只停靠、渔货销售生活区污染的影响;4~6#(嶂山闸)、9~13#(围网养殖、采砂区)点位蓝藻门生物量较低。13#点位位于主采砂区,其蓝藻生物量较低,可能是采砂导致水体过于浑浊而抑制了包括蓝藻在内的所有藻类的生长,其他点位较低可能是调查期间恰好处于开闸放水期,带走了大量营养物质。骆马湖为典型的过水性湖泊,其水质变化是对区域内人类活动强烈程度的反馈[25]。因此,骆马湖现阶段水质状况与夏季人类活动加剧有关。
蓝藻中微囊藻明显占优势的点位为8月的2#和16#,其他大部分区域均为浮游蓝丝藻占优势,尤其是9月占绝对优势。8月TP浓度与PC浓度呈显著负相关,2#和16#点位TP浓度在全湖中较低。而微囊藻具有较高的磷吸收最大摄取速率,比其他藻类有更强的储存磷的能力[26]。因此,2#和16#点位微囊藻占优势的结果可能是原有TP浓度较高所致。另外,浮游动物对浮游藻类的捕食作用具有选择性,不同类型藻类受捕食作用的影响是不同的。研究表明,捕食性微小动物僧帽触口虫对孟氏浮游蓝丝藻有明显的控制作用[27]。由于僧帽触口虫对浮游蓝丝藻的捕食,反而使微囊藻生长更旺盛。因此,浮游动物牧食其他藻类而非微囊藻也可能是2#和16#点位微囊藻占优势的原因之一。微囊藻最佳生长温度高于其他藻类,如太湖微囊藻最适生长温度为30~35 ℃[26]。金相灿等[28]研究表明浮游蓝丝藻比微囊藻更适合低温生长。浮游蓝丝藻属是从颤藻属中分离出来的新属,很多特性与颤藻相似,在水温约为25 ℃时最易暴发[29]。而骆马湖9月平均水温为25.4 ℃,更适合浮游蓝丝藻的生长,这可能是9月浮游蓝丝藻占绝对优势的原因之一。
磷是浮游植物生长繁殖所必需的营养元素,是影响浮游植物群落组成的重要环境因子之一。湖泊的富营养化,尤其是水体中磷浓度的增加,通常会导致水体中浮游植物种群组成朝着形成水华的蓝藻演替。如太湖梅梁湾6月浮游蓝丝藻属占据主导地位时,TP浓度高于其他月份[30]。当磷浓度很高时,比较容易出现浮游动物对绿藻的捕食,遏制绿藻的生长,促使蓝藻快速生长形成优势种[31]。当氮、磷营养盐浓度严重超标时,较小的氮磷比〔ρ(TN)∶ρ(TP)≈10〕有利于形成拟浮丝藻水华[29]。拟浮丝藻属和浮游蓝丝藻属为相近属[20]。骆马湖9月ρ(TN)∶ρ(TP)约为12.5∶1。因此,9月浮游蓝丝藻生物量的增加可能与ρ(TN)∶ρ(TP)比值较低及TP浓度增加有关。
另外,薛迪[32]调查结果显示南四湖夏、秋季水体中蓝藻门的伪鱼腥藻占据优势地位,此次调查中的浮游蓝丝藻与其都是丝状蓝藻。在水体中丝状蓝藻藻丝游离漂浮,利用自身的悬浮机制,能够获得更多的营养和光照[32]。流速较高的水体不利于相对体积质量较小的细胞停留,一般在流水系统中蓝藻门与硅藻门较多[33],但微囊藻的悬浮机制与水体的稳定性密切相关[34],在水力滞留时间短的水体浮游植物组成中会失去竞争优势[35],而丝状体在流水和浑浊水体更占优势[36]。骆马湖是过水性湖泊,径流量较大,流速较快,而且常年采砂作业导致骆马湖每遇大风之后水质浑浊,且笔者研究中9月骆马湖水体透明度与PC浓度呈显著负相关(P<0.05,数据未列出)。因此,水体流速较快和透明度较低也可能是浮游蓝丝藻占优势的原因之一。综上所述,9月骆马湖浮游蓝丝藻占优势,可能是由其本身的生理特点以及温度、营养盐、水体流速、透明度及其他生物等诸多环境因素所引发。
RDA分析主要针对环境因子与浮游植物群落结构变化的关系,在自然条件下,多个环境因子之间往往是相互作用,共同对浮游植物群落结构起作用。蒋伊能[37]通过RDA分析发现营养盐、水温和离子类环境数据共同作用时解释了抚仙湖浮游植物群落结构变化的25%,未解释的为75%。邻近的南四湖夏季主要受水温和总磷浓度的影响,秋季主要受总氮浓度、总磷浓度和pH的影响[32]。笔者研究中RDA分析结果表明,氮磷比、水温和溶解氧浓度的共同作用解释了骆马湖夏季浮游植物群落结构变化的28.16%,未解释的为 71.84%。由于骆马湖生态环境的复杂性,其浮游植物群落结构的变化可能受到此次调查中未检测的其他水质因子、气象条件、水动力以及生物因素等的驱动。
PC是蓝藻的特征色素蛋白之一,通常被用来表征蓝藻生物量。大量研究表明,高磷负荷会导致较高的浮游植物生物量。但在笔者研究中,8月蓝藻PC浓度和TP浓度变化未显示出预期的正相关关系,可能是物理因素而不仅仅是磷决定了浮游植物密度和生物量。这种解释与ZHANG等[38]的研究结论相似,其研究表明抚仙湖浮游植物密度的主要驱动因子是物理变量,特别是在水下光照条件下,尽管总磷浓度(1.89~21.8 μg·L-1)很低。XIE等[39]在武汉东湖的围隔实验证明氮磷比无论小于还是大于29都会发生蓝藻(微囊藻)水华。笔者研究中8月ρ(TN)和ρ(TP)平均值分别为3.02和0.23 mg·L-1,已经充分满足了蓝藻生长的需要[40],说明ρ(TN)∶ρ(TP)比值已经不是影响8月蓝藻生长的主要因子。研究表明,较低的ρ(TN)∶ρ(TP)比值是蓝藻水华产生的结果[39],但笔者研究中8月蓝藻生物量较低,可能没有足够的生物量来引发ρ(TN)∶ρ(TP)比值降低。当氮、磷浓度严重超标时,拟浮丝藻大规模的爆发还会使ρ(TN)∶ρ(TP)比值下降[29],因而9月PC浓度与ρ(TN)∶ρ(TP)比值、TP浓度的关系可能受浮游蓝丝藻大量增殖的影响较大。因此,蓝藻PC与TP浓度及ρ(TN)∶ρ(TP)比值的关系在8月和9月相反可能主要是由于8月蓝藻不占优势及其他物理因素所致。
4 结论
通过对骆马湖夏季浮游植物的调查,分析骆马湖水质现状及水体营养状态,探讨骆马湖浮游植物群落结构变化与环境因子的关系,得出以下结论:
(1)与往期骆马湖调查结果相比,骆马湖夏季多样性指数差异不大,细胞丰度明显增加,优势种较集中于蓝藻门和绿藻门,尤其是浮游蓝丝藻明显增多。从近几年优势属种类、藻类细胞密度变化来看,骆马湖富营养化程度依然在加剧。
(2)RDA分析结果表明,水温、溶解氧浓度和氮磷比的共同作用解释了骆马湖夏季浮游植物群落结构变化的28.16%。其中,骆马湖浮游植物群落结构的变化受采砂、围网养殖及夏季人类活动影响较大。骆马湖夏季总体为浮游蓝丝藻占优势,可能是由浮游蓝丝藻本身的生理特点以及温度、营养盐、水体流速、透明度及其他生物等诸多环境因素所引发。而比浮游蓝丝藻生长速率高的微囊藻几乎不占优势,说明骆马湖在调查期间可能属于微囊藻生长受抑水体,而骆马湖水体浮游蓝丝藻水华暴发几率会增大。

