柠檬醛对阪崎克罗诺肠杆菌环境压力耐受能力及抗生素敏感性的影响
康慎敏,刘志远,孟宇杰,程晓萌,涂俊宏,温啓吾,郭 都,石 超*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
阪崎克罗诺肠杆菌(Cronobacter sakazakii)是一种周生鞭毛、无芽孢、能运动、兼性厌氧的革兰氏阴性条件致病菌,属肠杆菌科[1]。它能够从自然界不同的环境中被分离出来,包括土壤、奶粉工厂、奶酪、肉类、蔬菜等[2]。婴幼儿配方奶粉是阪崎克罗诺肠杆菌感染新生儿最常见的载体[3],阪崎克罗诺肠杆菌感染新生儿后易引起坏死性小肠结肠炎、败血症和脑膜炎等疾病,致死率达33%~80%[4]。感染后的幸存儿童易出现严重的神经系统后遗症,包括癫痫、脑脓肿、脑积水和发育迟缓等[5]。
阪崎克罗诺肠杆菌在婴幼儿乳粉污染及传播的途径中,需要经历干燥(干燥贮存环节)和高温环境(复原冲调环节)。研究表明,阪崎克罗诺肠杆菌具有极强的耐干燥能力,它能够在干燥的婴幼儿乳粉中存活2.5 a及以上[6]。同时,阪崎克罗诺肠杆菌还具有良好的温度适应能力,能在一定的时间范围内耐受60 ℃处理[7]。这使得其能够经受乳粉的冲调高温并进入人体从而增大感染风险。在进入人体后,胃酸和肠道胆盐是阪崎克罗诺肠杆菌必须应对的两大生存压力介质。有研究表明阪崎克罗诺肠杆菌能在pH 3.2~4.5的环境中生长[8-9],并且与成年人相比,婴幼儿的胃酸pH值较高,这使得阪崎克罗诺肠杆菌更容易耐受婴幼儿胃酸从而进入肠道。肠道中的胆盐能够通过破坏细胞膜中的磷脂结构、降解细胞内的蛋白等多种方式发挥其对细菌的抑杀作用[10],而阪崎克罗诺肠杆菌能够在肠道中存活并引发感染,说明其对胆盐具有一定的耐受能力。
近年来,部分研究者将目光投向于使用植物源活性物质控制食源性致病菌。柠檬醛是柠檬草油的主要活性成分,存在于多种植物的叶子和果实中[11],具有广谱抗菌作用,已被美国食品药品监督管理局评价为公认安全的食品成分(GRAS 182.60)而应用于多种食品。本研究团队前期已报道柠檬醛对阪崎克罗诺肠杆菌的生长及毒力因子具有良好的抑制作用[12],但其对阪崎克罗诺肠杆菌环境耐受能力的影响鲜有研究。
本研究以柠檬醛为研究对象,以阪崎克罗诺肠杆菌为作用主体,首先采用液体稀释法测定柠檬醛对阪崎克罗诺肠杆菌的亚抑制浓度;随后分别探究亚抑制浓度的柠檬醛对阪崎克罗诺肠杆菌干燥、渗透压、热、酸和胆盐耐受能力的影响;同时利用E-test®法检测柠檬醛作用后阪崎克罗诺肠杆菌对抗生素氨苄西林与头孢西丁敏感性的变化;最后,通过实时逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RTPCR)探究柠檬醛对阪崎克罗诺肠杆菌相关耐受基因转录的影响。旨在探究柠檬醛对阪崎克罗诺肠杆菌环境压力耐受能力和抗生素敏感性的影响及可能的机理,为柠檬醛应用于食品生产加工过程中用以预防和控制阪崎克罗诺肠杆菌提供相应的理论依据。
1 材料与方法
1.1 菌株与试剂
阪崎克罗诺肠杆菌ATCC 29544、ATCC 12868购于美国模式菌株收集中心;分离菌29由西北农林科技大学食品科学与工程学院食品安全与天然产物功能实验室分离自市售婴幼儿奶粉。
柠檬醛(色谱纯,纯度≥99.2%) 德国Dr.Ehrenstorfer公司;胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、胰蛋白胨大豆肉汤(tryptone soya broth,TSB)、缓冲蛋白胨水(buffered peptone water,BPW)北京陆桥技术有限公司;山梨醇(纯度≥98%) 北京索莱宝科技有限公司;盐酸 四川西陇化工有限公司;胆盐 美国Sigma公司;E-test®氨苄西林试纸条带、头孢西丁试纸条带 意大利Liofilchem公司;其他所用有机溶剂均为国产分析纯。
1.2 仪器与设备
SPX-250B细菌生化培养箱 上海南荣实验室设备有限公司;5804R低温冷冻离心机 德国Eppendorf公司;Smart SpecTMplus分光光度计、GelDoc XR凝胶成像系统 美国Bio-Rad公司;微生物全自动生长曲线分析仪 芬兰Bioscreen公司;MK-200-1干式恒温器杭州奥盛仪器有限公司;TH2-312台式恒温振荡器上海精宏实验设备有限公司。
1.3 方法
1.3.1 菌种活化
将冻存于-80 ℃的阪崎克罗诺肠杆菌采用划线法在TSA平板上活化,挑取单菌落接种于30 mL的TSB肉汤中,将其置于37 ℃恒温摇床中培养8 h(130 r/min)后离心(5 000×g,10 min,4 ℃)。用pH 7.2磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤菌体沉淀,洗涤2 次后调整菌悬液的OD600nm为0.5(约108CFU/mL)。
1.3.2 亚抑制浓度的测定
亚抑制浓度指低于最小抑菌浓度且对微生物生长无明显抑制作用的抑菌剂浓度。柠檬醛对阪崎克罗诺肠杆菌的亚抑制浓度采用液体稀释法测定[13],按照1.3.1节方法活化菌体,调整菌液OD600nm为0.1后加入百孔蜂窝板中,加入柠檬醛使其终质量浓度为1 000、500、250、125、62.5、31.25、15.625 μg/L和0 μg/L(对照组)。将样品置于微生物全自动生长曲线分析仪中37 ℃培养24 h,每隔1 h检测600 nm波长下的光密度。以时间(h)为横坐标,菌悬液OD600nm值为纵坐标绘制生长曲线,分析确定柠檬醛对阪崎克罗诺肠杆菌的亚抑制浓度。
1.3.3 柠檬醛对阪崎克罗诺肠杆菌干燥耐受能力的影响
按照1.3.1节方法分别制备ATCC 29544、ATCC 12868和分离菌29的菌悬液,调整菌悬液OD600nm为0.5,3 种菌悬液等量混匀后稀释10 倍制成混合菌悬液。在柠檬醛质量浓度为31.250 μg/L和15.625 μg/L的TSB中培养混合菌液10 h后离心(5 000×g,5 min,4 ℃),用PBS清洗菌体2 次,制备亚抑制浓度柠檬醛处理后的菌体。对照组为在不添加柠檬醛的TSB中培养的菌体。
柠檬醛对阪崎克罗诺肠杆菌干燥耐受能力的影响测定参照Al-Nabulsi等[14]的方法进行。使用PBS调整菌悬液的OD600nm为1.5,吸取50 μL菌悬液并均匀加于培养皿底部,40 ℃烘干2 h后转移至干燥器中(25 ℃),分别干燥0、12、24、48、72、96、120、144 h取出样品,使用0.2%缓冲蛋白胨水收集菌体,稀释涂布于TSA培养基(每组3 个平行),37 ℃培养24 h后记录细菌总数。实验结果表示为细菌存活率(N/N0),其中N表示在25 ℃干燥不同时间后菌体数量,N0表示在25 ℃干燥处理前的起始菌体数量。
1.3.4 柠檬醛对阪崎克罗诺肠杆菌渗透压耐受能力的影响
参照Fakruddin等[8]的方法进行。按照前述1.3.3节方法制备亚抑制浓度柠檬醛处理后的菌体,调整菌悬液的OD600nm为0.5。吸取100 μL菌悬液加入10 mL含有山梨醇(75 g/100 mL)的TSB肉汤中,置于37 ℃恒温培养箱中培养。分别于0、6、12、24、36 h将样品稀释涂布于TSA培养基(每组3 个平行)培养24 h后记录细菌总数。实验结果表示为细菌存活率(N/N0),其中N表示菌株耐受渗透压不同时间后菌体数量,N0表示菌株未耐受渗透压的起始菌体数量。
1.3.5 柠檬醛对阪崎克罗诺肠杆菌热耐受能力的影响
参照Shi Chao等[15]的方法进行。按照1.3.3节方法制备亚抑制浓度柠檬醛处理后的菌体(OD600nm=0.5)。吸取100 μL菌悬液加入10 mL TSB肉汤中,置于干式恒温加热器中,探究柠檬醛对阪崎克罗诺肠杆菌热(50、55、60 ℃)耐受能力的影响。其中,50 ℃热处理0、20、40、80、100 min,55 ℃热处理0、10、20、40、60、90 min,60 ℃热处理0、5、10、20、30、40 min后,将样品稀释涂布于TSA培养基培养24 h后记录细菌总数。实验结果表示为细菌存活率(N/N0),其中N表示菌株耐受热不同时间后的菌体数量,N0表示菌株未耐受热的起始菌体数量。
1.3.6 柠檬醛对阪崎克罗诺肠杆菌酸耐受能力的影响
参照Amalaradjou等[16]的方法进行。使用HCl溶液调整TSB肉汤的pH 3.3,吸取100 μL的1.3.3节中菌悬液(OD600nm=0.5)加入10 mL酸化的TSB肉汤中,将样品置于37 ℃恒温培养箱中,分别于0、10、20、40、60 min将样品涂布于TSA培养基培养后记录细菌总数。实验结果表示为细菌存活率(N/N0),其中N表示菌株耐受酸不同时间后的菌体数量,N0表示菌株未耐受酸的起始菌体数量。
1.3.7 柠檬醛对阪崎克罗诺肠杆菌胆盐耐受能力的影响
吸取100 μL的1.3.3节中菌悬液(OD600nm=0.5)加入10 mL含有2%胆盐[17]的TSB肉汤中,置于37 ℃恒温培养箱中,分别于0、2、4、6、8、12 h时取出样品,将样品稀释涂布于TSA培养基培养24 h后记录细菌总数。实验结果表示为lg(N/N0),N表示菌株耐受胆盐不同时间后的菌体数量,N0表示菌株未耐受胆盐的起始菌体数量。
1.3.8 柠檬醛对阪崎克罗诺肠杆菌氨苄西林和头孢西丁耐受能力的影响
参照Zanini等[18]选用的E-test®方法进行测定,并作一定修改。按照1.3.3节方法制备亚抑制浓度柠檬醛处理后的菌体,使用TSB重悬浮并将菌体稀释1 倍,将菌液均匀涂抹在TSA平板上,待菌液干燥后放置抗生素试纸条,氨苄西林和头孢西丁的质量浓度为0.016~256 μg/mL。将样品置于37 ℃培养箱中培养24 h。抗生素抑菌圈与试纸条相交处的刻度值即为氨苄西林和头孢西丁对阪崎克罗诺肠杆菌的最小抑菌浓度。
1.3.9 柠檬醛对阪崎克罗诺肠杆菌耐受基因转录的影响
参照韩淇安等[19]的方法进行。按照1.3.1节方法活化阪崎克罗诺肠杆菌ATCC 29544,加入柠檬醛使其质量浓度为31.250、15.625 μg/L和0 μg/L,置于37 ℃摇床培养10 h(130 r/min)。将菌悬液离心(13 400×g,2 min,4 ℃)后弃去上清液,使用细菌总RNA提取试剂盒提取总RNA。使用超微量核酸分析仪测定RNA的纯度、浓度,当A260nm/A280nm在1.8~2.1之间时说明提取得到的RNA纯度较高,无蛋白质、化学大分子残留,此时将总RNA浓度调成一致。随后,使用Takara PrimeScriptTMRT reage nt Kit(Perfect Real Time)反转录试剂盒将总RNA反转录为cDNA并保存于-20 ℃。
以ESA-04030a为内参基因,选取与阪崎克罗诺肠杆菌环境耐受能力相关的10 个功能基因(表1)作为目标,利用SYBR Green I染料法进行实时监测,选择两步法PCR扩增程序进行扩增。采用2-ΔΔCt法分析目标基因的相对表达量。

表1 实时RT-PCR所用的引物信息Table 1 Information about primers used for real-time RT-PCR
1.4 数据处理
数据以 ±s表示(n=3),使用SPSS软件(version 19.0,SPSS,Inc.,Chicago,IL)对数据进行统计分析,采用LSD法检验结果间的显著性,P<0.05,差异显著;P<0.01,差异极显著。
2 结果与分析
2.1 柠檬醛对阪崎克罗诺肠杆菌的亚抑制浓度
由图1可知,柠檬醛对阪崎克罗诺肠杆菌的抑制效果呈现质量浓度依赖性。当柠檬醛质量浓度高于500 μg/L时,阪崎克罗诺肠杆菌不能在TSB中生长;当柠檬醛质量浓度低于31.25 μg/L时,柠檬醛对阪崎克罗诺肠杆菌生长无明显抑制作用。因此,本研究选择31.25 μg/L和15.625 μg/L为柠檬醛对阪崎克罗诺肠杆菌的亚抑制浓度并为后续实验所用。
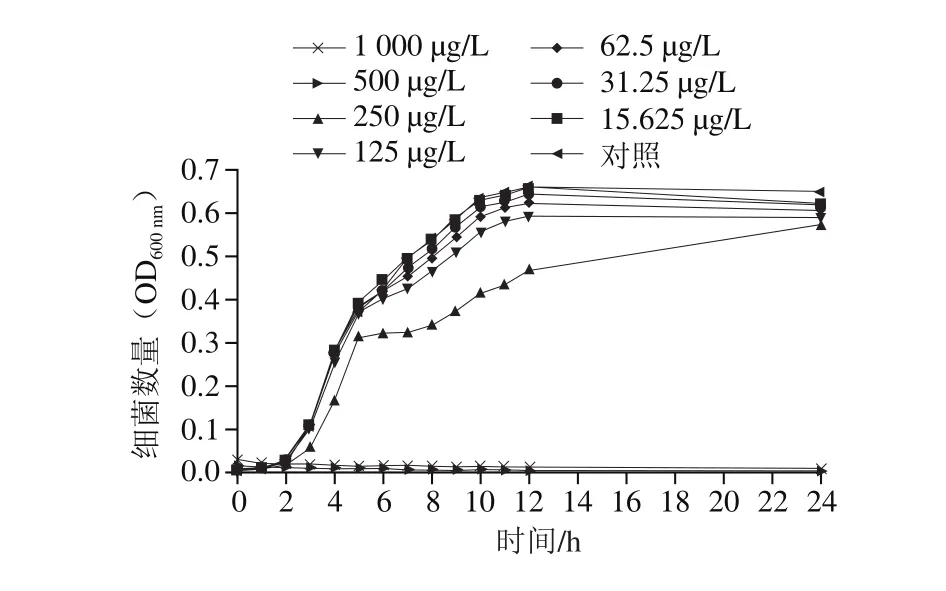
图1 柠檬醛对阪崎克罗诺肠杆菌生长曲线的影响Fig. 1 Effects of citral on growth curve of C. sakazakii
2.2 柠檬醛对阪崎克罗诺肠杆菌干燥耐受能力的影响
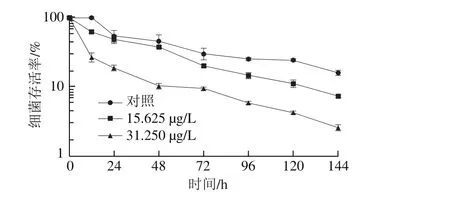
图2 柠檬醛处理对阪崎克罗诺肠杆菌干燥耐受能力的影响Fig. 2 Effects of citral on desiccation tolerance of C. sakazakii
由图2可知,柠檬醛能显著降低阪崎克罗诺肠杆菌的干燥耐受能力。未经柠檬醛作用的阪崎克罗诺肠杆菌(对照组)在耐受干燥12 h后存活率与0 h无明显差异,亚抑制浓度柠檬醛处理菌体在耐受干燥12 h后存活率明显下降,且与对照组相比,随着干燥作用时间延长,经柠檬醛作用的菌体存活率下降较快。干燥处理144 h后,经质量浓度为31.250 μg/L和15.625 μg/L柠檬醛处理的阪崎克罗诺肠杆菌存活率分别约为对照组的16%和46%。
2.3 柠檬醛对阪崎克罗诺肠杆菌渗透压耐受能力的影响
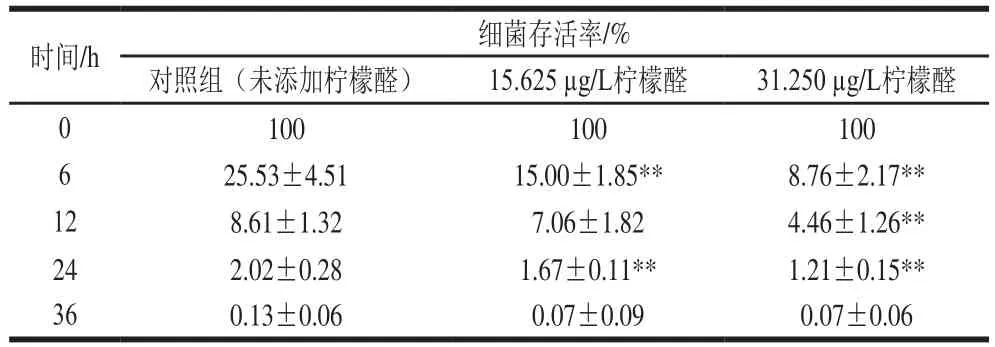
表2 柠檬醛处理对阪崎克罗诺肠杆菌渗透压耐受性的影响Table 2 Effects of citral on osmotic pressure tolerance of C. sakazakii
由表2可知,未经柠檬醛作用的样品(对照组)经75 g/100 mL的山梨醇处理6 h后细菌存活率为25.53%,经31.250 μg/L和15.625 μg/L柠檬醛处理后阪崎克罗诺肠杆菌存活率仅为对照组的34%和59%。75 g/100 mL山梨醇作用24 h后,亚抑制浓度柠檬醛处理菌体存活率低于对照组(P<0.01)。高渗透压处理36 h后,亚抑制浓度柠檬醛处理菌体存活率与对照组无显著差异(P>0.05)。在75 g/100 mL的山梨醇处理下,柠檬醛对阪崎克罗诺肠杆菌耐受渗透压的能力有明显的抑制效果,且随着柠檬醛质量浓度的升高,其对阪崎克罗诺肠杆菌渗透压耐受能力的抑制作用越显著。
2.4 柠檬醛对阪崎克罗诺肠杆菌热耐受能力的影响
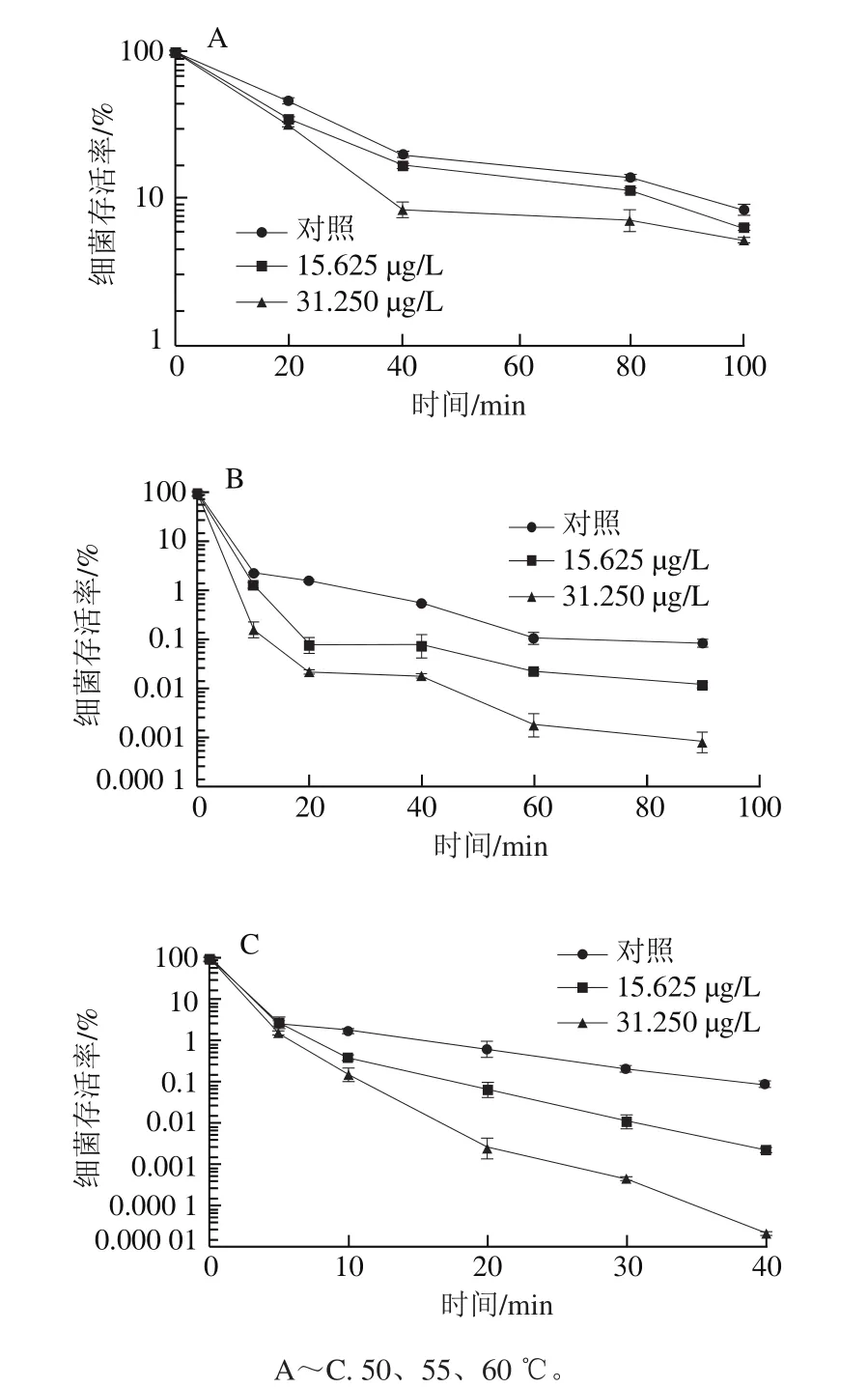
图3 不同温度条件下柠檬醛对阪崎克罗诺肠杆菌热耐受能力的影响Fig. 3 Effects of citral on heat tolerance of C. sakazakii
由图3A可知,加热处理使菌体存活率显著下降。与未经柠檬醛作用的阪崎克罗诺肠杆菌(对照组)相比,经质量浓度为31.250 μg/L柠檬醛处理的菌体在50 ℃处理40 min后存活率显著降低(P<0.05)。经50 ℃处理100 min后,经柠檬醛作用的阪崎克罗诺肠杆菌的细菌存活率与对照组相比均存在显著差异(P<0.05)。
由图3B可知,未经柠檬醛作用的菌体(对照组)在55 ℃加热60 min后细菌存活率为0.11%,90 min时的细菌存活率与60 min间无显著性差异(P>0.05)。加热90 min后,经质量浓度为15.625 μg/L柠檬醛作用的菌体存活率明显低于对照组,约为对照组的14%,经质量浓度为31.250 μg/L柠檬醛作用的菌体与对照组相比多下降了2 个数量级。
图3C显示,未经柠檬醛作用和亚抑制浓度柠檬醛处理的菌体经60 ℃加热0~5 min内细菌存活率无显著差异(P>0.05)。加热10 min时,3 组阪崎克罗诺肠杆菌的存活率之间均存在显著性差异(P<0.05)。加热40 min时,对照组菌体存活率约为经15.625 μg/L柠檬醛作用的菌体存活率的10 倍,经质量浓度为31.250 μg/L柠檬醛作用的菌体与对照组相比多下降了4 个数量级。
2.5 柠檬醛对阪崎克罗诺肠杆菌酸耐受能力的影响
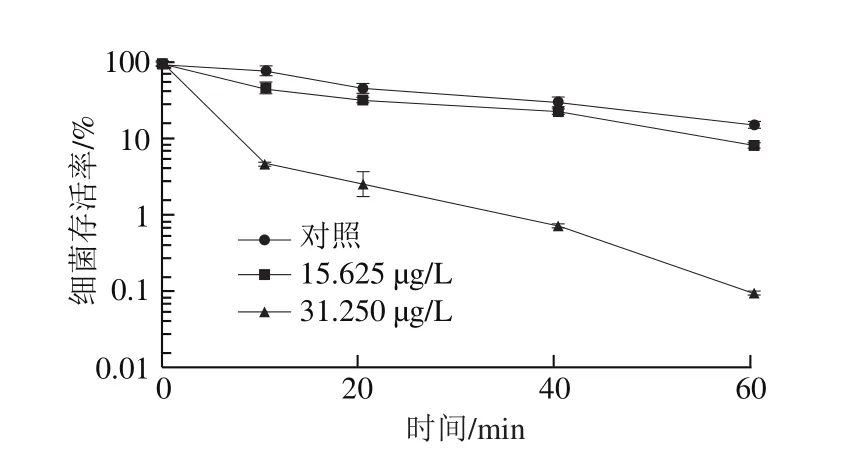
图4 柠檬醛处理对阪崎克罗诺肠杆菌酸耐受能力的影响Fig. 4 Effects of citral on acid tolerance of C. sakazakii
由图4可知,在酸化的TSB(pH 3.3)中培养60 min后,未经柠檬醛作用的阪崎克罗诺肠杆菌(对照组)细菌存活率下降为16.22%,与经柠檬醛质量浓度为15.625 μg/L作用的菌体存活率呈极显著差异(P<0.01)。而经质量浓度为31.250 μg/L柠檬醛作用的菌体存活率与未经酸处理前相比菌体存活率下降3 个数量级。结果表明,柠檬醛能降低阪崎克罗诺肠杆菌对酸的耐受能力,且随着柠檬醛质量浓度的升高,对菌体酸耐受能力的抑制作用增强。
2.6 柠檬醛对阪崎克罗诺肠杆菌胆盐耐受能力的影响

图5 柠檬醛处理对阪崎克罗诺肠杆菌胆盐耐受能力的影响Fig. 5 Effects of citral on bile salt tolerance of C. sakazakii
由图5可知,未经柠檬醛作用的阪崎克罗诺肠杆菌(对照组)经胆盐处理4 h后细菌数量上升约0.25(lg(N/N0)),而经15.625 μg/L柠檬醛作用的阪崎克罗诺肠杆菌的上升值约为对照组增加菌量的33%,经质量浓度为31.250 μg/L柠檬醛作用的阪崎克罗诺肠杆菌几乎未上升。经胆盐处理12 h和24 h时,质量浓度为31.250 μg/L和15.625 μg/L柠檬醛作用的阪崎克罗诺肠杆菌存活率上升值与对照组相比极显著降低(P<0.01)。结果表明,柠檬醛能降低阪崎克罗诺肠杆菌在胆盐中的生长数量,且随着柠檬醛质量浓度的升高作用增强。
2.7 柠檬醛对阪崎克罗诺肠杆菌氨苄西林和头孢西丁耐受能力的影响
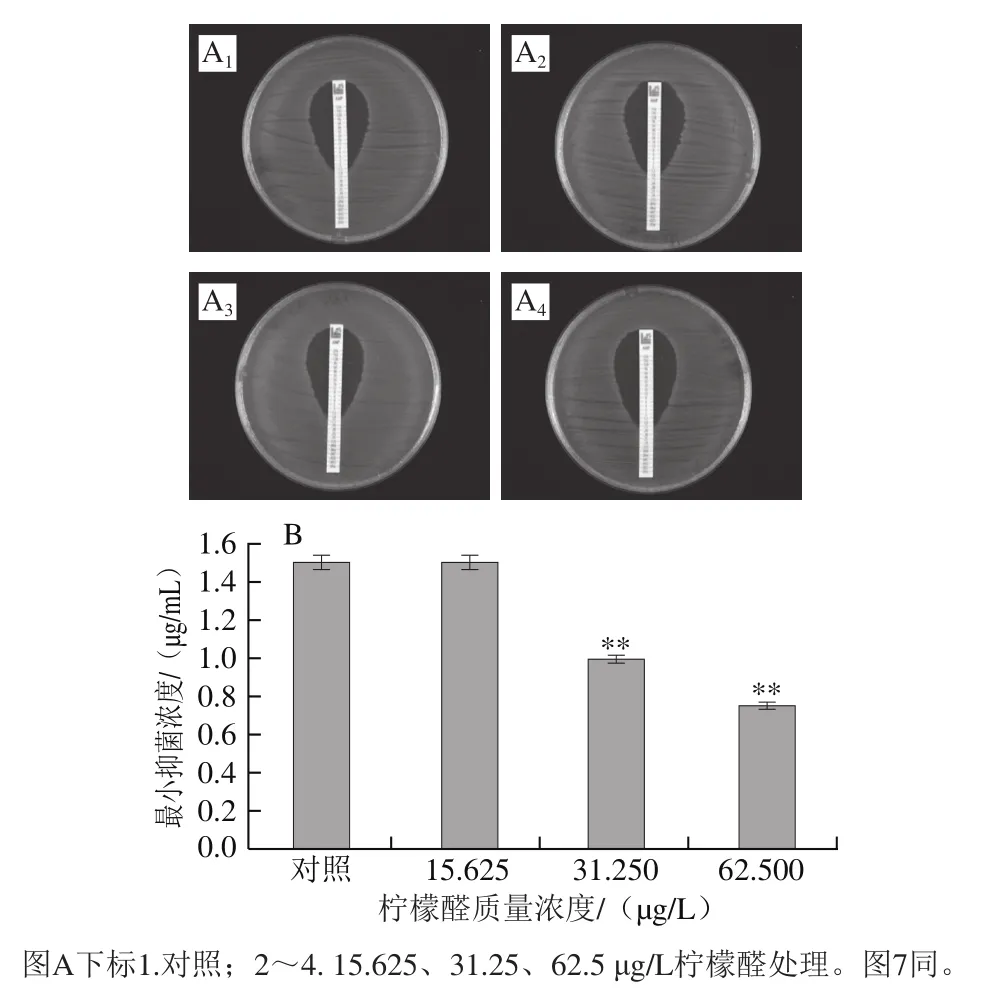
图6 氨苄西林对阪崎克罗诺肠杆菌的抑菌圈(A)和柠檬醛对阪崎克罗诺肠杆菌氨苄西林耐受能力的影响(B)Fig. 6 Inhibition zone of ampicillin against C. sakazakii (A) and effect of citral on ampicillin resistance of C. sakazakii (B)
由图6可知,氨苄西林对未经柠檬醛处理(对照组)及经15.625、31.25 μg/L和62.5 μg/L柠檬醛处理菌体的最小抑菌浓度分别为1.5、1.5、1.0、0.7 μg/mL,其中,经31.25 μg/L和62.5 μg/L柠檬醛作用菌体的最小抑菌浓度与对照组相比具有极显著差异(P<0.01)。
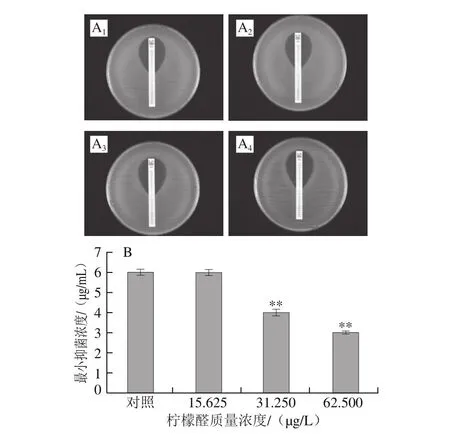
图7 头孢西丁对阪崎克罗诺肠杆菌的抑菌圈(A)和柠檬醛对阪崎克罗诺肠杆菌头孢西丁耐受能力的影响(B)Fig. 7 Inhibition zone of cefoxitin against C. sakazakii (A) and effect of citral on cefoxitin resistance of C. sakazakii (B)
由图7可知,头孢西丁对未经柠檬醛处理(对照组)的阪崎克罗诺肠杆菌的最小抑菌浓度为6.0 μg/mL,经柠檬醛质量浓度为15.625 μg/L作用的菌体和对照组相比,头孢西丁对菌体的最小抑菌浓度无显著差异(P>0.05)。头孢西丁对31.25 μg/L和62.5 μg/L柠檬醛作用菌体的最小抑菌浓度分别降低为4.1 μg/mL和2.9 μg/mL,与对照组相比具有极显著差异(P<0.01)。本研究结果表明,柠檬醛增强了阪崎克罗诺肠杆菌对抗生素氨苄西林和头孢西丁的敏感性,且随柠檬醛质量浓度升高,作用效果增强。
2.8 柠檬醛对阪崎克罗诺肠杆菌相关耐受基因转录的影响
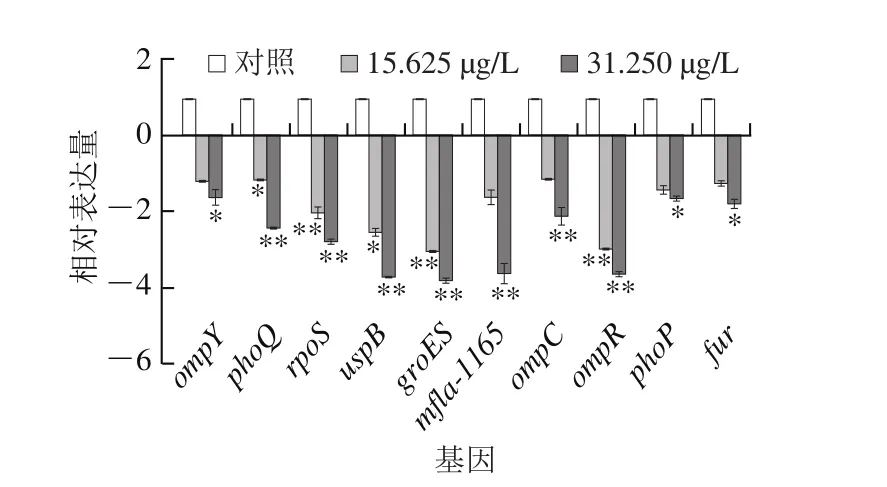
图8 柠檬醛处理对阪崎克罗诺肠杆菌相关耐受基因转录的影响Fig. 8 Effects of citral on expression of genes associated with environment stress tolerance in C. sakazakii
由图8可知,柠檬醛可显著影响阪崎克罗诺肠杆菌环境耐受相关基因的转录,并且作用效果呈现浓度依赖性。其中,与阪崎克罗诺肠杆菌耐酸性相关的基因fur、phoP/phoQ在柠檬醛质量浓度为31.250 μg/L分别下调了1.80、1.65 倍和2.44 倍。耐热指示基因mfla-1165在柠檬醛质量浓度为15.625、31.250 μg/L时分别下调了1.63 倍和3.63 倍。ompR、ompC和osmY是与阪崎克罗诺肠杆菌渗透压、干燥和胆盐耐受性相关的基因,柠檬醛作用时三者的表达量均有不同程度的下调,在31.250 μg/L柠檬醛作用下分别下调了3.64、2.13 倍和1.63 倍,在15.625 μg/L柠檬醛作用下分别下调了3.12、1.11 倍和1.17 倍。
3 讨 论
阪崎克罗诺肠杆菌对多种不良环境有着良好的环境耐受能力,婴幼儿奶粉中的阪崎克罗诺肠杆菌在生产加工、贮存运输、复原冲调以及消化吸收的过程中要经过干燥、高温、高渗透压、胃中酸性环境、肠道胆汁等作用,最终作用于宿主肠道引发肠道炎症及更深层次的疾病。因此,降低菌体的环境耐受能力对于控制阪崎克罗诺肠杆菌的存活及感染能力具有重要的作用。前期,本研究团队探究了多种植物源活性物质对阪崎克罗诺肠杆菌的抑制作用,证明了柠檬醛具有良好的抑菌效果[20],并且发现柠檬醛在亚抑制浓度下能够抑制阪崎克罗诺肠杆菌的毒力因子从而降低其致病能力[12],本研究探究了亚抑制浓度的柠檬醛降低阪崎克罗诺肠杆菌多种环境耐受能力及降低菌体对抗生素敏感性的作用。
婴幼儿配方乳粉是阪崎克罗诺肠杆菌的主要污染来源和传播途径,由于阪崎克罗诺肠杆菌具有良好的耐干燥能力,其能够在乳粉的货架期内长期存活[6]。本研究结果表明,亚抑制浓度的柠檬醛能够显著降低阪崎克罗诺肠杆菌的耐干燥能力,且呈现质量浓度依赖性。Amalaradjou等[16]也有类似的发现,反式肉桂醛也能够降低阪崎克罗诺肠杆菌的耐受干燥的能力,经750 μmol/L的反式肉桂醛作用的菌体在干燥7 d后,与对照组相比细菌数量下降了1.0(lg(CFU/mL))。菌体外膜蛋白OmpA、OmpC和伴侣蛋白GroES被证明与阪崎克罗诺肠杆菌的耐干燥能力相关。本研究实时RT-PCR表明,柠檬醛能够显著降低菌体ompA、ompC和groES基因的相关转录,推测柠檬醛可能是通过影响这3 个基因与耐受干燥相关蛋白的形成从而降低了菌体的耐干燥能力。
阪崎克罗诺肠杆菌对高渗透压环境的适应性是其能够在婴幼儿配方奶粉及其他食品生产加工过程中生存和生长的关键。Breeuwer等[21]发现阪崎克罗诺肠杆菌相比大肠杆菌、沙门氏菌和其他肠杆菌科菌株对高渗透压的耐受能力更强,且该菌能通过金属离子积累以及可溶性物质如海藻糖、脯氨酸、糖胶和甜菜碱增加细胞间的渗透压,维持大分子周围的水膜来防止细胞间的脱水作用。本研究通过在溶液中添加75 g/100 mL的山梨醇使aw为0.81模拟奶液浓缩环节的高渗透压环境,结果表明,柠檬醛可降低阪崎克罗诺肠杆菌的渗透压耐受能力,柠檬醛作用后的菌体在高渗压处理36 h后的存活率仅为0.1%左右。Chen等[22]发现青霉素能增加单核细胞增生李斯特菌对渗透压的敏感性,从而降低其对高渗透压的耐受性。高渗条件下,外膜孔蛋白OmpC,渗透性应答调节器OmpR和渗透诱导蛋白OsmY扮演渗透保护剂跨膜运输载体的角色[23]。本研究实时RT-PCR结果表明,柠檬醛使阪崎克罗诺肠杆菌ompC、ompR和osmY 3 个基因的转录量均降低,因此推测柠檬醛可能通过影响渗透保护剂跨膜运输载体的形成,从而降低阪崎克罗诺肠杆菌的渗透压耐受性。
高温热水冲调是奶粉中阪崎克罗诺肠杆菌进入人体前的最后一道防线。阪崎克罗诺肠杆菌的生长温度范围为3.6~47.6 ℃,与其他肠杆科菌类相比可以耐受更高的温度[24]。Nazarowecwhite等[25]通过测定在52、54、56、58、60 ℃的婴幼儿配方奶粉中阪崎克罗诺肠杆菌耐热性发现它具有良好的耐热能力。通常,为防止高温冲调造成婴幼儿奶粉营养成分损失,常用50~60 ℃的温水冲调,因此选取50、55 ℃和60 ℃三个温度探究柠檬醛对阪崎克罗诺肠杆菌热耐受性的影响,结果表明,柠檬醛能够显著降低阪崎克罗诺肠杆菌在3 个温度下的耐热能力,且60 ℃时柠檬醛降低阪崎克罗诺肠杆菌耐热能力的效果最强。Lim等[26]也得到相似结论,番石榴提取物对沙门氏菌耐热性具有良好的抑制作用。Lategan等[27]发现一些化学添加剂如环氧乙烷、丁二烯二氧化碳和乙酸,均能降低鼠伤寒沙门氏菌的耐热性。RNA聚合酶σ因子(RpoS)与阪崎克罗诺肠杆菌种环境耐受能力相关[28]。Mfla-1165蛋白被提议作为阪崎克罗诺肠杆菌耐热性的生物学标志[29]。本研究实时RT-PCR定量分析表明,柠檬醛能使rpoS和mfla-1165转录水平降低,因此,推测柠檬醛是通过调节阪崎克罗诺肠杆菌热应力相关蛋白的表达来降低其耐热能力。
胃酸是宿主抵抗食源性致病菌的一道重要的防线,前期研究表明,阪崎克罗诺肠杆菌能够在酸性环境下存活甚至生长[30],使得婴幼儿在食用被阪崎克罗诺肠杆菌污染的乳粉后,菌体将能够突破胃酸屏障从而引起坏死性小肠结肠炎等肠道炎症,增大了菌体感染的风险。本研究证明亚抑制浓度的柠檬醛能够降低阪崎克罗诺肠杆菌对酸性环境的耐受能力,经质量浓度为31.250 μg/L柠檬醛作用的阪崎克罗诺肠杆菌在酸性环境(pH 3.3)中生存60 min后菌量下降3(lg(CFU/mL))。Lehrke等[31]现经过Nisin和绿茶提取物作用的单核细胞增生李斯特菌对酸性环境的敏感性增强,经Nisin(30 IU/mL)和绿茶提取物(5 390 mg/L)处理48 h并耐受酸性环境(pH 4.0)1 h后,单增李斯特菌CIP 80.11分别下降2.7(lg(CFU/mL))和1.4(lg(CFU/mL)),而未经作用的菌体数量仅下降0.2(lg(CFU/mL))。Fur蛋白(铁吸收调节蛋白)和PhoP/PhoQ双组份系统(菌体感知环境的传感器)与大肠杆菌和沙门氏菌的耐酸能力相关[32-33]。本研究实时RT-PCR结果表明,柠檬醛可显著降低阪崎克罗诺肠杆菌phoP/phoQ和fur基因的转录。因此,推测柠檬醛可通过影响阪崎克罗诺肠杆菌PhoP/PhoQ双组份系统的传感调节功能及Fur蛋白的表达从而降低菌体的耐酸能力。
肠道中的胆盐能够通过破坏细胞膜中的磷脂结构、降解细胞内的蛋白、影响微生物的生长等多种方式发挥其对细菌的抑杀作用[10],阪崎克罗诺肠杆菌是肠道中的定植菌,其能够耐受一定浓度的胆盐环境。健康人体内胆盐通常在2%左右波动[17],因此测定亚抑制浓度柠檬醛作用后的阪崎克罗诺肠杆菌在2%胆盐下的生长情况。结果显示柠檬醛处理后的阪崎克罗诺肠杆菌在2%胆盐环境中的生长速度明显下降,且作用效果呈现浓度依赖性。柠檬醛作用使得阪崎克罗诺肠杆菌在肠道胆盐环境中生长缓慢,这将使菌体脂多糖产生量减少且对肠上皮细胞的黏附和侵入数量降低。
目前,抗生素治疗是控制阪崎克罗诺肠杆菌感染的主要方法,一些研究表明阪崎克罗诺肠杆菌对常用抗生素较为敏感,但长期使用抗生素会导致阪崎克罗诺肠杆菌耐药性增加,这增大了控制其感染的难度[34]。本研究结果表明,亚抑制浓度的柠檬醛能够增加阪崎克罗诺肠杆菌对氨苄西林和头孢西丁这两种抗生素的敏感性,且呈现浓度依赖性。Zanini等[18]也有类似的发现,柠檬醛和香芹酚能够增加单核细胞性李斯特菌和英诺克李斯特菌对红霉素和黏菌素的敏感性,并推测柠檬醛和香芹酚是通过影响菌体细胞膜的通透性从而使抗生素更容易到达作用靶点,达到杀菌的目的。Karumathil等[35]证明亚抑制浓度的反式肉桂醛和丁香酚能够增强鲍曼不动杆菌对β-内酰胺类抗生素的敏感性,并且发现这两种天然物质影响了菌体外排泵的功能,但没有增加菌体细胞膜的通透性。实时RT-PCR结果表明,天然物质显著降低了鲍曼不动杆菌与耐受β-内酰胺类抗生素相关基因的转录水平。
4 结 论
本研究以柠檬醛为研究对象,以阪崎克罗诺肠杆菌为作用主体,探究了柠檬醛对阪崎克罗诺肠杆菌的环境压力耐受能力和抗生素敏感性的影响。首先利用液体稀释法测定不同质量浓度柠檬醛对阪崎克罗诺肠杆菌生长曲线的影响,确定柠檬醛对阪崎克罗诺肠杆菌的亚抑制浓度;接着探究了亚抑制浓度的柠檬醛对阪崎克罗诺肠杆菌干燥、渗透压、热、酸和胆盐耐受能力的影响;同时,研究利用E-test®法检测了柠檬醛作用后的阪崎克罗诺肠杆菌对抗生素氨苄西林和头孢西丁敏感性的变化;最后利用实时RT-PCR分析了柠檬醛对阪崎克罗诺肠杆菌环境耐受相关基因转录的影响。结果表明柠檬醛可降低阪崎克罗诺肠杆菌干燥、渗透压、热、酸、胆盐的耐受能力,且呈现浓度依赖性;并且,亚抑制浓度的柠檬醛增强了菌体对氨苄西林和头孢西丁的敏感性;实时RT-PCR结果表明,柠檬醛降低了与阪崎克罗诺肠杆菌环境耐受能力相关的多个基因的转录水平。上述研究结果表明:柠檬醛可降低阪崎克罗诺肠杆菌的多种环境压力耐受能力,增强菌体对抗生素的敏感性。这为柠檬醛应用于食品生产加工过程中控制阪崎克罗诺肠杆菌奠定理论基础,也为天然活性物质控制食源性致病菌提供新的思路。

