2012—2018 年山东省部分地区猪瘟分子流行病学研究
邹 敏,宫 晓,张 青,杨旭兵,于可超,刘 东,刘 蕾,李陆梅,刘拥军,范根成
(青岛易邦生物工程有限公司,动物基因工程疫苗国家重点实验室,山东青岛 266144)
猪瘟又称古典猪瘟(classical swine fever,CSF),是由古典猪瘟病毒(classical swine fever virus,CSFV)感染猪而引起的一种急性、热性、接触性传染病,临床以高热、沉郁、多器官出血、高死亡率为特征,具有高传染性和致死性[1]。该病的易感动物为家猪和野猪,发病无季节性特点,是影响全球养猪业的重大猪病之一,是世界动物卫生组织(OIE)规定的必须报告动物传染病,也是我国农业农村部认定的一类动物疫病,是《国家中长期动物疫病防治规划(2012—2020 年)》中明确的优先防治病种[2-4]。
CSFV 归属于黄病毒科(Flaviviridae)、瘟病毒属(Pestivirus),是单股正链RNA 病毒,基因组全长约12 kb,其基因组两端分别为5′NTR 和3′NTR,有4 个结构蛋白基因C、E0、E1、E2,其 余8 个 基 因(Npro、p7、NS2、NS3、NS4A、NS4B、NS5A、NS5B)为非结构蛋白基因[5-7]。国内外已有研究表明,CSFV 只有1 个血清型,依据E2 基因主要抗原区域(190 bp,以下简称E2 基因)或E2基因全长(1 119 bp)将其分为3个基因型(1、2、3)、11 个 亚 型(1.1、1.2、1.3、1.4、2.1、2.2、2.3、3.1、3.2、3.3、3.4),其中2.1 亚型又可进一步分为2.1a、2.1b、2.1c 和2.1d 共4 个分支[8-9]。我国猪群中存在1、2 两种基因型CSFV 毒株。1型CSFV 主要是1.1 亚型;2 型CSFV 依据序列特点分为3 种(2.1、2.2、2.3)基因亚型,尤以2.1亚型为优势毒株,且以2.1b 分支毒株为主,近年来又出现了2.1d 分支毒株[10-11]。我国自2007 年以来对猪瘟实施强制免疫政策,并取得较好的防治效果[12]。山东是我国养猪大省。为了解该省猪群中的CSFV 感染情况及其分子特点,开展了为期7 年的CSFV 分子流行病学研究。
1 材料与方法
1.1 组织样品
共79 份,由本公司技术服务部收集、提供,已经研磨、提取核酸、RT-PCR 检测,确定为CSFV 核酸阳性。2012—2018 年收集的样品数分别为12、10、14、13、10、10、10 份,均已研磨为混悬液,分装规格为2 mL/管,-80 ℃保存备用。
1.2 基因扩增引物
参考朱小甫等[13]设计的E2 基因引物,将序列发送上海生工进行合成,收到引物后用DEPC 水稀释至20 pmol/μL,-20 ℃保存备用。
1.3 主要试剂
TRIzol LS Reagent,购自Invitrogen;一步法RT-PCR 扩增试剂盒、DNA 分子量标准物(DL2000),购自TaKaRa;DNA 纯化试剂盒,购自天根生物;氯仿、异丙醇、无水乙醇等,购自国药集团;琼脂糖、无RNA/DNA 酶DEPC 水,购自上海生工。
1.4 核酸提取
取1.1 节保存的79 份组织处理混悬液于台式高速冷冻离心机中进行12 000 r/min、4 ℃条件下离心10 min;每份样品取上清液250 μL,按照TRIzol LS Reagent 使用说明,提取总RNA,-80 ℃保存备用。
1.5 E2 基因RT-PCR 扩增
扩增总体系50 μL,分别包含:预混酶(enzyme mix)2 μL、2×buffer 25 μL、E2 基因扩增引物对各1 μL、总RNA 5 μL、DEPC 水16 μL。瞬时配制好反应体系后放入预先开启、设置好程序的PCR 仪进行扩增。反应程序为:50 ℃ 30 min、94 ℃ 5 min,然后进入35 个扩增循环94 ℃ 40 s、55 ℃ 40 s、72 ℃ 40 s,最后72 ℃延伸8 min。反应终止后,取适量PCR 产物进行琼脂糖凝胶电泳检查,并拍照。
1.6 基因测序及编辑
将电泳检测后的剩余PCR 产物送上海生工测序,收到结果后用DNAstar(Version 7.10)软件中的Editseq,对序列进行校对,截取190 bp 用于分析[14-16]。
1.7 E2 基因序列分析
利用DNAstar 中的Megalign,对59 个不同年份的CSFV E2 基因序列与28 个不同基因亚型CSFV 参考毒株E2 基因同一区域、以及7 个分离自山东省的CSFV毒株(表1)E2基因进行序列分析。

表1 基因1、2、3 型CSFV 参考毒株背景信息
1.8 遗传发育进化树分析
配合使用Megalign、Clustal X 1.83 两个软件,对测定的59 个CSFV、35 个参考CSFV 的E2 基因进行聚类分析,再使用MEGA 6 软件,采用邻接法构建基于CSFV E2 基因(190 bp)的进化树。
2 结果
2.1 E2 基因扩增及测序
对79 份CSFV 阳性样品进行CSFV E2 基因扩增,共获得59 个CSFV E2 基因阳性扩增结果,送样测序正确,经编辑、截取190 bp 的片段用于分析,其中23 份样品的RT-PCR 扩增结果见下图1。
图1 病料中CSFV 的检测结果
2.2 E2 基因核苷酸序列同源性分析
SDQDF1-12、SDQW9-12、SDQDF5-12、SDJM-17、SD254-18、SD265-18、SD267-18 与Shimen 等 基 因1 型CSFV 参 考 毒 株、Alfort 等基 因2 型CSFV 参 考 毒 株、YI9908 等 基 因3 型CSFV 参考毒株的E2 基因同一编码区(以下简称为E2 基因)碱基序列同源性介于84.1%~99.5%、79.9%~85.7%、82.0%~86.2%。SDJZ-15 与上述3 种基因型CSFV 参考毒株的E2 基因碱基序列同源性介 于81%~90.5%、87.3%~96.8%、85.7%~90.5%。其他51 个CSFV 测序毒株与上述3 种基因型CSFV 参考毒株E2 基因碱基序列同源性介于77.2%~85.7%、81.5%~96.8%、75.7%~82.5%。59 个测序毒株之间的E2 基因序列同源性介于79.4%~100%。
2.3 E2 基因推导氨基酸序列同源性分析
SDQDF1-12、SDQW9-12、SDQDF5-12、SDJM-17、SD254-18、SD265-18、SD267-18 与Shimen 等基因1 型CSFV 参考毒株、Alfort 等基因2 型CSFV 参考毒株、YI9908 等基因3 型CSFV参考毒株E2 基因推导氨基酸序列同源性分别介于79.4%~100%、82.5%~96.8%、79.4%~88.9%。SDJZ-15 与 上 述3 种CSFV 参 考 毒 株E2 基因推导氨基酸序列同源性介于81%~90.5%、87.3%~96.8%、85.7%~90.5%。 其 他51 个CSFV测序毒株与上述3 种基因型CSFV 参考毒株E2基因推导氨基酸序列同源性介于79.4%~93.7%、84.1%~100%、81%~93.7%。59 个测序毒株之间的E2 基因推导氨基酸序列同源性介于81.0%~100%。
对全部59 个测序毒株与参考毒株的E2 基因28~90 位aa 序列进行比对,发现SDQDF1-12、SDQW9-12、SDQDF5-12、SDJM-17、SD254-18、SD265-18、SD267-18 与1.1 亚群代表Shimen、C株的E2 基因28~90 aa 未发生变异,与我国的疫苗株C 株相比,7 个毒株中有3 个毒株的E2 基因aa序列与C 株一致,提示这7 个毒株可能起源于疫苗毒或为类疫苗毒株(图2)。SDJZ-15 株 E2 基因与2.1b 亚型毒株E2 基因的28~90 aa 序列基本一致,仅A51突变为V51(图3)。其他51 个测序毒株与基因2 型毒株E2 基因的28~90 aa 序列基本保持一致,多数毒株K32突变为R32/E32,N35突变为S35,A51突变为S51,T57突变为I57(图4)。

图2 7 个1.1 亚群毒株E2 基因推导氨基酸序列变异比较

图3 SDJZ-15 与2.1b 亚群毒株E2 基因推导氨基酸序列变异比较
2.4 CSFV 遗传发育进化树
将59 个测序毒株的E2 基因序列与35 个国内外CSFV 参考毒株E2 基因进行多序列比对,构建遗传发育进化树(图5),发现SDQDF1-12、SDQW9-12、SDQDF5-12、SDJM-17、SD254-18、SD265-18、SD267-18 与Shimen 株等归属于1.1 亚群,SDJZ-15 与参考毒株CSF0708 等归属于2.1b亚群,其他51 个毒株则属于2.1d 亚群。
3 讨论

图4 51 个测序毒株与2.1d 亚群毒株E2 基因推导氨基酸序列变异比较
用于CSFV 基因分型的靶基因包括5' NTR、E2 基因(190 bp)、NS5B 基因,但国内外应用最多的是E2 基因。Lowings 等[17]对1945—1994 年获得的14 个国家的115 个CSFV 毒株进行了分析,发现这115 个毒株分别属于1.1、1.2、2.1、2.2、2.3 共5 个CSFV 亚型。2013 年,Postel 等[11]在古巴发现1.4 亚型毒株;Pereda 等[18]在危地马拉和洪都拉斯发现1.3 亚型毒株;基因3 型毒株主要出现在我国台湾、日本、韩国等亚洲地区[10,19-20]。在国内,王琴等[21]对12 株CSFV 进行聚类分析,发现我国20 世纪80—90 年代的CSFV 主要是1 型、2 型。赵耘等[22]对l7 株CSFV 的 E2 基因进行比较,发现这些毒株分别归属于1.1、2.1、2.2 亚群,但以1.1 亚型毒株为主。吴健敏等[23]对广西地区13 株CSFV 进行分析,发现这些毒株分属于1.1、2.1、2.2 和2.3。涂长春等[24]对来自30 个省份的191 株CSFV E2 基因进行分析,发现50 个毒株属1.1 亚型、76 个毒株属2.1 亚型、51 个毒株属2.2亚型、13 个毒株属2.3 亚型,提示我国的CSFV流行毒株以2.1 亚型为主。王博阳等[25]、Deng等[26]、Zhang 等[27]的研究显示,我国各地流行的2.1 亚型CSFV 毒株又可分为2.1a、2.1b、2.1c、2.1d 共4 个分支。
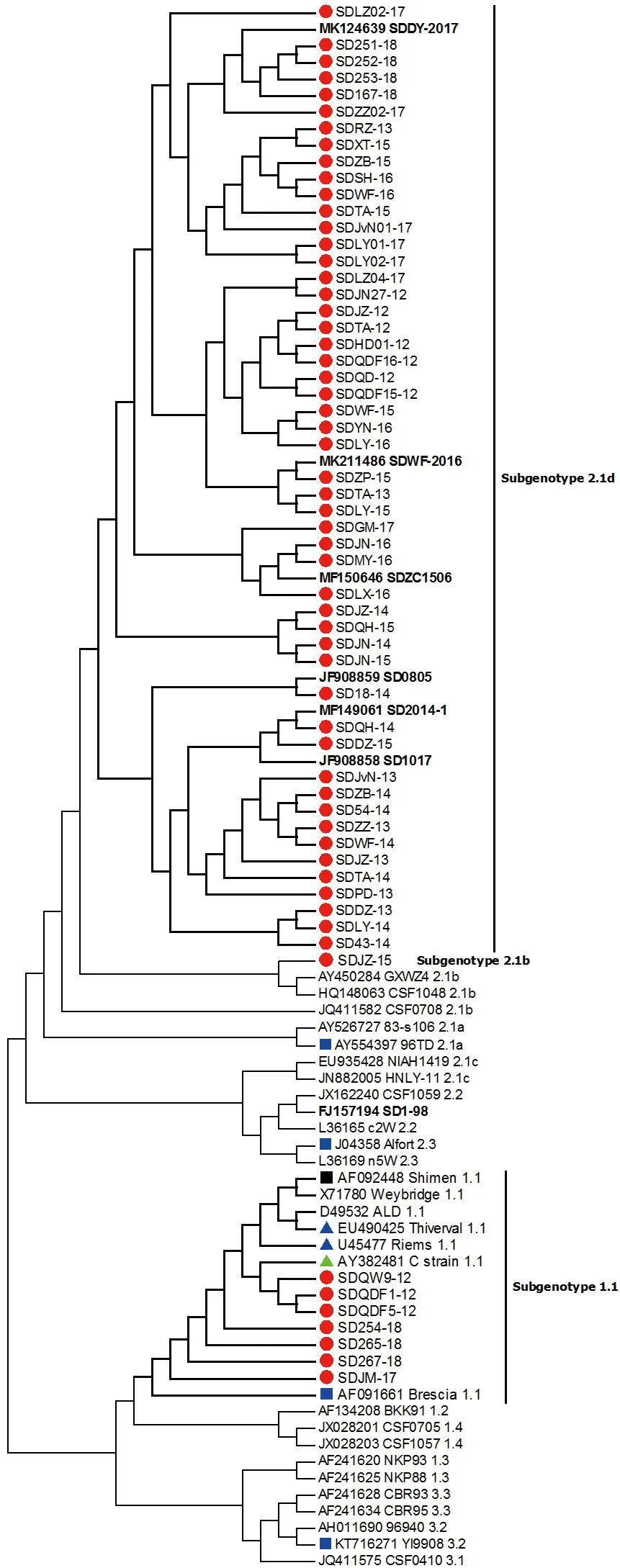
图5 基于CSFV E2 基因主要抗原区域构建的遗传发育进化树
我国研制的猪瘟兔化弱毒疫苗免疫效果极佳,经数十年应用,特别自2007 年实行强制免疫政策以来,我国的猪瘟疫情得到了有效控制,但并未根除[28-29]。CSFV 为单链RNA 病毒,在长期的疫苗免疫压力下,田间CSFV 将进一步发生变异。研究显示,我国猪群中的CSFV 流行株已从1.1 亚型毒株逐渐演化到1.1 亚型、2.1 亚型混杂存在,并以2.1 亚型为优势毒株。山东作为国内生猪存栏量居前列的大省,相关地市猪群中CSFV 毒株的分子特点也与其他省份极为类似[30]。因此,为掌握山东省猪群中CSFV 的遗传演化特点,从而为有效防控该病提供数据支持,对2012 年以来收集的、经RT-PCR 检测为CSFV 核酸阳性的临床样品直接进行了E2 基因测序及分子流行病学分析,发现研究结果与冯丽苹等[31]所发表的研究结果基本一致,除发现1 株2.1b 亚型毒株、7 株1.1 型毒株外,其余51 株均为2.1d 亚型,表明现阶段山东省内猪群中的CSFV 优势毒株的基因型为2.1d。这提示需要对本病总体流行态势、病毒遗传演化特点以及现有疫苗免疫效果进行跟踪研究,以便有效控制该病,保障生猪养殖业健康发展。

