猪圆环病毒2型与猪细小病毒混合感染对仔猪致病性的研究
刘国阳,唐 波,常 晨,华 涛,侯继波,张道华*
(1.江苏省农业科学院 动物免疫工程研究所,江苏 南京 210014;2.江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
仔猪断奶后多系统衰竭综合征(Postweaning multisystemic wasting syndrome, PMWS),是主要由猪圆环病毒(Porcine circovirus, PCV)引起的一类传染病。其中PCV可以分为PCV1型、PCV2型以及PCV3型,而PCV1型不致病,PCV2型具有致病性,PCV3型的致病性尚未有定论[1-3]。目前,PCV2型被认为是引起PMWS的主要病原。PMWS以仔猪进行性消瘦、淋巴结肿大、肝炎、肾炎、间质性肺炎等症状为临床特征,组织病理学表现为淋巴结肉芽肿性炎症、巨噬细胞增生、部分脏器淋巴细胞浸润等[4]。该病最早于1991年加拿大首次发现报道[5-7];之后Allen等[8-9]通过实验验证PCV2与PMWS发病有相关性。国内最早报道PMWS的是郎洪武等[10],他们通过对临床材料进行血清学检测,证明该病在我国是存在的。
一直以来,PMWS是困扰世界上许多养殖业发达国家的重要猪传染病之一,每年造成了巨大的经济损失。研究发现,虽然PCV2是引起PMWS发病的主要病原,但单独感染时并不能导致严重的后果。国内外许多学者均已在PMWS临床诊断中发现,PPV与PCV2存在混合感染[11]。本研究对健康的断奶仔猪人工感染PPV和PCV2两种病毒,对仔猪感染后的临床症状和组织病理学变化进行了观察,对其血清学指标进行了检测,并对实验室分离获得的1株PPV和PCV2对仔猪的致病性进行了评估,以期为PPV和PCV2协同致病模型及二联疫苗的研究提供理论依据。
1 材料与方法
1.1 实验材料
PCV2 NJ株和PPV NJ株均由国家兽用生物制品工程技术研究中心分离鉴定、保存;PCV2的滴度利用PK-15a细胞增殖可达106.5TCID50/mL;PPV NJ株的滴度利用ST细胞增殖可达107.0TCID50/mL。ST细胞和PK-15a细胞由国家兽用生物制品工程技术研究中心驯化、保存。DNA提取试剂盒购自TaKaRa公司;PCV2 ELISA抗体检测试剂盒购自武汉科前生物技术有限公司。
筛选PRV、PCV2、PRRSV、PPV抗体阴性,PPV、PCV2抗原阴性的45日龄仔猪,共计20头,购自江苏某农户。所有动物实验均在江苏省农业科学院国家兽用生物制品工程技术研究中心实验动物房进行。
1.2 试验设计
筛选20头仔猪,随机分为4组,分别为空白对照组5头、PPV单独感染组5头、PCV2单独感染组5头、PPV和PCV2混合感染组5头。4组实验动物全部封闭隔离饲养。在45日龄时,通过滴鼻和肌肉注射方式感染,其中PPV单独感染组分别以滴鼻和肌肉注射方式各接种1.5 mL PPV NJ株;PCV2单独感染组分别以滴鼻和肌肉注射方式各接种1.5 mL PCV2 NJ株;PPV和PCV2混合感染组分别以滴鼻和肌肉注射方式各接种1.5 mL PPV NJ株(共计3 mL)和1.5 mL PCV2 NJ株(共计3 mL);空白对照组分别以滴鼻和肌肉注射方式各接种1.5 mL DMEM培养液。接种剂量PPV NJ株为3×106.0TCID50/头,PCV2 NJ株为3×105.0TCID50/头。
在攻毒前称量每头猪的体重,在攻毒后观察记录临床症状和直肠温度,并于攻毒后3、5、7、10、14、21、28 d采集血清,备用。在攻毒后28 d剖杀,称量体重,观察肺脏、脾脏、肝脏和淋巴结病变。
1.3 试验仔猪的组织病理学检查
剖杀仔猪后,采集不同器官(心、肝、脾、肺、肾、扁桃体和淋巴结),取组织病变位置用10%福尔马林固定;在24 h后取出固定的组织,用梯度乙醇脱水,用二甲苯透明,随后进行透蜡、包埋、切片、苏木素-伊红染色,最后在普通光学显微镜下观察组织形态学变化。
1.4 试验仔猪病毒血症的检测
参照PPV和PCV2分离株的基因序列设计引物(表1),根据DNA提取试剂盒说明书的操作步骤提取PPV和PCV2病毒DNA,采用荧光定量PCR (qPCR)法检测被攻毒仔猪的病毒血症。反应程序为:50 ℃ 2 min;95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。同时设ddH2O为阴性对照,获得循环阀值(Ct值),根据标准曲线方程计算血清样品中PCV2和PPV的核酸拷贝数[12],判断被攻毒仔猪是否存在病毒血症。
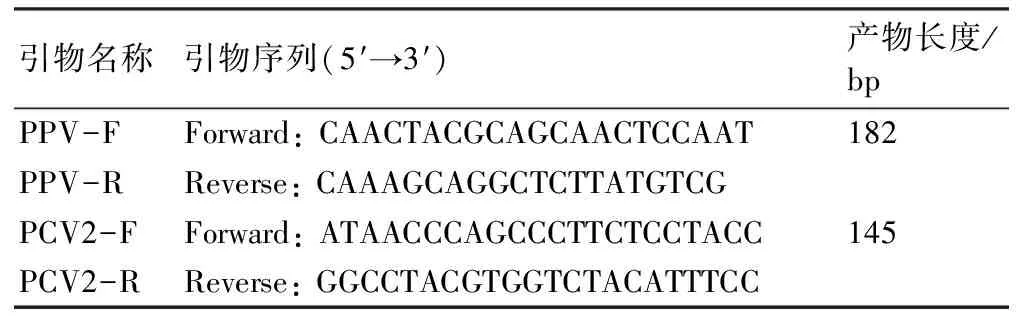
表1 用于PCR扩增的引物序列
1.5 PCV2 ELISA抗体和PPV HI抗体效价的检测
采用PCV2 ELISA抗体检测试剂盒检测血清IgG抗体,根据试剂盒说明书判定各组PCV2 ELSIA抗体之间的相互关系。PPV HI抗体检测:参照《中国兽药典》2015版中的血清HI抗体检测方法,以能够抑制50%豚鼠红细胞凝集的血清最高稀释倍数以2为底的对数为血清PPV HI抗体效价[13]。
1.6 数据统计分析
应用GraphPad PRISM软件对试验数据进行统计分析,P<0.05表示差异显著。
2 结果与分析
2.1 试验仔猪的体温变化
在攻毒后,每日10:00定时测量试验仔猪的直肠温度,结果显示:PPV单独感染组和空白组体温无显著差异;在攻毒后11、12 d,PCV2单独感染组的仔猪体温较PPV单独感染组和空白组有明显升高,而PPV和PCV2混合感染组的仔猪体温升高早于PCV2单独感染组,且持续时间更长(图1)。上述结果表明,PPV和PCV2混合感染能够引起仔猪更严重的体温反应。
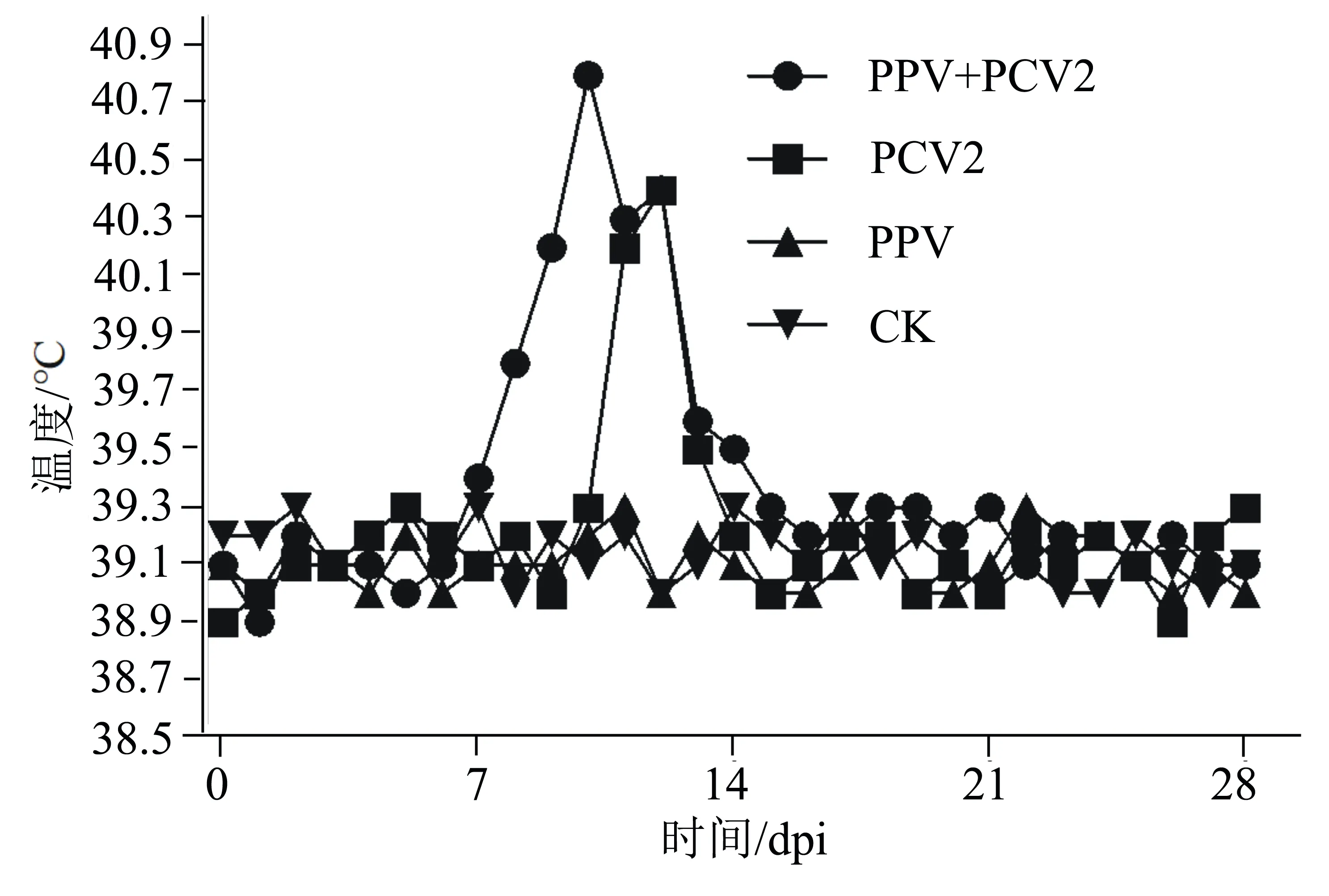
图1 试验猪肛肠温度的变化
2.2 试验仔猪平均日增重的变化
在攻毒前和攻毒后剖杀时,分别称量试验猪的体重,计算每组试验猪的日平均增重情况。结果显示:PPV和PCV2混合感染组猪的平均日增重极显著低于PPV单独感染组和空白组(P<0.01),显著低于PCV2单独感染组(P<0.05);PCV2单独感染组猪的平均日增重显著低于PPV单独感染组与空白组;PPV单独感染组与空白组猪的平均日增重无显著性差异(图2)。表明,PPV和PCV2混合感染仔猪后能够导致仔猪生长缓慢,平均日增重下降。
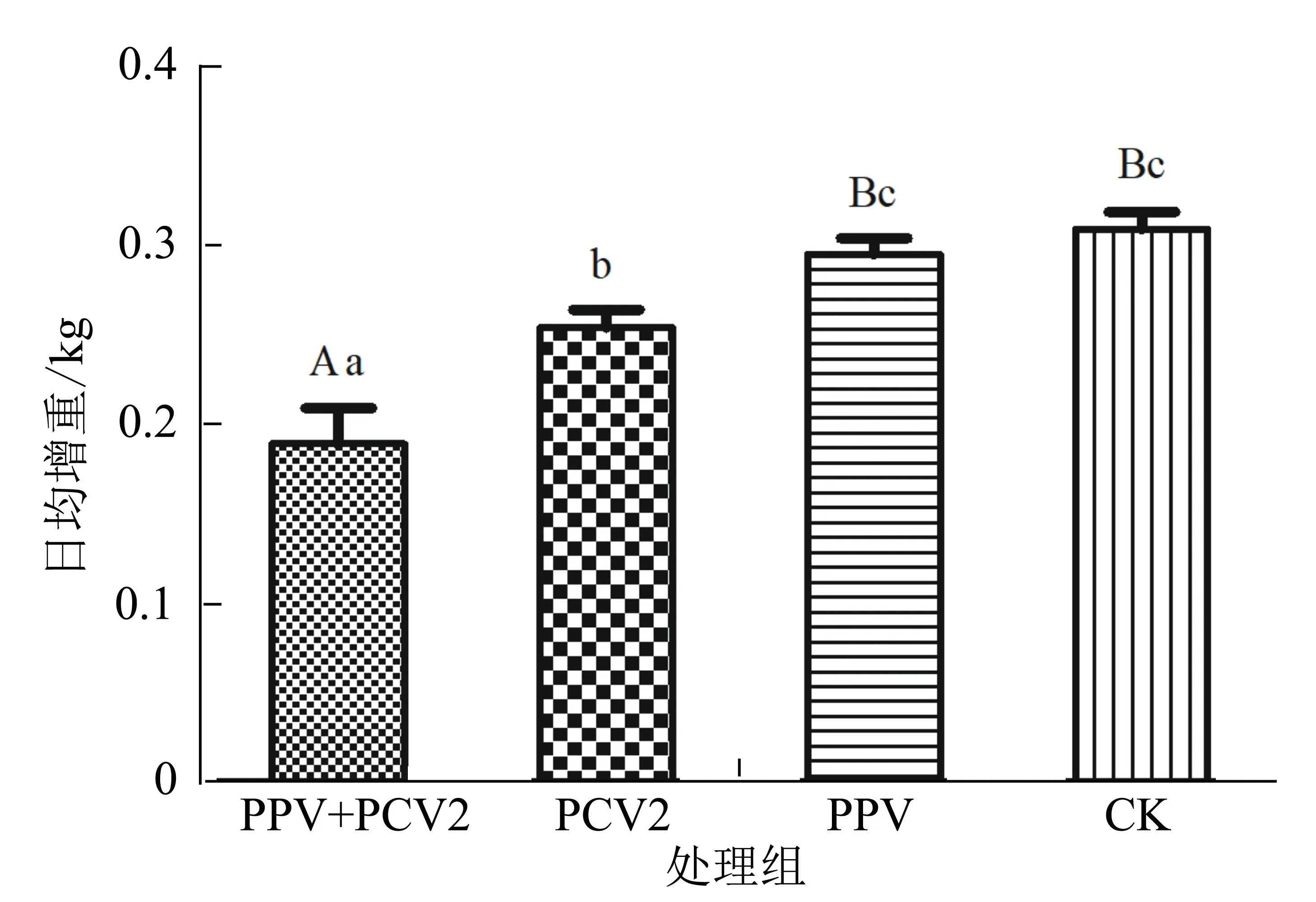
图柱中标不同大写字母表示在不同试验组间差异极显著(P<0.01);不同小写字母表示差异显著(P<0.05)。
2.3 试验仔猪临床症状及剖检变化观察
攻毒后每日观察试验猪的精神、采食及临床变化。结果显示:PPV和PCV2混合感染组和PCV2单独感染组猪在攻毒后先后出现食欲减退、精神萎靡、迟钝、不愿移动等临床表现,以混合感染组的临床表现更加严重,持续时间更长;在攻毒后10 d混合感染组4/5的试验猪在四肢和腹部出现泛红的斑点(图3A、图3D);PPV单独感染组和空白组无明显临床变化。
在攻毒后28 d剖杀试验仔猪,观察统计各脏器的病理变化。结果显示:PPV和PCV2混合感染组猪的肺脏水肿、颜色变浅,部分区域出现肉变且按压无弹性(图3B、图3C),脾脏有少量出血点,边缘有明显的锯齿状梗死灶(图3E),且淋巴结轻微肿大(图3F);PCV2单独感染组、PPV单独感染组和空白组猪的各脏器无明显眼观变化。表明,PPV和PCV2混合感染仔猪引起的临床症状更加明显,仔猪的发病程度更加严重,证明PPV和PCV2混合感染仔猪能够增强PCV2引起的临床症状,加重PMWS的发病程度。
2.4 试验仔猪组织病理学变化
在攻毒后28 d,剖杀试验仔猪,采集相关脏器固定,制备组织病理学切片,经HE染色后观察变化。结果发现:PPV单独感染组和空白组试验猪无明显组织病理变化。PCV2单独感染组部分试验猪的肺脏和淋巴结出现与PPV和PCV2混合感染组猪相似的病理变化,但混合感染组的试验猪各脏器均有更加严重的组织病变,其中:肺脏肺泡壁增厚,肺泡上皮细胞增生,伴有少量中性粒细胞和淋巴细胞浸润,支气管上皮细胞有坏死和脱落(图4A);脾脏细胞界限不清,红髓区增生伴有大量坏死细胞和中性粒细胞(图4B);肝脏肝细胞重度水样变性,胞质疏松呈空泡化(图4C);淋巴结淋巴细胞减少,细胞核深染(图4D);扁桃体局部区域出现细胞核深染和淋巴细胞浸润(图4E);心脏心肌细胞水样变性,胞质肿胀、疏松、淡染(图4F)。表明,PPV和PCV2混合感染仔猪的组织病理变化较单独感染组和对照组更加严重,进一步证明两种病毒具有相互促进感染的作用,能够引起更加严重的临床症状。
2.5 试验仔猪血清病毒含量的检测
分别于攻毒后3、5、7、10、14、21、28 d,采集试验猪的血样并分离,提取血清DNA,采用qPCR法检测各时间点的PPV和PCV2病毒含量。PCV2病毒含量的检测结果如图5A所示:PPV和PCV2混合感染5 d后即可检测到PCV2阳性;PCV2单独感染组在攻毒后10 d可以检测到PCV2阳性,但其含量显著低于混合感染组(P<0.05),直至实验结束;PPV单独感染组和空白组未检测到PCV2阳性。
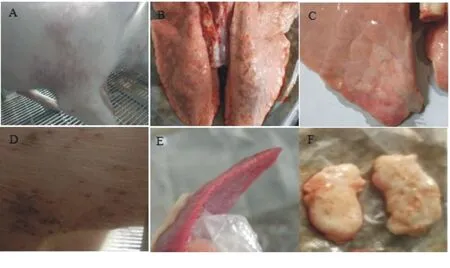
图3 各组试验猪大体眼观变化

图4 试验猪部分脏器组织病理学变化(HE染色,400×)
PPV病毒含量的检测结果如图5B所示:在攻毒后5 d,PPV单独感染组和PPV+PCV2混合感染组均可检测到PPV阳性,但混合感染组的PPV病毒含量显著高于PPV单独感染组(P<0.05);PCV2单独感染组和空白组未检测到PPV阳性。上述结果表明,PPV和PCV2混合感染后,PPV能够促进PCV2在猪机体内增殖,提高PCV2病毒的含量。
2.6 试验仔猪抗体检测结果
采集攻毒后不同时间点的仔猪血清,利用PCV2 ELISA抗体检测试剂盒检测血清抗体,结果显示:PPV单独感染组和空白组在试验持续期内,PCV2 ELISA抗体均为阴性;PPV和PCV2混合感染组在攻毒后10 d抗体检测全部呈阳性;PCV2单独感染组攻毒后14 d抗体检测呈阳性;攻毒后14、21、28 d,混合感染组的抗体水平显著高于PCV2单独感染组(P<0.05)(图6A)。

*表示与PCV2单独感染组相比差异显著(P<0.05);**表示与PCV2单独感染组相比差异极显著(P<0.01);#表示与PPV单独感染组相比差异显著(P<0.05)。下图同。
根据《中国兽药典》中血清HI抗体检测方法,检测不同时间点采集的仔猪血清HI抗体,结果显示:PCV2单独感染组和空白组的PPV HI抗体始终保持阴性;PPV和PCV2混合感染组以及PPV单独感染组在攻毒后7 d全部转阳,并且在攻毒后14、21、28 d,混合感染组PPV HI抗体水平显著高于PPV单独感染组(P<0.05)(图6B)。表明,PPV和PCV2混合感染仔猪后血清抗体水平较单独感染组明显升高, PPV和PCV2能够相互促进,增强机体的抗体反应。

图6 试验猪血清的特异性抗体水平
3 讨论
目前普遍认为PCV2是引起PMWS的主要病原,但单独采用PCV2人工感染断奶洁净仔猪很难复制出PMWS的典型症状。Ober等[14]研究证实,PCV2与PPV、猪伪狂犬病毒、猪繁殖与呼吸障碍综合征病毒、猪肺炎支原体等病毒混合感染时,PMWS发病症状明显,甚至能够导致较高的死亡率,但国内关于两种病毒混合感染致病性差异的报道较少。
本研究通过控制试验过程,使得各组动物的感染试验在相同的环境下进行,避免复杂的外界环境干扰,保证了结果的准确科学性。研究表明,PPV和PCV2混合感染猪表现出的临床症状和组织病理学变化较单独感染组更为严重,血清中病毒含量更高,发病程度更重,表明PPV和PCV2共同感染后强化了PCV2的致病性,这与国外的相关报道[15-18]一致。在共感染组中,所有试验猪在试验周期内均出现了厌食、精神萎靡、消瘦等症状;在试验28 d结束时,甚至有1头共感染仔猪体重呈负增长,生长指标受到严重影响。组织病理学切片结果同样显示,共感染组较单独感染组出现更加明显的组织病理学损伤,脾脏、肝脏、肺脏等组织器官中均有不同程度的病理变化;此外,淋巴组织切片结果发现机体淋巴结出现严重的淋巴细胞损失。这些说明PPV和PCV2共感染严重破坏了仔猪机体内的免疫系统。
本试验通过对各组感染猪不同时间点的病毒含量进行检测,发现PPV和PCV2混合感染组病毒血症出现的时间更早;qPCR结果显示攻毒后5 d,即可检测到血清抗原阳性,直至实验结束时均呈现阳性结果,与单独感染组结果相比病毒含量更高,持续时间更长。这进一步验证了前期的报道结果[19]。另外,通过间接ELISA法和血凝抑制试验法检测不同时间点的PCV2和PPV抗体水平,发现:在攻毒后7 d,混合感染组可检测到PPV HI抗体阳性,而PCV2抗体在攻毒后10 d转阳,且在攻毒后21 d达到峰值,在28 d试验结束时稍微降低。这也证明了前期国外关于PPV在机体内先于PCV2病毒复制,PPV和PCV2混合感染后PPV能够促进PCV2增殖的观点[20-21]。同时,抗体检测结果也解释了本研究中仔猪混合感染后PCV2病毒血症更加严重、持续期更长的原因:PCV2抗体出现较晚,机体受到PCV2侵染后未能及时组织有效的病毒清除系统。
本研究阐明了实验室新分离的两株PPV和PCV2混合感染协同致病性作用,各项检测指标均显示两种病毒共同感染的致病性远远高于单独感染,引起的临床症状和病理变化更为严重,这可为后期更进一步研究PPV和PCV2混合感染的机理和研制两种病毒混合感染防控的二联疫苗提供参考。

