家蝇抗菌肽MAF-1A体外抗甲型流感病毒活性及机制研究
朱志翠,邓思波,张迎春,吴 坤,马晓琳,吴建伟,王 涛
流行性感冒是一种急性呼吸道传染病,多由甲型流感病毒(influenza A virus,IAV)引起。由于全球每年感染的病例数量庞大、传播速度快且病毒变异性强,流感已成为严重威胁公众健康的病毒性传染病之一[1-2]。目前,对流感的主要防治措施主要是疫苗接种和化学药物治疗。流感病毒变异性强,增加了流感疫苗制备的难度,也使疫苗的有效性大大降低[3-7]。随着耐药病毒株的不断出现,现有的抗流感病毒药物已无法满足临床需求[8-11]。因此,寻求新型抗流感病毒药物已成为迫切需要解决的问题。
抗菌肽(Antimicrobial peptides,AMPs)是生物体内对细菌、病毒、真菌等微生物和肿瘤细胞具有抑杀活性的小分子多肽。由于具有广谱抗微生物活性、低毒、不容易产生耐药性等特征,AMPs被认为是新型抗生素的理想候选者[12-13]。MAF-1A(Musca domesticaantimicrobial peptide-1A)来源于家蝇,由26个氨基酸残基构成的小分子抗菌肽[14]。实验研究发现,MAF-1A具有抗流感病毒作用,具有研发新型抗流感病毒药物的潜力,但MAF-1A抗流感病毒活性及其作用机制尚未清楚[15]。本文在此基础上,探讨MAF-1A抗IAV活性和作用机制,为MAF-1A的应用研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 MAF-1A的化学合成 抗菌肽 MAF-1A序列为KKFKETADKLIESAKQQLESLAKEMK,委托生工生物工程(上海)股份有限公司采用FMOC固相合成法合成,高效液相色谱(HPLC)纯化、液相色谱-质谱(LC-MS)验证,多肽合成纯度≥98%。
1.1.2 细胞和病毒 狗肾细胞(MDCK细胞)购自中国医学科学院基础医学院研究所;甲型流感病毒A/PR/8/34(H1N1)为本室保存。
1.1.3 主要试剂 胎牛血清购自德国PAN公司;神经氨酸酶抑制剂筛选试剂盒购自上海碧云天生物技术有限公司;RNAiso Plus试剂盒、逆转录试剂盒(PrimeScriptTMRT Master Mix)、荧光定量PCR试剂盒(SYBR Premix ExTaqTMⅡ)均购自TaKaRA(大连)有限公司;四甲基偶氮唑盐(MTT)购自北京博奥拓达科技有限公司;磷酸奥司他韦购自上海麦克林生化科技有限公司;其他试剂均为国产分析纯。1.1.4 引物合成 委托生工生物工程(上海)股份有限公司合成IAV的qRT-PCR检测基因和内参基因引物HA-F:CCTG CTCGAAGACAGCCACAACG,HA-R:GCTCCCTCAGCTCCTCATAGTCG;GAPDH-F:AGGGCAATGCCAGCCCCAG CG,GAPDH-R:AGGGCAATGCCAGCCCCAGCG。
1.2 方 法
1.2.1 MAF-1A抗IAV活性检测
1.2.1.1 病毒的增殖 按文献[16]方法,将IAV 稀释液接种于9日龄鸡胚尿囊腔,37℃培养箱内孵育至48 h,收获尿囊液,检测血凝效价。
1.2.1.2 MDCK 细胞培养 MDCK 细胞用含10%胎牛血清的DMEM培养基在37℃5%CO2培养箱中培养,待细胞生长至70%~90%,取0.5%胰蛋白酶进行消化成单个细胞,按2×104个∕孔接种于96孔板,待细胞生长至90%单层细胞时备用。
1.2.1.3 病毒对 MDCK 细胞半数感染量(TCID50)测定 将上述96孔板生长的MDCK细胞,去培养液,PBS洗涤3次,将病毒液以10倍系列稀释,分别以100μL/孔接种于单层MDCK细胞,2 h后去掉病毒液,PBS缓冲液洗涤3次,加入等量细胞维持液,每个稀释度重复6个复孔,设细胞培养组为阴性对照,48 h后观察并记录细胞的病变效应;并参照文献[17]方法,按Reed-Muench法计算病毒对细胞的半数感染量TCID50。试验共重复3次。
1.2.1.4 MAF-1A 对IAV 半数有效浓度(EC50)检测 取100×TCID50病毒稀释液50μL与等体积MAF-1A溶液混匀,使MAF-1A终浓度为15.6μg/mL、31.2μg/mL、62.5μg/mL、125μg/mL、250μg/mL、500μg/mL。将混合液于37℃预处理30 min后,接种于单层MDCK细胞,2 h后去除液体,PBS缓冲液洗涤3次,以100μL/孔加入细胞维持液,于37℃、5%CO2培养箱中培养48 h,镜下观察细胞CPE效应;MTT法检测MAF-1A抗病毒有效率。同时,设置细胞培养组和病毒组为对照组,奥司他韦为药物对照组,MAF-1A对流感病毒抑制率(%)按公式计算,并参考文献[18],采用Probit回归法计算半数有效浓度EC50:
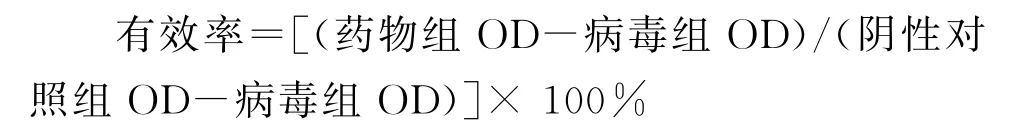
1.2.1.5 qRT-PCR检测MDCK细胞内的病毒载量 取100×TCID50病毒稀释液50μL与等体积MAF-1A溶液混匀,使MAF-1A终浓度为250μg/mL、125μg/mL、62.5μg/mL、31.2μg/mL、15.6 μg/mL。将混合液于37℃预处理30 min后,接种于6孔板中90%单层MDCK细胞,2 h后去混合液,用PBS缓冲液洗涤3次,每孔加入100μL细胞维持液,于37℃,5%CO2培养箱中继续培养24 h后,根据TaKaRA公司的RNAiso Plus和Prime-ScriptTMRT Master Mix试剂盒使用说明书,提取细胞Total RNA并逆转录为cDNA,于-20℃保存备用。参考文献[19],使用qRT-PCR反应试剂盒以管家基因GAPDH为内参,采用2-ΔΔCt法对HA基因mRNA水平进行相对定量。反应条件为:95℃30 s,95℃5 s,60℃30 s,共40个循环。
1.2.2 MAF-1A对 MDCK细胞的毒性检测 将MDCK细胞以2×104个/孔接种于96孔板,待其长成90%单层细胞备用;将MAF-1A溶液进行倍比稀释至10~2 500μg/mL,以上浓度梯度的MAF-1A以每孔100μL加入细胞中,每个浓度设置6个复孔,并设正常对照组(只加入细胞维持液),置CO2培养箱中培养至24 h后倒置显微镜下观察CPE。弃孔内培养基后用PBS洗涤3遍,以10μL/孔加入5 mg/mL的MTT液,继续培养4 h后去上清液,每孔加入DMSO 150μL,振荡摇匀15 min,在酶标仪490 nm波长下测定各孔吸光度值(OD),按公式计算 MAF-1A对MDCK细胞的抑制率[18]。

1.2.3 MAF-1A抗流感病毒作用机制分析
1.2.3.1 MAF-1A 对IAV形态结构的影响 按文献[20]方法,采用醛化鸡红细胞吸附释放法对含甲型流感病毒A/PR/8/34(H1N1)鸡胚尿囊液进行纯化,并检测纯化后病毒的血凝效价。将纯化的病毒液50μL与等体积MAF-1A系列稀释液充分混合,37℃孵育30 min,用0.1%甲醛溶液于37℃灭活48 h,以2%磷钨酸负染色液进行染色,经透射电镜观察病毒形态结构。
1.2.3.2 血凝抑制试验 将25μL 不同浓度的MAF-1A与等体积4倍血凝效价的病毒液混合,于室温孵育30 min后,每孔加入1%c RBC悬液50 μL,室温(20℃~25℃)静置40 min后观察结果,每个浓度作3个复孔。同时,设置病毒组和PBS阴性对照组,试验重复3次。
1.2.3.3 神经氨酸酶抑制试验 按试剂盒说明书操作,在96孔荧光酶标板内每孔加70μL神经氨酸酶检测缓冲液,然后每孔加入10μL神经氨酸酶,再每孔加入10μL各浓度的 MAF-1A,振动摇匀1 min后于37℃ 孵育2 min;加入10μL的神经氨酸酶荧光底物,再振荡1 min,37℃孵育20 min进行荧光测定。根据试剂盒方法计算出样品对神经氨酸酶的抑制百分比。
1.2.4 统计学处理 数据以 (±s)表示,采用SPSS20.0软件以方差分析检验各组间的统计学差异,P<0.05为具有统计学意义。
2 结 果
2.1 病毒滴度及毒力的检测 经检测发现,甲型流感病毒A/PR/8/34(H1N1)在鸡胚中扩增后,其血凝效价为1∶1 280;甲型流感病毒A/PR/8/34(H1N1)对 MDCK细胞的TCID50为1.0×10-5.2/mL。
2.2 MAF-1A对MDCK细胞的毒性 MTT结果显示,当MAF-1A的浓度达2 500μg/mL时,仍对MDCK细胞的生长无明显抑制作用;镜下可见,经MAF-1A作用后细胞的形态和结构完整性与对照组相比未见明显差异。MAF-1A对MDCK细胞表现出较小的细胞毒性。
2.3 MAF-1A抗流感病毒活性 镜下可见,甲型流感病毒A/PR/8/34(H1N1)可导致MDCK细胞变圆,坏死脱落,漂浮在培养液表面。但随 MAF-1A浓度的增高,甲型流感病毒A/PR/8/34(H1N1)病毒所致的CPE不断减弱,当浓度达500 μg/mL时,MDCK细胞完整性好,形态规则,正常细胞数量与阴性对照组无明显差异(图1)。经MTT法检测,MAF-1A具有抗甲型流感病毒A/PR/8/34(H1N1)活性,MAF-1A对病毒的EC50值为(89.8±2.97)μg/mL,且浓度越大,对甲型流感病毒A/PR/8/34(H1N1)的抑制率越高(图2)。qRT-PCR检测结果显示,与IAV组比较,不同剂量(250μg/mL、125μg/mL、62.5μg/mL、31.2μg/mL、15.6μg/mL)的MAF-1A显著抑制了IAV HA mRNA的表达(t=7.39、6.66、5.78、4.75、5.26,P<0.01),并呈剂量依赖性(图3)。
2.4 MAF-1A对病毒形态结构的影响 透射电镜检测结果显示,未经药物处理的病毒对照组病毒颗粒结构完整,而在MAF-1A的作用下,病毒的结构出现变化,随着MAF-1A作用浓度升高,变化更加明显,当浓度达500μg/mL时,病毒颗粒被完全破坏(图4)。
2.5 血凝抑制试验 MAF-1A对流感病毒引起的鸡红细胞凝集具有明显抑制作用,当浓度为1.56 μg/mL时即可抑制流感病毒引起的鸡红细胞凝集(图5A)。而MAF-1A与鸡红细胞单独作用时,不会引起鸡红细胞的凝集(见图5B)。
2.6 神经氨酸酶抑制试验 结果显示,MAF-1A与阳性对照药物奥司他韦相似,也具有抑制甲型流感病毒神经酸酶的作用,MAF-1A浓度增高,抑制效果越明显,其半数抑制浓度IC50为(134.7±10.31)μg/mL(图6)。

图1 MAF-1A抑制流感病毒A/PR/8/34(H1N1)在MDCK细胞中诱导的CPE(×400)Fig.1 MAF-1A inhibited the influenza A/PR/8/34(H1N1)virus induced CPE in MDCK cells(×400)

图2 MAF-1A抗甲型流感病毒A/PR/8/34(H1N1)活性Fig.2 Inhibition rate of the influenza A/PR/8/34(H1N1)virus by MAF-1A

图3 MAF-1A处理后甲型流感病毒HA基因mRNA水平的变化Fig.3 The mRNA level of influenza A/PR/8/34(H1N1)virus HA gene after treatment with MAF-1A

图4 不同浓度MAF-1A对甲型流感病毒H1N1形态结构的影响(×30 000)Fig.4 Effects of MAF-1A on morphological structure of virus(×30 000)

图5 MAF-1A血凝抑制试验Fig.5 Hemagglutinin inhibition assay for MAF-1A
3 讨 论

图6 MAF-1A对神经氨酸酶活性的影响Fig.6 Neuraminidase inhibition assay for MAF-1A
目前流感的防治主要依靠药物和疫苗,但由于耐药病毒株的不断出现以及疫苗作用的局限性,探寻新型、有效的抗流感药物已成为必然。MAF-1A是来源于家蝇幼虫体内的一类新型小分子AMPs,实验研究发现其对多种病毒、真菌具有的抑杀活性,具有新型肽类药物的开发潜能[15]。本实验研究结果显示,MAF-1A可抑制甲型流感病毒A/PR/8/34(H1N1)在MDCK细胞中诱导的CPE,能有效降低MDCK细胞内的病毒载量;MAF-1A对甲型流感病毒A/PR/8/34(H1N1)的EC50值为(89.8±2.97)μg/mL,其对病毒的抑制作用呈剂量相关性,而MAF-1A对MDCK细胞的毒性小。本实验结果证实,MAF-1A具有较强的抗甲型流感病毒A/PR/8/34(H1N1)活性,且毒性较低,表明其具有进一步研究的价值。
探明AMPs的抗病毒作用机制对研究AMPs生物学特性、开发新的抗病毒药物非常重要。研究报道,BPI、LL-37等抗菌肽可破坏病毒颗粒的结构,直接杀灭流感病毒[21-23]。本实验通过透射电镜观察发现,MAF-1A在低浓度下即可改变流感病毒的电子密度,随着浓度增加,对病毒结构破坏越明显,表明MAF-1A能够直接破坏流感病毒形态结构的完整性,导致其不能正常复制增殖。
流感病毒的包膜蛋白包括HA和NA。病毒进入靶细胞是由病毒包膜上的HA介导的。HA由HA1和HA2两个亚基构成,其中 HA1亚基与易感细胞膜表面的唾液酸受体结合,病毒通过胞吞作用进入细胞内。有文献报道,AMPs可以通过与流感病毒HA相互作用,阻断其与宿主细胞的吸附或融合过程,从而有效抑制流感病毒感染[24-26]。本实验发现,MAF-1A能阻止血凝素HA1亚基的血凝作用,因此认为血凝素HA1亚基是其抗流感病毒的作用位点,MAF-1A可能通过与血凝素HA1亚基结合而阻止流感病毒吸附宿主细胞。
流感病毒由细胞内出芽释放时,需借助自身的NA切断病毒蛋白和宿主细胞表面唾液酸之间的连接,才能使子代病毒释放至胞外,感染其他宿主细胞[21-25]。奥司他韦是NA抑制剂,选择性地抑制其活性,干扰流感病毒从细胞的释放,从而达到抗流感病毒的作用[27]。实验结果显示,MAF-1A也能抑制NA的活性,表明对NA的抑制可能也是其抗流感病毒作用机制之一。
综上,MAF-1A不仅能够直接破坏流感病毒的结构,还可以阻止流感病毒的吸附,干扰流感病毒的释放,提示MAF-1A是通过对多靶点作用而发挥抗流感病毒效应,但其抗流感病毒关键机制及其与靶点的结合模式有待进一步研究。本研究为MAF-1A的深入探讨和开发、利用提供了实验依据。
利益冲突:无
引用本文格式:朱志翠,邓思波,张迎春,等.家蝇抗菌肽MAF-1A体外抗甲型流感病毒活性及机制研究[J].中国人兽共患病学报,2019,35(9):791-796.DOI:10.3969/j.issn.1002-2694.2019.00.085

