中国健康汉族人基因组DNA中干扰素α1和干扰素α2等位基因组成的测定
王 兵, 杨昊欣, 杨 楠, 鞠泳兴, 卢 晨, 程联胜, 龚庆国
(1. 安徽省生物研究所, 合肥 230001; 2. 合肥安科精准医学检验所有限公司, 合肥 230001; 3. 中国科学技术大学 生命科学学院, 合肥 230026)
干扰素(interferon,IFNs)是一类具有广谱抗病毒、抗增殖和免疫调节活性的多功能细胞因子家族,根据结合受体不同,可以分为Ⅰ型、Ⅱ型和Ⅲ型干扰素[1]。Ⅰ型干扰素属于多基因家族,人体内共有17个Ⅰ型干扰素亚型,包括13个IFNα、1个IFNβ、1个IFNε、1个IFNκ和1个IFNω[2]。其中,IFNα1和IFNα2是首先发现和批准应用于临床的两个α干扰素亚型[3]。
迄今为止,人类IFNα1共计发现3个等位基因,彼此之间仅有两个核苷酸位点的差异,分别位于IFNα1基因编码区的410和541核苷酸位点。人类IFNα1基因有IFNαD、IFNα1和IFNα1/158Val 3个等位基因[4]。成熟的IFNαD蛋白氨基酸序列114位为缬氨酸残基(GTG)、158位为亮氨酸残基(TTG),由Nagata等人于1980年从急性髓系白血病细胞系(KG-1)cDNA中克隆的[5]。IFNα1蛋白氨基酸序列114位为丙氨酸残基(GCG)、158位为亮氨酸残基(TTG),由Goeddel等人于1981年从人胎肝染色体基因文库中分离的[6], IFNα1/158Val蛋白氨基酸序列114位则为丙氨酸残基(GCG)、158位为缬氨酸残基(GTG),其基因由我国学者黎孟枫等人于1991年从中国汉族人胎肝染色体中克隆的[4]。 同样,IFNα2基因也仅发现3个等位基因,分别为IFNα2a、IFNα2b和IFNα2c,其编码基因也仅有137和170核苷酸位点存在差异。IFNα2a基因是1980年由美国学者Goeddel在急性髓系白血病细胞系(KG-1)cDNA中克隆的[7],IFNα2b基因是1980年由美国学者Streuli从健康白种人外周血白细胞中克隆的[8],IFNα2c基因是1985年由美国学者Bodo从Namalwa类淋巴母细胞系中克隆的[9]。成熟的IFNα2a蛋白特征是23位氨基酸残基为赖氨酸(AAA)、34位为组氨酸残基(CAT),IFNα2b蛋白在23位为精氨酸(AGA)、34位为组氨酸(CAT),IFNα2c蛋白在23位(AGA)和34位(CGT)均为精氨酸残基。
早在20世纪90年代,就有关于人干扰素α2等位基因变异体在人基因组DNA中组成的研究。Lee等人[10]调查了干扰素α2等位基因变异体在北美大规模人群中的分布情况,发现超过99.9%人群含有IFNα2b基因,不超过0.04%的小比例人群拥有IFNα2c基因,IFNα2a基因没有在正常人群中检测出来。Kita等人[11]检测了103例健康日本人基因组DNA中IFNα2等位基因的组成,结果显示103例健康日本人体内只检测出IFNα2b基因,没有检测出IFNα2a和IFNα2c基因。然而,尚没有干扰素α1等位基因在正常人群中分布情况和干扰素α2等位基因在中国汉族人群中分布情况的研究报道。鉴于此,本研究通过测定100例中国汉族志愿者外周血基因组干扰素α1和干扰素α2基因PCR扩增产物DNA序列的方法,旨在探明干扰素α1和干扰素α2等位基因在中国健康汉族人群基因组DNA中的分布情况。
1 材料和方法
1.1 血样采集
招募100例健康中国汉族自愿献血者,其中女41人,男59人,最小年龄21周岁,最大年龄50周岁,平均年龄 29.9(±5.8)周岁。100例自愿献血者来自全国20个省、直辖市和自治区。所有自愿献血者均符合以下要求:1)父母双方均为汉族;2)性别、年龄不限; 3)无乙肝、丙肝等传染疾病史;4)近6个月内检查无肿瘤和血液疾病;5)排除孕妇、哺乳期女性。采集每名志愿者外周血2~4 mL于5 mL医用抗凝血采集管内,放置于-20 ℃冰箱保存待用。
1.2 提取外周血基因组DNA
从-20 ℃冰箱取出志愿者抗凝血血液样本,在50 ℃水浴锅中加热融解。取2 mL血液样本与4 mL裂解液混合[10%蔗糖,5 mmol/L氯化镁,5 mL Tris-HCl(pH 8.0),1.0% Triton ×100],离心收集细胞核后加入2.2 mL细胞核裂解液[0.1 mol/L Tris-HCl(pH 8.0),20 mmol/L EDTA (pH 8.0),0.15 mol/L NaCl,1% SDS溶液]和80 μL蛋白酶K(10 mg/mL),50 ℃水浴3 h。加入等体积5 mol/L乙酸铵离心去除蛋白,上清液加入等体积的异丙醇沉淀全血基因组DNA,然后溶于100 μL 10 mmol/L Tris-HCl(pH 8.0)溶液中,测定DNA浓度后,于-20 ℃冰箱保存备用。

图中显示是IFNα1基因189个密码子(包括信号肽和成熟IFNα1蛋白)和57个bp的3′端非编码区核苷酸片段,大写字母部分表示编码区核苷酸序列,小写字母部分表示3′端非编码区核苷酸序列。下划线部分表示引物IA1-P1和IA1-P2对应的核苷酸序列位置。阴影字母表示3个干扰素α1等位基因在410和541位点上的核苷酸序列差异, IFNαD:Val114(GTG),Leu158(TTG);IFNα1:Ala114(GCG),Leu158(TTG); IFNα1/158Val:Ala114(GCG),Val158(GTG)
图1干扰素α1基因核苷酸序列
Figure 1 The nucleotide sequence of interferon alpha 1 gene
1.3 PCR引物设计
PCR引物使用Primer Premier 5软件进行设计。干扰素α1基因片段扩增PCR引物序列为:IA1-P1:5′-GATGGTCCTGGTGGTGCT-3′;IA1-P2: 5′-AAGCGTGACCTGGTGTATGA-3′。IA1-P2引物为长度20 bp的3′端非编码区核苷酸序列互补片段,引物IA1-P1和IA1-P2位置以及其扩增干扰素α1基因片段序列见图1。引物IA1-P1和IA1-P2可以扩增出长度为601 bp片段,包含干扰素α1基因后面181个密码子和3′端57个非编码区核苷酸,待检测的干扰素α1基因的410和541位点核苷酸位于该基因片段内。
干扰素α2基因片段扩增PCR引物序列为:IA2-P1:5′-AGGTTTAGGCTCACCCATTTC-3′;IA2-P2:5′-ACAGGCTTCCAGGTCATTCA-3′。IA2-P2引物为长度20 bp的编码区互补序列,引物IA2-P1和IA2-P2位置以及其扩增干扰素α2基因片段序列见图2。引物IA2-P1和IA2-P2可以扩增出长度为415 bp片段,包含IFNα2基因前121个密码子和52个bp的5′端非编码区核苷酸,待检测的干扰素α2基因137和170位点核苷酸位于该片段内。

图中显示是IFNα2b基因前121个密码子(包括信号肽)和52个5′端非编码区核苷酸片段,大写字母部分表示编码区核苷酸序列,小写字母部分表示5′端非编码区核苷酸序列。下划线部分表示IA2-P1和IA2-P2对应的核苷酸序列位置。阴影字母表示3个干扰素α2等位基因在137和170位点上存在的核苷酸序列差异, IFNα2a:Lys23(AAA),His34(CAT);IFNα2b:Arg23(AGA), His34(CAT); IFNα2c:Arg23(AGA), Arg23(CGT)
图2IFNα2b基因部分核苷酸序列
Figure 2 The nucleotide sequence of interferon alpha 2b gene
1.4 PCR扩增
取100 ng全基因组DNA放置于PCR反应混合物中,PCR反应混合物包括10 μL 2×PremixTaqTM(TaKaRa),1 μL上游引物IA1-P1或IA2-P1,1 μL下游引物IA1-P2或IA2-P2,并加dddH2O至总反应体积为20 μL,10 μL矿物油覆盖PCR反应混合物以防止水分的蒸发。PCR产物扩增反应采用美国BIO-RAD伯乐T100 PCR仪进行,反应程序设置如下:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,34个循环;72 ℃延伸反应7 min后,于4 ℃下保存。反应完成后取5 μL反应液在1.5%含溴乙锭的琼脂糖凝胶进行电泳,紫外灯下观察电泳结果,以评估PCR扩增的效果。
1.5 PCR扩增产物测序
采用全自动DNA测序仪对扩增出的干扰素α1和干扰素α2基因DNA片段进行核苷酸序列测定。对IA1-P1、IA1-P2扩增的干扰素α1基因片段使用IA1-P1引物进行单端测序,对IA2-P1、IA2-P2扩增的干扰素α2基因片段使用IA2-P1引物进行单端测序。核苷酸序列测定具体操作方法为:1)PCR产物模板DNA的处理。向PCR原液中加入Exonuclease I和虾碱性磷酸酶,放入PCR仪中37 ℃孵育10 min,然后80 ℃变性2 min。2)测序扩增。使用BigDye® Terminator v3.1测序试剂盒,按照试剂盒要求配制测序反应体系,包括8 μL BigDyeTMTerminator 3.1 Ready反应混合物、2 μL(约300 ng)引物IA1-P1或IA2-P1、2 μL PCR扩增产物模板DNA和6 μL dddH2O,反应总体积为20 μL,再加入10 μL矿物油覆盖反应液相。测序扩增反应条件:96 ℃预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min;反应后于4 ℃下保存。3)测序反应产物纯化。按照BigDyeTM V3.1测序试剂盒的使用操作手册进行,采用乙醇/醋酸钠的方法纯化,纯化后的测序产物放置于室温下晾干。4)上样和电泳。在纯化后的测序反应产物DNA中加入Hi—Di去离子甲酰胺10 μL,在PCR仪上95 ℃变性 4 min,然后迅速置于冰上冷却4 min。使用美国ABI 3730xl DNA基因分析仪进行毛细管电泳,收集数据并用chromas软件分析测序结果。
2 结果与分析
2.1 PCR产物的扩增
琼脂糖凝胶电泳显示,以人外周血基因组DNA为模板,采用IA1-P1、IA1-P2引物对和IA2-P1、IA2-P2引物对可以明显扩增出一条特定的基因片段,根据DNA分子量Marker判断,IA1-P1、IA1-P2引物对扩增片段长度约为600 bp, IA2-P1、IA2-P2引物对扩增DNA片段长度介于400~500 bp,两者均与设计长度相一致,基本可以判定为干扰素α1和干扰素α2基因DNA片段,如图3所示。

泳道1、2、3为IA2-P1、IA2-P2引物对的PCR扩增产物电泳结果,分别以1、13、22号志愿者外周血基因组DNA为模板;泳道4、5、6为IA1-P1、IA1-P2引物对PCR扩增产物电泳结果,分别以4、6、29号志愿者外周血基因组DNA为模板;DNA Marker片段长度从上至下相应为100、200、300、400、500、600 bp
图3IA1-P1、IA1-P2引物对和IA2-P1、IA2-P2引物对扩增产物的电泳情况
Figure 3 Electrophoresis maps of the amplified products of primers(IA1-P1,IA1-P2)and primers (IA2-P1,IA2-P2)
2.2 干扰素α1基因序列分析
使用IA1-P1引物对扩增的干扰素α1基因DNA片段进行单端测序,可以清晰测出长度约为600 bp的核苷酸序列,测序结果均能分析出干扰素α1基因中+410和+541位点核苷酸的碱基类型,如图4所示。100例中国健康人群基因组DNA中仅检测出IFNα1基因,没有检测出IFNαD和IFNα1/158Val两种干扰素α1基因变异体。所有样本的干扰素α1基因的+410位点碱基均为胞嘧啶(C),+541位点碱基均为胸腺嘧啶(T)。除了待检测两个核苷酸位点外,其他所有的核苷酸序列均与NCBI和UCSC数据库中公布的IFNα1基因完全一致。
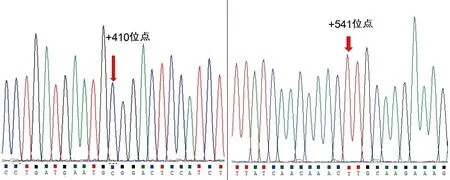
100例中国健康汉族人的IFNα1基因+410位点均为胞嘧啶(C),+541位点均为胸腺嘧啶(T),对应密码子分别为GCG(Ala114)和TTG(Leu158)
图4IFNα1基因+410位点和+541位点核苷酸序列分析图谱
Figure 4 The nucleotide sequencing map of IFN alpha1 gene at the sites of +410 and +541
2.3 干扰素α2基因序列分析
使用IA2-P1引物对扩增的干扰素α2基因DNA片段进行单端测序,可以清晰测出长度约为400 bp的核苷酸序列,测序结果均能分析出干扰素α2基因中+137和+170位点核苷酸位点的碱基类型,如图5所示。同样,100例中国健康人群基因组DNA中仅检测出IFNα2b基因,且所有样本的核苷酸序列均与NCBI和UCSC数据库中公布的IFNα2b基因序列完全一致,没有发现其他核苷酸位点的突变。
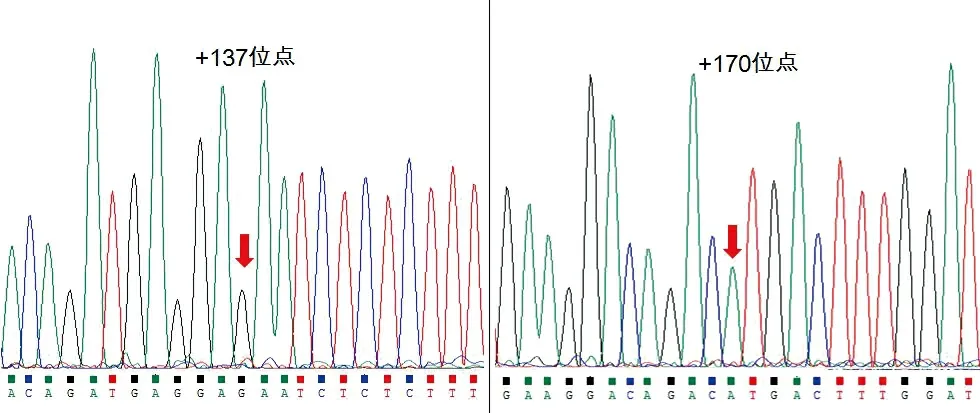
100例中国健康汉族人的干扰素α2基因+137位点均为鸟嘌呤(G),+170位点均为腺嘌呤(A),对应密码子分别为AGA(Lys23)和CAT(His34)
图5干扰素α2基因+137位点和+170位点核苷酸序列分析图谱
Figure 5 The nucleotide sequencing map of IFN alpha2 gene at the sites of +137 and +170
3 讨论
为了测定干扰素α1和干扰素α2等位基因在中国汉族人群中的分布,我们抽取了100例健康中国汉族人外周血白细胞基因组DNA,采用PCR方法分别扩增了长度为601 bp的干扰素α1基因片段和长度为415 bp的干扰素α2基因片段,两种干扰素α基因的扩增片段均包含待测的核苷酸位点。由于所有13种α干扰素基因均没有内含子且相互之间具有50%以上氨基酸序列的同源性[12],特别是干扰素α1和干扰素α13基因蛋白编码区氨基酸序列完全相同[13],为了仅获得我们所需要的特异干扰素α1和α2基因片段,而不是其他的α干扰素基因片段,两对基因扩增引物均包括了编码区和非编码区核苷酸序列。这些序列均根据NCBI和UCSC数据库公布的人类基因组序列获得的,我们首先确定干扰素α1基因编码序列位于(chr9:21 440 508-21 441 077)和干扰素α2基因编码序列位于(chr9:21 384 763-21 385 329)区域,然后分别查获两个基因5′和3′端非编码区长度为100 bp的核苷酸序列,再采用引物设计软件获得设计的引物。实验结果证实我们获得了想要的DNA片段,为大范围的人群干扰素α1和干扰素α2基因测序提供了保证。
本研究结果表明,IFNα1基因在中国汉族人群中属于干扰素α1的优势等位基因,且没有发现IFNα1基因其他核苷酸位点的突变。这与Manry等人[14]报道IFNα1基因在186例健康撒哈拉以南非洲、欧洲和亚洲健康人中的非同义或无义突变比例高达94.6%的内容不符,有待于以后的研究来进一步确认。从结构上看,IFNα1拥有166个氨基酸残基,含有5个半胱氨酸(Cys),其中1和99位Cys之间形成二硫键,29和139位Cys形成二硫键,86位上是第5个Cys。从生物学活性上看,IFNα1在老鼠细胞上抗病毒活性较高[15-16],但在人体细胞上的抗病毒活性在所有13个IFNα亚型中是最低的[17]。目前,在GenBank数据库中检索不到IFNα1b的基因序列,因此,关于IFNα1b基因的来源问题目前有3种说法。第一种说法认为IFNα1b是我国学者将美国Goeddel等人发现的IFNα1进行重命名[4];第二种说法认为IFNα1b是中国学者从中国人脐带血白细胞中克隆的新基因[18];第三种说法认为IFNα1b是IFNα1的变异体,因为在生产过程中86位上的Cys会干扰IFNα1蛋白的复性,导致出现较多的异构体蛋白,我国学者将其突变为天冬氨酸(Asp),并构建了相应的IFNα1b表达菌株[19]。
另外,在100例中国汉族人群中仅检测出IFNα2b基因,没有检测出IFNα2a和IFNα2c基因,也没有发现IFNα2b基因其他核苷酸位点的突变。本研究结果与Manry等人[14]报道结果相一致,在186例健康撒哈拉以南非洲、欧洲和亚洲健康人中干扰素α2基因非同义或无义突变比例仅为1.08%;同时与Lee等[10]和Kita等[11]研究结果相一致,Lee等人报道在28 000个北美人群中IFNα2b属于优势等位基因,其中16例中国人仅检出IFNα2b基因;Kita等人报道103例健康日本人仅检测出IFNα2b基因,IFNα2c基因仅在白血病患者中比例较高。本次研究结果和以上文献均支持IFNα2b序列是中国汉族人和现代智人的优势等位基因。另外,有研究显示[20]10 700个健康人白细胞经病毒诱导后主要分泌IFNα2b。Manry等[14]认为IFNα2b基因在苛刻的自然选择下的突变阻断预示着其在抗病毒和预防癌症等生理功能方面是必不可少的。从蛋白结构上看,成熟的IFNα2b含有165个氨基酸残基,而其他人类干扰素α蛋白均拥有166个氨基酸残基,从序列分析其缺少了44位上的天冬氨酸残基[3]。IFNα2b特有的蛋白结构在人类细胞培养上表现出非常高的抗病毒活性[17],但在小鼠细胞上的活性却较低,并不能保护小鼠细胞免受病毒的感染[15-16]。与干扰素α1基因在整个有胎盘哺乳动物广泛存在不同, 干扰素α2属于灵长类哺乳动物特有的干扰素基因[21],而IFNα2b则可能属于人类特有的干扰素亚型。
早在20世纪90年代,国外研究已经证实注射重组人干扰素α2b(rhIFNα2b)治疗后患者血清中α干扰素的中和抗体和结合抗体发生率显著低于rhIFNα2a。Von Wussow等[22]报道rhIFNα2a在慢性粒细胞白血病患者中的抗体产生率显著高于rhIFNα2b,且其诱导的血清抗体滴度也很高。Antonelli等[23]在慢性乙型肝炎患者中以及学者Oberg[24]在实体瘤患者中均证实注射rhIFNα2a的抗体产生率显著高于rhIFNα2b。由此表明,在临床使用中,与人群基因型不匹配的rhIFNα2a的免疫原性较高,而与人体基因型匹配的rhIFNα2b免疫原性较低,更适合人体内注射使用。本次研究基本明确了中国汉族人群中干扰素α1和α2基因多样性的遗传背景信息,有助于临床对重组人干扰素α的正确选择,有助于提升重组人干扰素α的临床治疗效果。
本次研究结果显示:在中国健康人群中仅检测出IFNα1和IFNα2b基因,没有检测出IFNαD和IFNα1/158Val两种干扰素α1基因变异体,也没有检出IFNα2a和IFNα2c两种干扰素α2基因变异体。尽管IFNα1的基因序列与中国汉族人遗传背景匹配,但是其在人体细胞中的抗病毒较低;而IFNα2b是人类特有的高活性干扰素和人类白细胞分泌的主要干扰素亚型,属于中国汉族人的基因,更适合中国人使用。

