改良法处理人脱细胞真皮的脱细胞效果及其与体外细胞的相容性研究
邓霞 钟惠兰
[摘要]目的:研究经改良法处理后的人脱细胞真皮的脱细胞效果及其与体外细胞的相容性。方法:分别使用传统方法与改良方法脱去健康人皮肤的细胞成分,观察两种方法制备的脱细胞真皮的外观、HE染色结果、脱细胞效率、胶原纤维的完整度、体外降解时间、孔隙率、孔腔直径、细胞毒性及体外细胞相容性,并进行对比分析。结果:改良法制备的脱细胞真皮柔韧度更好,塑形性更高;经HE染色后,改良法制备的真皮孔隙均匀、结构疏松、胶原纤维较传统方法更为纤细;改良法制备的脱细胞真皮的孔隙率及真皮网状面孔隙直径均优于传统方法,组间比较差异有统计学意义(P<0.05);两组脱细胞真皮的基底层孔隙直径及体外降解时间比较差异无统计学意义(P>0.05);改良方法制备的脱细胞真皮8d内连续检测结果均显示无细胞毒性。经改良法制备的脱细胞真皮上的干细胞浸润基底层,且浸润范围随时间增加而扩大,细胞数量明显增加,而传统方法制备的脱细胞真皮无明显浸润现象。结论:改良方法不仅操作简单,且制备的脱细胞真皮的脱细胞效果较好,无细胞毒性,体外相容性更佳。
[关键词]脱细胞真皮;相容性;改良法;体外细胞;孔隙率
[中图分类号]R329.2 [文献标志码]A [文章编号]1008-6455(2019)10-0102-03
Abstract: Objective To study the acellular effect of human acellular dermis treated by modified method and its compatibility with cells in vitro. Methods The appearance, HE staining results, acellular efficiency, integrity of collagen fibers, degradation time in vitro, porosity, pore diameter, cytotoxicity and cytocompatibility of acellular dermis prepared by the two methods were observed and compared. Results The modified acellular dermis had better flexibility and higher plasticity. After HE staining, the improved acellular dermis had uniform pore, loose structure and finer collagen fibers than the traditional method. The porosity and pore diameter of the acellular dermis prepared by the improved method were better than the traditional method, and the difference between the two groups was significant (P<0.05). There was no significant difference in basal pore diameter and degradation time in vitro (P>0.05). The acellular dermis prepared by the improved method showed no cytotoxicity within 8 days. Stem cells infiltrated the basal layer of the acellular dermis prepared by the improved method, and the infiltration range increased with time, and the number of cells increased significantly. However, the acellular dermis prepared by the traditional method had no obvious infiltration. Conclusion The modified method is not only simple in operation, but also has better acellular effect, no cytotoxicity and better compatibility in vitro.
Key words: acellular dermis; compatibility; improved method; in vitro cell; porosity
無论是天然牙还是种植牙,牙龈缺损、过窄或过薄,都对美观性产生影响,且不利于牙周健康。而脱细胞真皮是一种很好的牙龈替代物,能够修复或重建天然牙、种植牙及义齿周围牙龈的宽度及厚度[1],帮助患者重新恢复功能及美观性。脱细胞真皮是一种仅具有真皮基质,且完整保留了细胞外基质的结构及形态、成分及基底膜等,为种子细胞的生长与分化提供所需环境的理想的支架材料[2]。脱细胞真皮能够将供体皮肤中易引起排斥反应的成纤维细胞、血管内皮细胞等成分脱出,仅保存完整的低抗原性细胞外基质成分,且其独有的三维结构为细胞提供了一个生长代谢的立体框架,使细胞外基质蛋白能促进表皮细胞的附着与增生,促进细胞相容性,使组织的生理性修复得到完成[3]。研究显示,脱细胞真皮具有良好的生物相容性、极低的抗原性、快速血管化及较高稳定性的特点[4],能够促进机体表皮的再生及修复[5]。生物相容性是生物材料贯穿始终的主题,对生物医用材料而言,脱细胞真皮的生物相容性直接决定了材料的应用效果。脂肪干细胞是组织工程中广泛应用的一种种子细胞[6]。Ribeiro等使用异种脱细胞真皮对拔牙后的软组织创面进行修补,取得良好效果[7]。Basegmez等研究结果显示,脱细胞真皮不仅不影响种植体与骨的结合,且手术创伤小、修复效果及美观性良好[8]。但现有的脱细胞真皮方法复杂,且尽管去除了毛发、腺体、血管后,残留有部分腔隙,但是孔隙率仍较低,细胞渗透性差,影响宿主细胞及血管的生长。本次实验采用改良方法进行脱细胞真皮的制备,并将传统方法与改良方法制备的脱细胞真皮的脱细胞效果及体外细胞相容性进行对比,现将结果报道如下。
1 材料和方法
1.1 材料:选取本院整形外科行常规皮肤移植术后多余的臀部皮肤组织作为皮肤样本,入选者年龄24~44岁,均无传染性疾病及皮肤病变等。本次研究经笔者医院伦理委员会批准。
1.2 方法
1.2.1 脱细胞真皮的制备[9]:①传统法:无菌状态下将所选皮肤组织的皮下脂肪减除,放入1mol/L的氯化钠溶液(上海玉博生物科技有限公司)中37℃作用24h,然后除去表皮,放入2%的氫氧化钠溶液中37℃进行摇床处理16h,使用链霉素磷酸盐缓冲液(PBS,上海远慕生物科技有限公司)将溶液冲洗至中性。将所得皮片按照-80℃冷冻、37℃水浴箱复温、洗涤,反复冻融4次,每次4h。完成后使用冷冻干燥机冻干,将所得脱细胞真皮4℃密封备用;②改良法:将所选皮肤组织的皮下脂肪组织在无菌状态下剪除,放入1mol/L的氯化钠溶液中37℃作用24h将表皮去除,然后放入2%的氢氧化钠溶液中45℃进行摇床处理4h,使用PBS将溶液冲洗至中性。进行冷冻干燥后4℃密封备用。
1.2.2 染色:两种方法均先使用4%的多聚甲醛固定24h,再用石蜡包埋,然后进行切片、HE染色,用树脂进行封片,在显微镜下观察并拍照记录。
1.2.3 性状检测:①孔隙率:将脱细胞真皮冷冻干燥后,进行称重(W1);加入50ml 75%的乙醇离心管,抽真空至不再有气泡溢出,连同含有乙醇及支架材料的离心管一起进行称重(W2);将含有乙醇支架材料取出,对剩余的乙醇及离心管称重(W3);所有称重结果均精确至0.001g。孔隙(P)率:P(%)=(W2-W3-W1)/(W2-W3)×100%;②体外降解时间:称取冷冻干燥后的脱细胞真皮0.02g,使用1.0ml胶原酶37℃滴入,记录消化至液体完全澄清所用时间;③孔腔直径:使用3%的戊二醛将脱细胞真皮固定4℃过夜,然后使用PBS进行冲洗,每次10min,连续3次,使用梯度乙醇+六甲基二硅氨烷脱乙醇进行脱水后,进行冷冻、干燥、喷金,拍照记录,使用Image J测量孔隙直径;④细胞毒性:参照《医疗器械生物学评价第5部分:体外细胞毒性实验》中的方法提取脱细胞真皮浸润液。3cm2表面积(双面)加入1ml RPMI1640+10% FBS培养基,加入二氧化碳培养箱孵育24h后收集浸润液;体积比0.64%苯酚作为阳性对照,聚乙烯浸润液作为阴性对照,RPMI1640+10% FBS则作为空白对照;将5×104/ml的P3脂肪干细胞以100μl接种于96孔板,常规培养24h后再以阳性、阴性及空白三组浸润液以100μl/孔进行培养,并连续8d使用MTT法对细胞增殖活性进行检测,每日检测4孔/组。
1.3 细胞毒性的评价标准:根据《非直接接触血液的医用生物材料生物性能测试标准》中的6级毒性分级法进行评定:0级,细胞相对增殖率(RGR)≥100%;1级,RGR为75%~99%;2级,RGR为50%~74%;3级,RGR为25%~49%;4级,RGR为1%~24%;5级,RGR为0%。评分在2级及2级以上者,说明材料存在细胞毒性[10]。
1.4 细胞相容性:以每孔2×104个细胞将P4脂肪干细胞接种于浸泡过完全培养基48h的脱细胞真皮中,孵育8d后用甲醛进行固定,使用HE染色后观察两种脱细胞真皮上脂肪干细胞生长及浸润程度。
1.5 观察与评价指标:观察两种方法制备的脱细胞真皮的外观、染色结果、孔隙率、孔腔直径、体外降解时间及细胞毒性,并进行对比分析;对比两种方法制备的脱细胞真皮的体外相容性。
1.6 统计学分析:应用SPSS 19.0软件进行统计分析,计量资料用(x?±s)表示,使用t检验;计数资料用率(%)表示,使用χ2检验;不同浓度脱细胞真皮浸润液及空白对照吸光度间比较采用单因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 外观比较:两种方法制备的脱细胞真皮经肉眼观察颜色无差异,均呈乳白略带微黄色;但改良法制备的真皮表面可见孔隙,柔韧度更好,塑形性更高,更利于手术操作。
2.2 染色结果比较:经HE染色后,两种脱细胞真皮细胞成分均被完全脱去,均未见蓝染细胞核及残留,胶原纤维均完整,且较传统方法,改良法制备的真皮孔隙均匀、结构疏松、胶原纤维更为纤细。
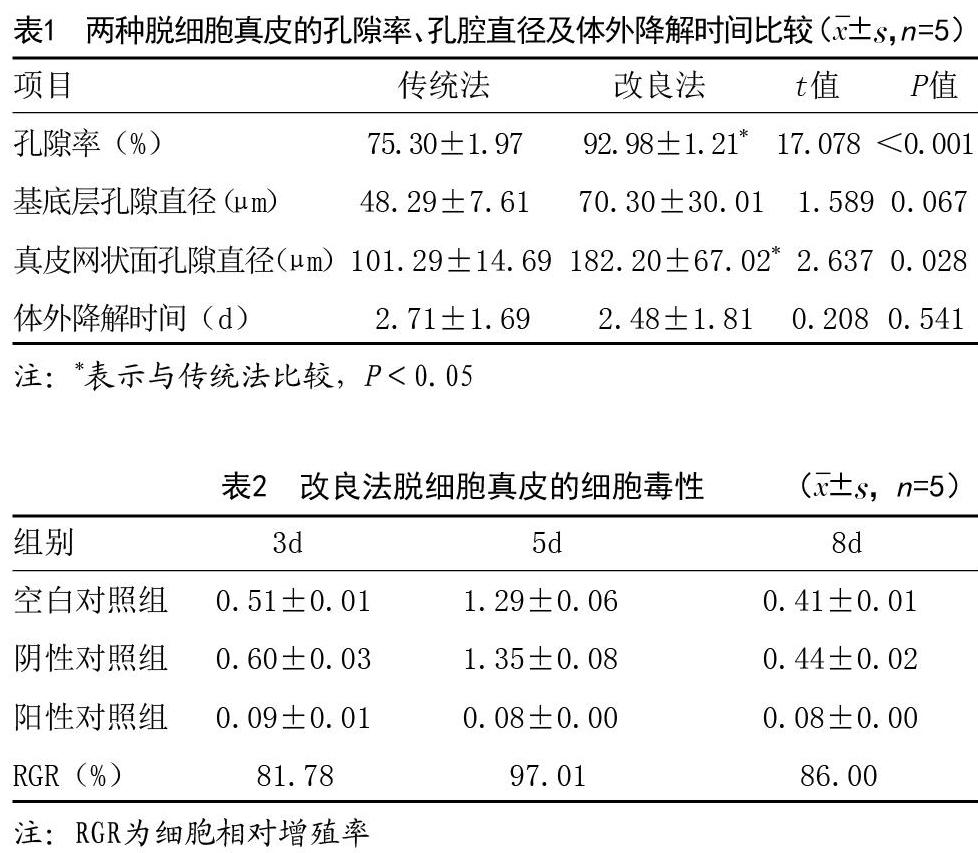
2.3 两种脱细胞真皮的孔隙率、孔腔直径及体外降解时间比较:改良法制备的脱细胞真皮的孔隙率及真皮网状面孔隙直径均优于传统方法,组间比较差异有统计学意义(P<0.05);但改良法脱细胞真皮的基底层孔隙直径及体外降解时间与传统法比较差异无统计学意义(P>0.05),见表1。
2.4 改良法脱细胞真皮的细胞毒性:改良方法制备的脱细胞真皮8d内阳性对照组、阴性对照组及空白对照组的脱细胞真皮的连续检测结果均显示无细胞毒性。见表2。
2.5 体外细胞相容性:将P4脂肪干细胞接种于经两种不同方法制备后的脱细胞真皮上,8d后传统法制备的脱细胞真皮的基底膜面呈现单层-复层生长,无明显浸润现象;8d后改良法制备的脱细胞真皮上的干细胞浸润基底层,且浸润范围随时间增加而扩大,细胞数量明显增加。
3 讨论
脱细胞真皮基质是一种经过特殊方式去除皮肤组织内细胞及抗原而保留细胞外基质的生物材料[11]。研究证实,脱细胞真皮够为细胞的生长及细胞外基质的重建提供良好的环境,提高移植的成活率,降低创面收缩率,减轻瘢痕挛缩[12]。目前脱细胞真皮已广泛应用于整形外科、眼科、口腔科及烧伤科等临床学科[13]。邵小均等[14]研究结果证实,脱细胞真皮在口腔颌面部各类创面的修复中起到创面覆盖、引导组织再生和支架的作用。时长江等[15]研究证实,在治疗各种创面的修复过程中,将脱细胞真皮作为载体,联合种子细胞治疗各种创面的修复及组织重建,亦取得良好效果。陈武等[16]研究证实,牙周膜细胞在脱细胞真皮表面黏附及增殖情况良好。组织相容性是衡量生物材料的重要指标之一,而制备的脱细胞真皮的孔隙率、通透性等均会对细胞的浸润生长产生影响。因此制备脱细胞真皮的各种方法的重点均是尽量去除皮肤组织的细胞成分,提高脱细胞真皮的相容性。另外据报道,脱细胞真皮的孔隙率、孔腔大小及各种细胞因子等都会对脱细胞真皮的血管化产生影响[13]。
张爱君等[17]研究证实,通过调节制备过程中碱液的浓度能够有效调节脱细胞真皮的微结构,使其孔腔直径与孔隙率增大,而冷冻处理则可以使细胞外基质更加疏松。本次实验结果显示,传统方法与改良方法制备的脱细胞真皮经肉眼观察颜色无差异,均呈乳白略带微黄色,但经改良法制备的真皮表面可见孔隙,柔韧度更好,塑形性更高,更利于手术操作;而经HE染色后,两种脱细胞真皮细胞成分均被完全脱去,均未见蓝染细胞核及残留,胶原纤维均完整,且较传统方法,改良法制備的真皮孔隙均匀、结构疏松、胶原纤维更为纤细;且改良法制备的脱细胞真皮的孔隙率及真皮网状面孔隙直径均优于传统方法,组间比较差异有统计学意义。说明相对传统法而言,改良法制备的脱细胞真皮更利于细胞的浸润生长。两组脱细胞真皮的基底层孔隙直径及体外降解时间比较差异无统计学意义;改良方法制备的脱细胞真皮8d内连续检测结果均显示无细胞毒性,说明经改良法制备的真皮安全可靠。笔者将P4脂肪干细胞接种于经两种不同方法制备后的脱细胞真皮上,8d后传统法制备的脱细胞真皮的基底膜面呈现单层-复层生长,无明显浸润现象;而改良法制备的脱细胞真皮上的干细胞浸润基底层,且浸润范围随时间增加而扩大,细胞数量明显增加。结果与姜涛等[18]研究一致,说明改良方法去除细胞更彻底,制备的脱细胞真皮的体外相容性及临床使用效果更好。
综上所述,应用改良方法制备的脱细胞真皮,不仅方法简单,且制备出的脱细胞真皮质地更利于手术操作,孔隙率及孔腔直径均优于传统方法,且无细胞毒性,与体外细胞的相容性较传统方法亦更佳。
[参考文献]
[1]关巍,汪昌宁.脱细胞异体真皮基质在牙周病学中的应用[J].国际口腔医学杂志,2017,44(6):669-673.
[2]Szabo AZ,Fong S,Yue L,et al.The CD44+ ALDH+ population of human keratinocytes is enriched for epidermal stem cells with long-term repopulating ability[J].Stem Cells,2013,31(4):786-799.
[3]罗志军,黎洪棉,王和庚,等.脱细胞异体真皮基质与人脂肪干细胞的生物相容性[J].中国组织工程研究,2012,16(25):4616-4621.
[4]Cronin H,Goldstein G.Biologic skin substitutes and their applications in dermatology[J].Dermatol Surg,2013,39(1):30-34.
[5]Banyard DA,Bourgeois JM,Widgerow AD,et al.Regenerative biomaterials:a review[J].Plast Reconstr Surg,2015,135(6):1740-1748.
[6]Kuroda K,Kabata T,Hayashi K,et al.The paracrine effect of adipose-derived stem cells inhibits osteoarthritis progression[J].BMC Musculoskelet Disord,2015,16(1):1-10.
[7]Ribeiro S,Ferreira V,Stutz B,et al.Evaluation of the zone of keratinized tissue using exposed acellular dermal matrix over tooth extraction sites[J].Implant Dent,2015,24(2):180-184.
[8]Basegmez C,Karabuda ZC,Demirel K,et al.The comparison of acellular dermal matrix allografts with free gingival grafts in the augmentation of peri-implant attached mucosa:a randomised controlled trial[J].Eur J Oral Implantol,2013,6(2):145-152.
[9]姜涛,张爱君,李雪阳,等.人新型脱细胞真皮制备及性状分析[J].中国组织工程研究,2016,20(7):1006-1012.
[10]熊武,张彪,蔡昫,等.新型脱细胞真皮基质的制备及相关性能实验研究[J].中国医师杂志,2017,19(7):1018-1021.
[11]Kocak E,Nagel TW,Rd HJ,et al.Biologic matrices in oncologic breast reconstruction after mastectomy[J].Expert Rev Med Devices,2014,11(1):65-75.
[12]Kuna VK,Padma AM,Hakansson J,et al.Significantly accelerated wound healing of full-thickness skin using a novel composite gel of porcine acellular dermal matrix and human peripheral blood cells[J].Cell Transplant,2017,26(2):293-307.
[13]杨荣强.异种脱细胞真皮基质临床应用研究与进展[J].中国美容医学,2017,26(9):132-135.
[14]邵小钧,庞恋苏,袁仕廷,等.异种脱细胞真皮基质在口腔颌面部创面修复中的应用[J].解放军医学院学报,2015,36(9):900-903,907.
[15]时长江,王鹏飞,辛大森,等.自体BMSCs复合改建脱细胞真皮基质体内构建组织工程软骨的实验研究[J].中国矫形外科杂志,2014,22(12):1111-1118.
[16]陈武,王韦玮,时新站,等.脱细胞真皮基质作为屏障膜的细胞相容性及细胞封闭性的体外研究[J].上海口腔医学,2013,22(3):260-264.
[17]张爱君,李强,崔莹莹,等.不同年龄阶段人脱细胞真皮的制备及细胞渗透性研究[J].中华医学美学美容杂志,2014,20(2):130-133.
[18]姜涛,金培生,陶常波,等.改良法制备人脱细胞真皮的特性与体外细胞相容性[J].中华医学美学美容杂志,2016,22(6):369-372.
[收稿日期]2019-02-20
本文引用格式:邓霞,钟惠兰.改良法处理人脱细胞真皮的脱细胞效果及其与体外细胞的相容性研究[J].中国美容医学,2019,28(10):102-105.

