长途运输应激对孕中期小鼠胚胎发育的影响
孙丽萍,张靖楠,李小娟,张 蓓,杨利国
(1.郑州轻工业学院食品与生物工程学院 河南郑州 450002;2.华中农业大学动物科技学院,湖北武汉 430070)
运输会引起动物生理生化功能的改变,尤其是长途运输。在卵泡期,运输引起下丘脑-垂体-肾上腺轴的激活显著推迟了促黄体生成素(LH)峰值[1-3]。运输应激对羔羊均只获卵数、均只获可用卵数及均只获可用卵率均无显著影响[4],但进行6 h 的道路运输后海兰褐鸡卵巢雌二醇受体mRNA 和孕酮受体mRNA 的相对表达量显著降低[5]。产前运输应激并没有影响垂体对GnRH的反应及睾丸对GnRH 诱导的LH 分泌[6]。对妊娠3 d的小鼠进行连续束缚应激,发现胚泡着床位点数和子宫蜕膜中的胚泡数目显著减少[7]。
排卵、性行为表现、胚胎着床、分娩和断奶是繁殖过程最敏感的时期,这些过程均受内分泌系统的控制。小鼠胚胎发育至14 d(E14)时内胚细胞开始分化形成3 个胚层,此时胚胎对环境条件十分敏感[8]。基于此,本试验选择对环境较敏感的妊娠中期(怀孕8~10 d)小鼠来研究运输应激对胚胎发育的影响,旨在探讨运输应激对妊娠的影响程度和影响方式,通过Agilent 小鼠表达谱芯片筛选运输前后垂体和子宫中的差异表达基因,以期找到抗运输应激的主效基因及其调节机制,为抗运输应激新产品的开发提供理论依据。
1 材料与方法
1.1 试验动物和样品的采集 8 周龄健康清洁级昆明雌鼠100 只,9~10 周龄健康昆明雄鼠50 只。试验动物、动物饲料和垫料购于武汉大学实验动物中心。室温控制在22℃左右,光控时间为07:00—19:00,自由采食、饮水和活动,预试1 周后进入正式试验。于每天17:00 开始按2:1 的比例进行雌雄鼠合笼配种,第2 天07:00—08:00 查栓,见栓当天记为妊娠第0 天,连续配种3 d。随机取孕8~10 d 小鼠14 只进行 1 000 km 的普通公路长途运输(时间约15 h),运输过程中不间断饮水、采食和活动。
运输结束后随机取孕8~10 d 试验鼠和正常对照鼠各3 只,颈椎脱臼致死,快速取垂体和胎盘,生理盐水冲洗后投入液氮速冻,-80℃冰箱保存备用。其余孕鼠分别于运输结束后2~3 d 颈椎脱臼致死,并记录活胎数、死胎数和吸收胎数,计算活胎率、死胎率和吸收胎率:
活胎率=活胎仔数/胎仔总数×100%
吸收胎率=(早期吸收数+晚期吸收率)/胎仔总数×100%
死胎率=死胎数/胎仔总数×100%
1.2 总RNA 的提取 采用Trizol 一步法提取总RNA(Cat#15596-018,Life technologies,Carlsbad,CA,US)。抽提所得总RNA 经Agilent Bioanalyzer 2100(Agilent technologies,Santa Clara,CA,US)电泳质检合格后使用RNeasy mini kit(Cat#74106,QIAGEN,GmBH,Germany)和 RNase-Free DNase Set(Cat#79254,QIAGEN,GmBH,Germany),纯化total RNA。
1.3 芯片杂交和扫描 质检合格的RNA 样品采用干冰送上海伯豪生物技术有限公司进行mRNA 放大和标记,用RNeasy mini kit(Cat#74106,QIAGEN,GmBH,Germany)纯化标记后的cRNA,之后按照Agilent 表达谱芯片配套提供的杂交标准流程和配套试剂盒进行Agilent 小鼠全基因4×44K 芯片杂交。
完成杂交的芯片采用Agilent Microarray Scanner(Cat#G2565CA,Agilent technologies,Santa Clara,CA,US)进行扫描,软件设置Dye channel:Green,Scan resolution=5 μm,PMT 100%,10%,16bit。用Feature Extraction software 10.7(Agilent technologies,Santa Clara,CA,US)读取数据,最后采用Gene Spring Software 11.0(Agilent technologies,Santa Clara,CA,US)进行归一化处理,所用的算法为Quantile。
1.4 QPCR 验证基因芯片 为了证明基因芯片检测的准确程度,本试验选取了5 个差异基因,设计特异性荧光定量PCR 引物(表1),以β-action为内参,采用SYBR Green I 荧光染料,在Bio-Rad IQ5 Real-time PCR 仪上进行实时定量PCR。
1.5 统计分析 采用IQR 对数据进行归一化处理,然后采用moderate t-test 筛选差异倍数大于2 倍的基因。采用Westfall Young 来剔除假阳性。筛选到的差异表达基因上传入Ingenuity Pathway Analysis(IPA)V7.5 软件,进行分子功能和基因网络分析。
2 结果
2.1 运输应激对孕鼠胚胎发育的影响 由表2 可知,与对照组相比,孕中期长途运输导致活胎率显著下降和死胎率显著增加。

表1 用于定量PCR 验证的引物
2.2 阵列和通路分析 在孕中期垂体中筛选到了138 个差异表达的基因,其中71 个基因表达显著上调,67 个基因表达显著下调。在孕中期子宫中筛选到了392 个差异表达的基因,其中73 个基因表达显著上调,319 个基因表达显著下调。表3 和表4 列出了与正常对照相比孕中期小鼠垂体和子宫组织中运输应激差异最为显著的10 个基因的信息。
差异基因的IPA 分析发现,典型通路和生物功能涉及免疫和炎性疾病、细胞的生长、增殖和细胞间的相互作用、机能失调等(表5 和表6)。其中垂体中磷脂酰胆碱生物合成和DHA 信号通路及子宫中自然杀伤细胞通路都对胚胎发育和免疫系统发挥着非常重要的作用。
IPA 分析出垂体中的主要调控网络:①RNA 转录后修饰、神经系统发育和功能、细胞间信号和相互作用(score 35,24 个主要分子);②体液免疫反应、蛋白质合成、细胞周期(score 33,23 个主要分子);③心血管疾病、神经系统疾病、心肌肥大(score 30,22 个主要分子);④体液免疫反应、蛋白质合成、细胞形态(score 29,21 个主要分子);⑤分子运输、细胞发育、细胞生长和增殖(score 27,20 个主要分子)。IPA 分析出子宫中的主要调控网络:①细胞死亡和存活、感染性疾病、炎性反应(score 43,26 个主要分子);②细胞功能与维持、血液系统发育和功能、细胞间信号和相互作用(score 31,20 个主要分子);③细胞间信号和相互作用、组织发育(score 31,20 个主要分子);④发育畸形、遗传性疾病、代谢性疾病(score 31,20 个主要分子);⑤脂代谢、分子运输、小分子生物合成(score 30,20 个主要分子)。

表2 运输应激对孕中期鼠胎儿发育的影响

表3 应激组和对照组相比垂体组织中前10 个差异表达基因
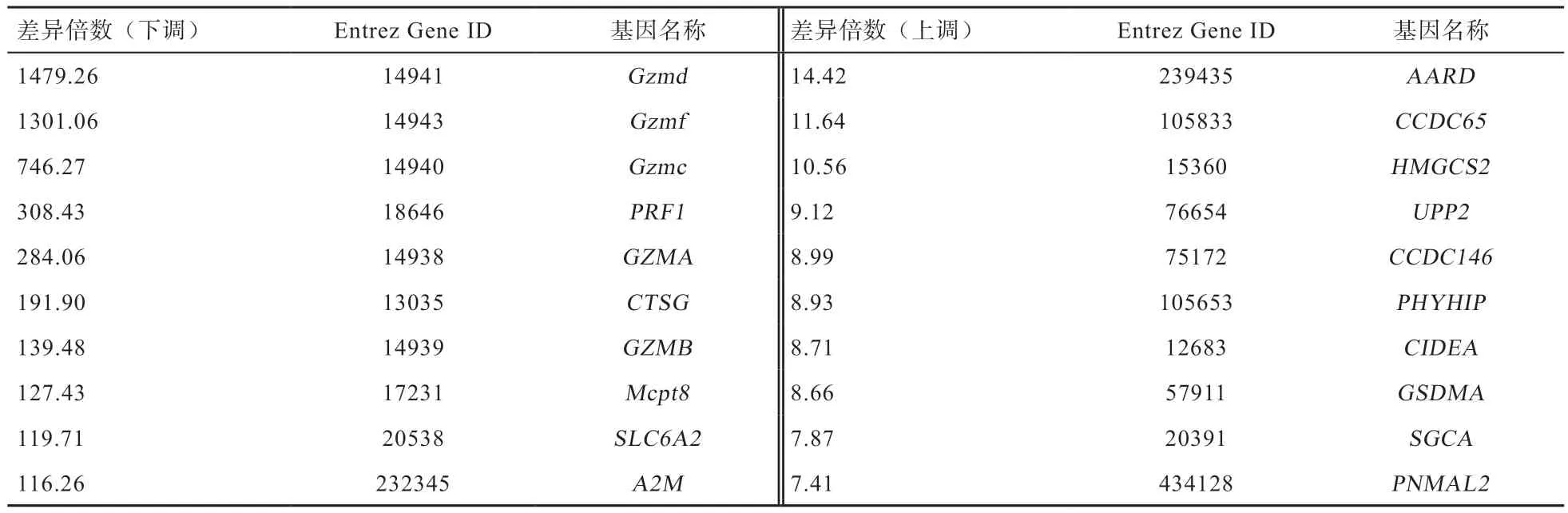
表4 应激组和对照组相比子宫组织中前10 个差异表达基因

表5 垂体组织中差异基因的典型信号通路(P<0.0001)
从表7 和表8 的调控网络中可以看出,经历长途运输后孕鼠无论是垂体还是子宫组织都有重复的基因参与不同调控网络,而且部分基因不仅参与运输应激垂体中的调控网络还参与子宫中的调控网络。如Fcer1、Igg3、IgG2a、PLC gamma、SYK/ZAP 既参与垂体中体液免疫反应、蛋白质合成、细胞周期,又在子宫中参与细胞功能与维持、血液系统发育和功能、细胞间信号和相互作用。IFN alpha/beta 和NFkB(complex)既参与垂体中体液免疫反应、蛋白质合成、细胞周期调控网络又参与子宫中细胞间信号和相互作用、组织发育调控网 络。ARID3A、BCR(complex)、Ige、IgG1 既 参与垂体中体液免疫反应、蛋白质合成、细胞形态又参与子宫中细胞功能与维持、血液系统发育和功能、细胞间信号和相互作用。Alpha catenin、Collagen type I、creatine kinase、Laminin、Notch 既参与垂体中分子运输、细胞发育、细胞生长和增殖,又参与子宫中细胞间信号和相互作用、组织发育。Jnk 和Ldh 既参与垂体中体液免疫反应、蛋白质合成、细胞形态,又在运输应激小鼠子宫中参与脂代谢、分子运输、小分子生物合成调控网络。

表6 垂体和子宫组织中差异基因的主要生物功能(P<0.0001)
本研究还发现,运输应激子宫组织中OLR1 和WNT10A 既参与细胞间信号的相互作用、组织发育又参与发育畸形、遗传性疾病、代谢性疾病调控网络,而AMBP基因既参与发育畸形、遗传性疾病、代谢性疾病调控网络,又参与脂代谢、分子运输、小分子生物合成调控网络。
2.3 基因芯片结果的定量验证 为了验证芯片结果的可靠性,试验选择了部分差异显著性的基因进行了验证。荧光定量PCR 得到的差异倍数与芯片结果得出的差异倍数不尽相同(表9)。可能与定量PCR 方法和基因芯片方法精确度不同、2 种方法的动态范围存在差异以及芯片不能特异区分一个基因家族的单个基因有关,然而2 种方法得到的基因表达模式一致。这表明荧光定量PCR 技术和基因芯片所得扩增产物的一致性,验证了基因芯片技术筛选出的抗应激基因的准确性。
3 讨 论
免疫调节因子类 Fcer1 是IgE 受体,表达于抗原递呈细胞,控制重要的促炎免疫调节子的产量。Igg3、IgG2a、Ige、IgG1、Igf、IGFBP6、Igfbp、Iga、Igm、Immunoglobulin 和IgG2b 这些免疫球蛋白以及IFN alpha/beta、NFkB(complex)细胞因子在多种免疫防御机制中起着重要作用。脾酪酸激酶Syk 是B 细胞激活信号转导过程中最重要的激酶,BCR 激活后,依赖Syk 的信号转导途径调整B 细胞克隆的表达、分化或凋亡,妊娠中期Syk 缺失的小鼠会死亡[9]。Syk/JNK 信号通路在炎症激活、调节宿主免疫反应中也起着非常重要的作用[10]。而妊娠本就是炎性反应过程,本研究检测到的这些免疫调节子在维持妊娠的正常进行中起着非常关键的作用。
持续性热应激造成了乳酸脱氢酶(LDL)和碱性磷酸酶(ALP)活性显著提高,而免疫球蛋白浓度显著下降[11]。本试验通过1 000 km 的长途运输,在孕鼠垂体和子宫组织中也检测到了相似的表达现象。
转录因子arid3a 是DNA 结合蛋白,调节基因表达,能够增加B 淋巴细胞中免疫球蛋白基因的表达但却抑制胎儿成纤维细胞中其他基因的表达[12-14]。研究表明,arid3a 对干扰素α的表达非常重要[15-16],而干扰素α 会引起病原体的炎性反应。本研究通过表达谱芯片的方式筛选出运输应激后arid3a 的表达上调了2.95,说明在应激条件下机体为了适应环境,调动了各种免疫调控机制(包括免疫球蛋白)以保证胚胎正常发育。
颗粒酶是丝氨酸蛋白酶类,通常与穿孔素联合发挥作用以维持细胞的正常发育和细胞周期的稳定,及时清除体内受损细胞,以维持组织器官及内环境的稳态。细胞凋亡的途径之一即是穿孔素/颗粒酶凋亡信号通路。在细胞免疫反应中当病原感染目标细胞时释放颗粒酶。颗粒酶A 除了具有细胞毒性功能外,还能够激活细胞外炎症因子的产生,从而允许细胞毒性细胞接近组织内的靶细胞。早期反复流产患者子宫蜕膜组织中颗粒酶B的表达量显著高于正常对照个体[17]。颗粒酶D 表达于小鼠肥大细胞,其表达量取决于肥大细胞的成熟程度[18]。颗粒酶F 特异性的表达于自然杀伤细胞中,很可能在固有性免疫中起作用,其底物是Drp1[19]。本研究发现,运输应激小鼠子宫中颗粒酶A、颗粒酶B、颗粒酶C、颗粒酶D 和颗粒酶F 的表达与正常对照小鼠相比急剧下降,尤其是颗粒酶D 和F,其表达量分别下降了1 479.26 倍和1 301.06 倍。提示颗粒酶可能在胚胎发育中发挥着某种重要的作用,其机制尚需进一步研究和探讨。

表7 垂体组织中前5 个信号网络所包含的基因

表8 子宫组织中前5 个信号网络所包含的基因

表9 定量PCR 结果与芯片结果的比较
综上所述,经过长途运输后孕中期小鼠垂体和子宫组织中检测到一系列差异表达的基因,包括免疫球蛋白类和颗粒酶类等,它们都在机体的免疫防御中发挥着重要作用,其在子宫组织中的具体作用机制有待进一步研究。

