DcR3表达在肝癌细胞凋亡和增殖中的作用研究*
彭 亮,赵静静,娄晓丽,侯彦强
(南京医科大学上海松江临床医学院,上海 201600)
肝癌是世界上最常见的内脏肿瘤之一,在全世界所有肿瘤病死率中居于第3位,其发生的分子机制主要包括癌基因和抑癌基因的突变、生长因子的失控表达、HBV/HCV 病毒蛋白对肿瘤信号通路的激活和调控等[1]。诱骗受体3(DcR3)是肿瘤坏死因子受体(TNFR)超家族的新成员,能够竞争性结合死亡配体 FasL、LIGHT 和 TL1A,阻断相关信号转导通路,调节细胞增殖,抑制细胞凋亡[2]。有研究发现,肝癌组织中 DcR3 的表达远远大于其癌旁组织和健康组织,提示 DcR3 可能作为癌基因在肝癌的发生、发展中起重要作用[3]。本研究通过体外试验探讨 DcR3 对肝癌凋亡和增殖的影响,为肝癌细胞分子治疗靶点的筛选和预后判断提供理论基础。
1 材料与方法
1.1仪器与试剂 人肝癌细胞株 HepG2、MHCC-LM3 和 MHCCC-97H 均购自北京中科质检生物技术有限公司;DMEM培养液、胎牛血清、胰蛋白酶均购自美国Hyclone公司;目的质粒(LV-DcR3)和空载质粒(LV-MCS-3FLAG-SV40-EGFP-IRES)均购自上海吉凯基因化学技术有限公司;鼠抗DcR3单克隆抗体(美国Abcam公司),鼠抗 GADPH 单克隆抗体(武汉艾美捷科技有限公司,中国)辣根过氧化物酶 HRP 标记亲和纯化山羊抗小鼠 IgG 二抗(美国sigma公司);逆转录试剂盒,荧光定量 PCR(qPCR) 试剂盒均购自日本 Takara公司,PCR 引物序列 (上海生工生物工程有限公司,中国 ),DcR3引物序列:上游引物 为5′- CCA CTA CAC GCA GTT CTG GA-3′,下游引物为5′-GTG CTC CAA GCA GAA ACC AG-3′,β-actin引物序列:上游引物为 5′-CCT GGC ACC CAG CAC AAT-3′,下游引物为 5′-GGG CCG GAC TCG TCA TAC-3′。 β-actin 作为内源对照,结果以相对定量2-ΔΔCt表示。
1.2方法
1.2.1细胞培养 人肝癌细胞株 HepG2、MHCC-LM3 和 MHCCC-97H 均用含有10% 胎牛血清及青链霉素双抗(均为100 U/mL)的 DMEM 培养,常规培养于 37 ℃、5% CO2培养箱中培养,取对数期细胞,按照每孔3×105个细胞接种于6孔板中,等到细胞密度大于80%时分别进行感染目的质粒(LV-DcR3)和空载质粒(LV-MCS-3FLAG-SV40-EGFP-IRES),感染前弃去培养基,更换新鲜培养基,根据上海吉凯基因化学技术有限公司病毒滴度测定结果按 MIO 50 TU/mL 加入病毒上清,37 ℃、5% CO2培养箱中培养12 h后更换培养基,72 h 后观察感染效率。通过荧光显微镜下观察绿色荧光蛋白 (GFP) 判断转染效率。继续进行下一步处理,分别收集 LV-NC组和LV-DcR3组细胞进行qPCR、蛋白质免疫印迹(Western blot)、细胞生长曲线的检测。
1.2.2绘制细胞生长曲线 取对数期细胞,于6孔板接种2.5×104个细胞/孔,常规培养,时间点设置为0、2、4、6 d,弃上清,1×磷酸缓冲盐溶液(PBS)清洗2次,10%福尔马林室温固定20 min,水洗1次,0.1% 结晶紫(溶解在10%乙醇中)室温染色至少30 min,流水清洗细胞外染液,完全晾干,10%乙酸溶解,分光光度计吸光度(A)590读取A值。以横坐标为时间(h),纵坐标为A,绘制细胞增殖曲线。实验重复3次。
1.2.3Western blot检测DcR3蛋白 采用细胞裂解液(RIPA)裂解细胞,BCA蛋白定量试剂盒定量后,加入 5×上样缓冲液(loading buffer)混匀,于 100 ℃变性10 min 进行 10% 十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿转 100 min,转移至 PVDF 膜上,5% 的脱脂奶粉封闭液封闭 2 h,一抗按比例加入,4 ℃孵育过夜,磷酸盐缓冲液(PBST) 漂洗3次,每次10 min。加入二抗,室温孵育1 h,PBST漂洗3次,每次5 min,结果用化学发光试剂盒检测,曝光、显影、定影、观察结果,在相同的印迹上针对ACTB信号标准化成像条带的光密度,用凝胶成像仪对免疫印迹条带灰度值并进行分析。
1.2.4mRNA 表达水平检测 (1)细胞总 RNA 的提取:采用 Trizol法提取总 RNA,采用逆转录试剂盒将总 RNA 的1 μg mRNA 反转录成 cDNA,反转录的条件为42 ℃ 60 min,70 ℃ 5 min。(2)qPCR:PCR反应体系为20 μL,每个孔设置3个复空,反应条件为预变性95 ℃ 2 min,95 ℃ 15 s,60 ℃ 34 s,40个循环。以β-actin作为内参,以2-ΔΔCt表示mRNA的相对定量,ΔCt=Ct靶基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组。
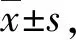
2 结 果
2.1不同肝癌细胞株DcR3蛋白及mRNA的表达 采用Western blot检测3株肝癌细胞HepG2、MHCC-LM3和MHCC-97H的DcR3蛋白表达水平,发现MHCC-LM3[(0.258±0.058)]、MHCC-97H[(0.660±0.055)]较HepG2[(0.028±0.009)]细胞中的DcR3蛋白表达水平明显升高,差异具有统计学意义(P<0.05)。在转录水平,发现HepG2 mRNA表达水平[(1.21±0.09)]较MHCC-97H[(8.56±0.46)]和MHCC-LM3[(5.27±0.23)]均明显降低,差异有统计学意义(P<0.05)。因此,本研究选取了肝癌细胞株HepG2,见图1。
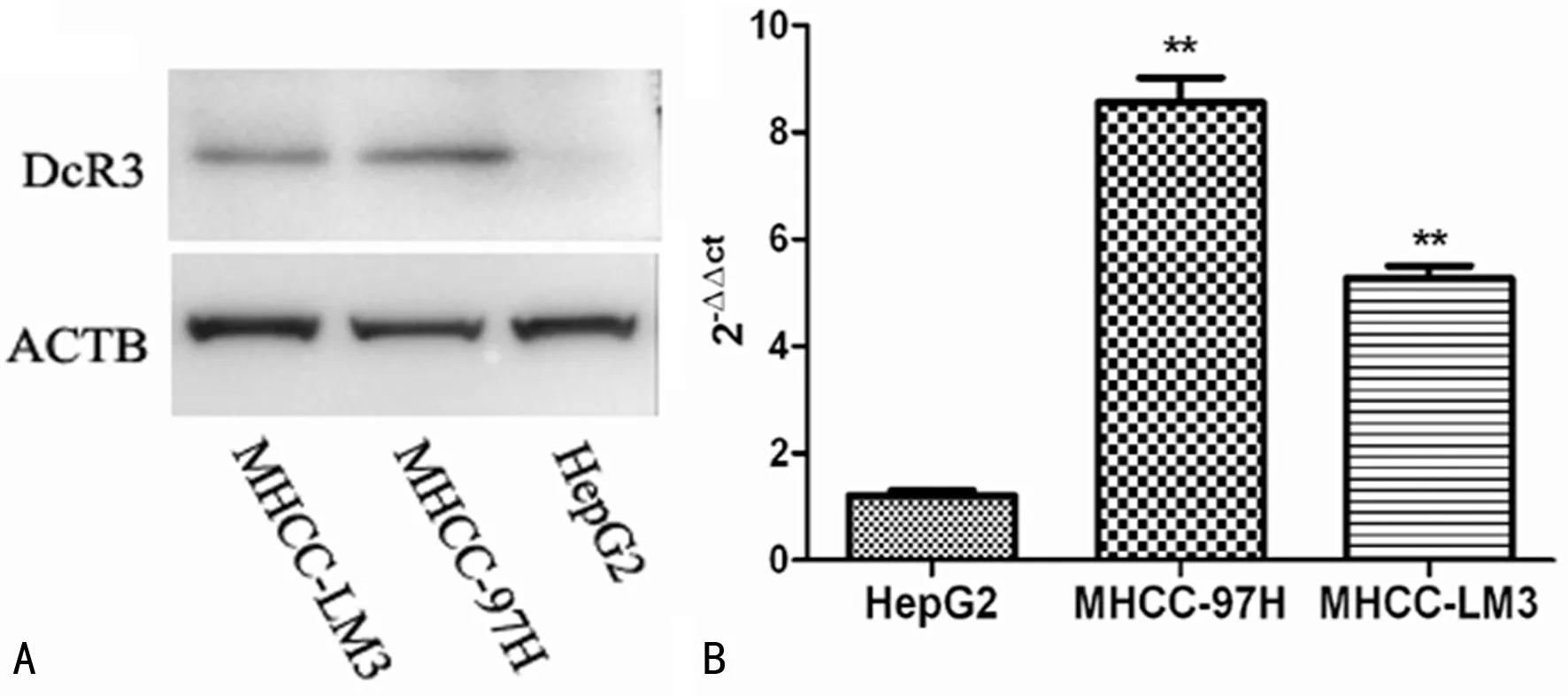
注:A表示不同肝癌细胞株DcR3蛋白表达水平比较;B表示HepG2、MHCC-LM3和MHCC-97H mRNA表达水平比较;**P<0.05,与HepG2 mRNA表达水平比较
图13株肝癌细胞HepG2、MHCC-LM3和MHCC-97H的DcR3蛋白和mRNA表达水平
2.2LV-DcR3组、LV-NC组肝癌细胞HepG2内DcR3 mRNA及蛋白的表达 DcR3过表达慢病毒LV-DcR3感染HepG2后,LV-DcR3组蛋白表达水平[(2.44±0.43)]高于LV-NC组[(0.31±0.23)]。同时,在转录水平,LV-DcR3组mRNA表达水平[(35.276±8.627)]均明显高于LV-NC组[(0.973±0.014)],差异具有统计学意义(P<0.05),提示过表达质粒转染效果良好,见图2。

注:A表示DcR3过表达慢病毒LV-DcR3感染HepG2后DcR3蛋白表达水平比较;B表示两组mRNA表达水平比较;*P<0.05,与LV-NC组比较
图2DcR3过表达慢病毒LV-DcR3感染HepG2后DcR3蛋白和mRNA表达水平
2.3DcR3表达对肝癌细胞HepG2凋亡的影响 细胞凋亡指标半胱天冬酶-3(caspase3)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)的mRNA水平的结果显示,LV-DcR3组凋亡基因caspase3和Bax转录水平较LV-NC组均明显下降,抗凋亡基因Bcl-2转录水平升高,差异有统计学意义(P<0.05),见表1。
2.4DcR3表达对肝癌细胞HepG2增殖的影响 绘制生长曲线:当培养第2天时,LV-DcR3组增殖速度[(9.95±3.06)]与LV-NC组[(5.06±3.11)]比较,差异无统计学意义(P=0.124);当培养到第4天时,LV-DcR3组增殖速度[(39.45±3.61)]与LV-NC组[(25.98±5.34)]比较,差异具有统计学意义(P=0.022);当培养到第6天时,LV-DcR3组增殖速度[(65.84±6.16)]与LV-NC组[(33.34±4.55)]比较,差异有统计学意义(P=0.002),见图3。
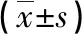
表1 上调DcR3表达后凋亡指标转录水平
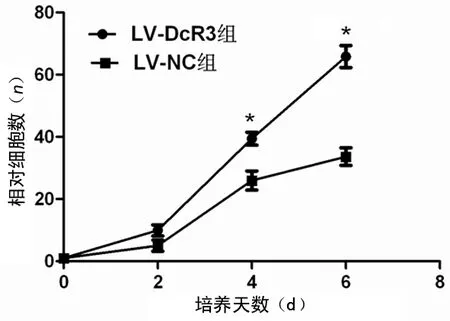
注:*P<0.05,与LV-NC组比较
图3HepG2细胞株增殖曲线
3 讨 论
肝癌是高度恶性的肿瘤,目前手术切除是首选的治疗方式,但因为肝癌的早期诊断率很低,大部分患者就诊时已处于疾病晚期,70%的肝癌患者往往在初次就诊时,就已经错过了最佳治疗时机[4]。因此,只有通过对于癌症的发生及其发展机制的不断深入研究,才能取得更有效的预防和治疗方法。大量研究证实,DcR3在肿瘤的发生、发展中起重要作用,DcR3基因作为TNFR超家族成员之一,与TNFR具有高度同源性,能够通过与Fas等介导细胞凋亡的蛋白分子配体相结合,阻断后者介导的细胞凋亡过程[5];另外,DcR3基因能够通过多种途径阻断T细胞、自然杀伤细胞诱导的肿瘤细胞凋亡,从而促进恶性肿瘤的免疫逃逸[6],在肺癌、胰腺癌、肝癌、胃癌等多种恶性肿瘤的发生与发展中扮演重要角色[7-9]。
为了探讨过表达DcR3对HepG2细胞DcR3蛋白表达、增殖和凋亡的影响,研究者构建了DcR3慢病毒载体,转染DcR3表达水平较低的HepG2细胞后,验证转染效率,上调DcR3的表达后可促进肝癌细胞株HepG2增殖和抗凋亡能力。
细胞凋亡是一种受基因调控的细胞程序性死亡方式,而异常的细胞凋亡往往会引起机体异常:凋亡不足会引发癌症[10]。Bcl-2基因是一种癌基因,它具有抑制凋亡的作用,大多数多细胞生物的自我调节性死亡均经过一个保守的程序性过程,几乎均由Bcl-2调控及实施的[11]。本研究通过上调HepG2肝癌细胞株的DcR3后,发现抗凋亡基因Bcl-2转录水平升高,而研究发现caspase-3在细胞凋亡中起着不可替代的作用,活化的caspase-3可引起细胞凋亡,但这个过程可以被Bcl-2阻断[12]。本研究发现caspase-3转录水平明显下降,可能的机制为Bcl-2系统能够稳定线粒体膜,防止caspase3/细胞色素C等分子渗出而导致的细胞凋亡[13],说明DcR3在肝癌的凋亡过程中起着重要作用,原因可能是Bcl-2参与了此过程,但具体机制仍需进一步探讨。
细胞生长曲线结果显示DcR3具有促进肝癌细胞的增殖作用。陶振洲等[14]通过下调DcR3表达发现可以明显降低肝癌细胞系HepG2细胞的增殖能力,与本研究结果一致,进一步证实了DcR3能够促进肝癌细胞的增殖。研究发现DcR3能够中和TLlA诱导的抗血管生成,而新生血管是肿瘤侵袭和转移的关键步骤[15]。GE等[16]研究发现DcR3通过P13K/AKT/GSK-3β/β-catenin信号通路促进胃癌细胞增殖、侵袭、转移和上皮间质转化,提示DcR3与肿瘤增殖、侵袭与转移的相关性。
4 结 论
本研究通过体外试验探讨了DcR3对肝癌细胞凋亡和增殖的影响,发现DcR3具有促进肝癌细胞的增殖和抗凋亡作用,其机制可能是通过上调抗凋亡基因Bcl-2发挥作用的。其如何进行调控的仍需进一步研究,为肝癌细胞分子治疗靶点的筛选和预后判断提供理论基础,具有重要的理论和临床价值。

