具核磁共振成像功能的可再生介孔硅作为抗肿瘤药物新型载体的性能研究
喻兆阳,薛慧颖,钟梦菊
癌症是人类健康的主要威胁,癌症的药物治疗发展迅速[1]。然而大部分抗肿瘤药物毒性高,具有较为严重的不良反应。因此,使用纳米载体作为递药系统使药物靶向至肿瘤组织继而释放,从而减少药物对正常组织的损伤成为癌症药物研发的重要手段[2]。
对比增强核磁共振成像(magnetic resonance ima-ging,MRI)是一种分辨率高、成像深度广的无创影像检查手段,广泛应用于各类临床疾病诊断中[3-4]。而常用的MRI对比剂主要是T1加权成像钆螯合物钆喷酸葡胺(Gd-DTPA)。此类对比剂大多存在半衰期短,不良反应较多且有结构稳定而无法实现靶向分子诊断和治疗的缺点[5]。
而无机纳米材料介孔二氧化硅纳米粒(mesoporous silicana noparticle,MSN)因其具有极大的比表面积、高度均匀可控的介孔孔道、容易进行功能化修饰以实现有效荷载、靶向递送功能被公认为是一种优秀的治疗诊断纳米系统[6-7]。研究表明,水稻壳中约含有10%~21%的无定型水合二氧化硅,煅烧后其灰分中二氧化硅含量高达90%,是一种良好的硅源[8-9]。因此,为符合当今绿色环保和循环经济的要求,本研究组使用稻壳为硅源并掺入钆离子(Gd3+)合成了一种新型再生多功能介孔硅纳米材料(gadolinium-containing renewable MSN,rMSN-Gd)。在前期研究基础上,以抗肿瘤药物盐酸阿霉素(doxorubicin hydrochloride,DOX)为模型药物,设计构建具MRI功能的载DOX介孔硅纳米粒(DOX-rMSN-Gd),以期提高肿瘤胞内药物浓度、增强抗肝癌细胞活性并同时实现肿瘤的影像诊断,为肿瘤的诊断治疗一体化的探索提供研究基础。
1 材料与方法
1.1 细胞株与实验动物 人宫颈癌Hela细胞株、人肺癌A549细胞株、人肝癌HepG2细胞株,均购自中国典型培养物保藏中心。SPF级BALB/c裸鼠[SCXK(京)2014-0004]6只,雌性,4~6周龄,购自北京华阜康生物科技股份有限公司。
1.2 试剂及仪器 水稻壳(实验室自备);氢氧化钠、溴化十六烷基三甲铵(CTAB,98%)、二氯甲烷(国药集团化学试剂有限公司);三氯化钆六水合物(美国Alfa Aesar公司),其他试剂均为分析提纯。高温反应炉(美国Lindberg Blue公司/300 ℃);JEM-2100型透射电镜(日本JEOL公司);动态散射光粒度仪(美国Brookhaven Instruments公司);比表面孔径分布测定仪(美国Boynton Beach公司);S300磁共振成像系统(德国Bruker公司);电感耦合等离子体发射光谱仪(德国Spectro公司);全波长酶标仪(美国Termo Scientific公司);紫外-可见光分光光度计(日本Hitachi公司)。
1.3 再生多功能介孔硅的制备
1.3.1 稻壳的处理 按照文献[8]方法改良后进行,取适量稻壳,2 mol/L的盐酸加热回流4 h,弃去盐酸,用蒸馏水洗涤至中性,干燥煅烧,即得白色二氧化硅粉末。取3.8 g二氧化硅粉以及1 g的氢氧化钠加入38 mL的水里,加热回流至粉末全部溶解,过滤得透明澄清液,即为硅酸钠溶液,常温保存备用。
1.3.2 rMSN与rMSN-Gd的制备 将1 g CTAB溶解于93 mL的超纯水中,加入0.1 mL 1 mol/L氢氧化钠溶液室温混和搅拌1 h,逐滴滴加3 mL所制备的硅酸钠溶液后,分别迅速加入3 mL超纯水与3 mL含41.6 mg GdCl3·H2O的水溶液,于80 ℃搅拌反应2 h。反应完成后,离心收集沉淀,用蒸馏水洗涤3次,干燥、煅烧后除去模板剂CTAB,即得rMSN与rMSN-Gd。
1.3.3 DOX-rMSN-Gd的制备 载药过程采用吸附法进行。精密量取1 mL 1 mg/mL的rMSN-Gd纳米粒水溶液,在剧烈搅拌中加入5 mg/mL的DOX水溶液1 mL超声2 min,继续搅拌吸附24 h至平衡。去除上清并洗涤多余游离DOX,即得DOX-rMSN与DOX-rMSN-Gd纳米粒,最后加1 mL超纯水重悬备用(图1)。

图1 载盐酸阿霉素含钆可再生介孔硅纳米粒(DOX-rMSN-Gd)合成示意图
1.4 形态与表征
1.4.1 透射电子显微镜与扫描电子显微镜成像 取10 μL rMSN轻滴到铜网吸附30 min。去除多余的液体,烘干,置于透射电子显微镜进行观察;同时将样本悬浮液滴在样本台上,干燥去除水分使rMSN粉末附在样本座上,导电处理后,置于扫描电子显微镜下观察,记录rMSN-Gd的形貌特征、大小及表面特性。
1.4.2 水合粒径和Zeta电位测定 开启Zeta Plus动态散射光粒度仪预热15 min后,取100 μL rMSN-Gd样本用去离子水稀释至3 mL,置于粒度仪中测量其水合粒径和Zeta电位。
1.4.3 元素含量分析 分别称取1 mg rMSN及rMSN-Gd,加入足量氢氟酸,待纳米粒子溶解完全后,用去离子水稀释至10 mL,最后用电感耦合等离子体发射光谱仪检测纳米粒中钆元素的含量。
1.5 观察指标
1.5.1 溶血试验检测生物相容性 收集适量新鲜的血液样本,4℃ 1 500 r/min离心10 min,洗净,以磷酸缓冲液(phosphate bufler saline,PBS)重悬得浓度为5×108/mL的红细胞。将4 mL rMSN-Gd与商用造影剂二乙三胺五乙酸钆(Gd-DTPA)分别与同体积红细胞37 ℃孵育1 h。并使用1%的Triton X-100和PBS分别作为阳性和阴性对照。离心分离后,使用酶标仪于541 nm下检测,并计算溶血率。溶血率=(样本OD值-阴性组OD值)/(阳性组OD值-阴性组OD值)。
1.5.2 体外MRI成像 取适量rMSN-Gd纳米粒子,配置成浓度为15.625、62.5、125和250 μg/mL溶液于EP管中,置于MRI仪中进行成像。扫描参数:TR/TE=300 ms/10.6 ms,视野FOV=7 cm,NEX=1,层厚为2.00 mm,矩阵为256×256条件下。
1.5.3 荷瘤裸鼠体内MRI成像 本研究按照相关实验动物伦理学规范进行。在6只BALB/c裸鼠腋背部接种人宫颈癌Hela细胞,至皮下移植瘤直径增长至1.0~1.2 cm时,将小鼠随机分为2组,每组3只。实验组静脉注射10 mg/mL的rMSN-Gd悬浮液0.2 mL,对照组注射同样体积PBS溶液。然后分别于注射30 min后,置于MRI仪下成像。
1.5.4 载药量的测定 采用紫外分光光度法。取上述制备好的DOX-rMSN-Gd 100 μL于5 mL EP管中,加入100 μL 4% HF混合均匀,40 ℃反应过夜,将HMSN中的DOX完全释放,在加入于紫外480 nm波长处测定吸光度从而得到100 μL中的DOX载药量。载药量=测得DOX含量/(测得DOX含量+HMSN总量)。
1.5.5 体外释放度研究 体外DOX释放实验采用透析法,按2015年版《中国药典》释放度测定法步骤进行,分别以30 mL 10 mmol/L PBS(pH7.4与pH 5.0)为溶出介质,以100 r/min转速持续搅拌,温度为(37.0±0.5)℃,并在在1、3、5、8、12、24、30、48和72 h抽取介质用UV分光光度计检测PBS中DOX的浓度。
1.5.6 细胞荧光摄取实验 将HepG2细胞接种于12孔板中,培养24 h,分别加入DOX-rMSN-Gd溶液和游离DOX水溶液1μL(DOX浓度为1 μg/mL)继续培养1 h或6 h,除去培养基,洗涤。用4%多聚甲醛溶液固定细胞,以DAPI染核并用PBS清洗,于荧光倒置显微镜下观察HepG2细胞的摄取情况。
1.5.7 体外抗肿瘤活性检测 将密度为5×103/孔的A549细胞和HepG2细胞种在96孔板中,待细胞贴壁后,分别加入含不同药物浓度的游离DOX与DOX-rMSN-Gd培养基1 μL,每组包含3个复孔。孵育48 h,弃去培养液,每孔加入100 μL 0.5 mg/mL MTT溶液,继续孵育4 h。随后弃去上清液,向每孔中加入100 μL的DMSO溶液并振荡10 min,用酶标仪测定490 nm波长处的吸光度。

2 结果
2.1 再生多功能纳米粒的制备与初步表征 动态光散射测量结果表明,合成的rMSN纳米粒粒径均一,平均水合粒径253 nm。加入钆元素之后或装载药物DOX后,纳米粒水合粒径未发生显著变化,Gd3+的加入对纳米载体的粒径大小分布无显著影响。掺杂Gd3+后,纳米粒的Zeta电位显著上升,这是因为rMSNs本身带负荷而Gd3+带正电荷,故Gd3+加入后中和了rMSNs本身的电荷属性致使其电位升高,初步证实钆元素掺杂至纳米粒中。使用ICP-AES测量构建的3种纳米粒中钆元素含量,结果表明rMSN未见测出钆元素(低于检测限),而rMSN-Gd与DOX-rHMSN-Gd中均可检测到含有质量分数为4.7%左右钆元素,这进一步确证Gd3+成功掺杂至纳米粒中。以分光光度法测定DOX-rHMSN-Gd纳米粒的载药量,结果发现rMSN-Gd的载药量可达(15.29±0.33)%。
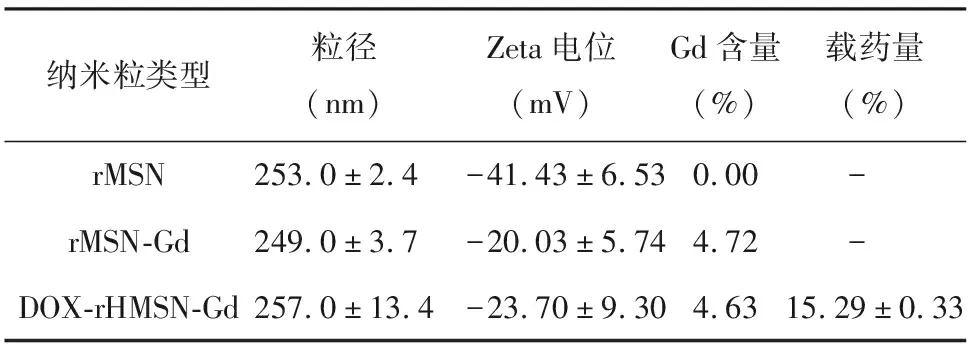
表1 rMSN、rMSN-Gd与DOX-rHMSN-Gd的表征结果
2.2 透射电子显微镜以及扫描电子显微镜的结构观察 透射电镜结果表明(图2A),rMSN呈规则球形,分散性良好,粒径分布均一,约为150 nm;扫描电镜结果表明(图2B),rMSN表面具规则排列的介孔结构。

图2 rMSN的透射电镜(A)与扫描电镜(B)显微结构
2.3 细胞生物相容性分析 通过溶血实验来测定所构建纳米载体的生物相容性。结果显示1 mg/mL与10 mg/mL rMSN-Gd与商用造影剂Gd-DTPA对细胞溶血率无明显差异,证实纳米材料rMSN-Gd有良好的生物相容性(图3)。
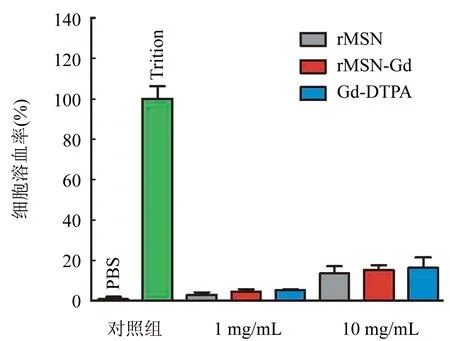
图3 溶血实验检测rMSN-Gd的生物相容性
2.4 体外与体内移植瘤MRI成像 体外MRI结果表明(图4A),T1影像的显影强度随着材料的浓度升高而升高,其拥有良好MRI的正造影特性。
纳米材料rMSN-Gd静脉注射至荷瘤BALB/c裸鼠体内后,可观察到较对照组相比荷瘤处(红圈的位置)MRI成像明显的变亮;证实rMSN-Gd在体内也可进行MRI显影(图4B)。
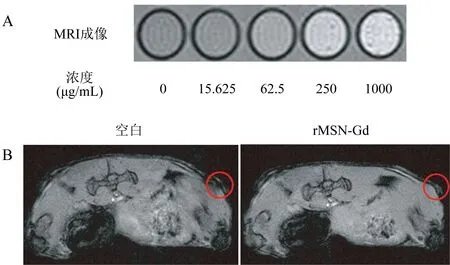
图4 rMSN-Gd体外(A)与荷瘤小鼠体内(B)的MRI成像特征
2.5 体外释放度实验 体外模拟了在生理环境(pH 7.4)和肿瘤的微环境(pH 5.0)中DOX-rMSN-Gd纳米粒DOX的释放特征,图5。
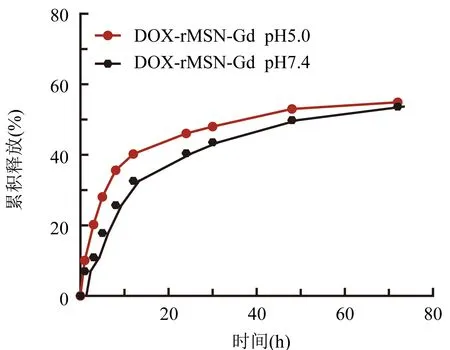
图5 DOX-rMSN-Gd纳米粒的体外释放曲线图(n=3)
在pH 7.4人工模拟生理环境下,DOX-rMSN-Gd纳米粒中DOX的释放相对较慢,而在pH 5.0模拟肿瘤的微环境的酸性介质中,DOX从纳米粒中释放速率变快,提示合成的再生多功能纳米粒DOX-rMSN-Gd可控制药物释放。在酸性肿瘤环境中,其可实现药物的较快释放,使得药物实现在肿瘤细胞内的迅速释药,发挥药效。
2.6 细胞荧光摄取实验 在HepG2细胞中观察其对药物的摄取情况,使用荧光显微镜在200倍放大的条件下对其进行观察,其中红色荧光为DOX,蓝色荧光为DAPI,结果表明纳米粒rMSN-Gd能很好的被细胞摄取,在1 h时DOX就可够达到较好的摄取量,8 h能够大量摄取且纳米粒药物能在细胞胞内较好扩散,图6。

注:图中标尺为100 μm,n=3图6 rMSN-Gd携载DOX进入HepG2细胞荧光显微图
2.7 纳米药物的体外抗肿瘤活性结果分析 如图7所示,处理48 h后,在A549与HepG2中不同浓度DOX-rMSN-Gd的细胞毒性均高于游离DOX(P<0.05)。游离DOX、DOX-rMSN-Gd抑制A549与HepG2细胞的IC50值分别为0.802 μg/mL与0.242 μg/mL(P<0.05);0.352、0.08 μg/mL(P<0.05),即纳米粒对A549细胞的毒性高于HepG2细胞,提示再生功能性纳米粒DOX-rMSN-Gd具有更强的抗肿瘤活性且对肝癌细胞具有更好疗效。

图7 DOX-rMSN-Gd纳米粒体外抗肿瘤活性结果
3 结论
目前,纳米材料在医学领域中应用十分广泛[10-14]。其中,无机纳米材料介孔硅具有结构稳定、表面积非常大、生物兼容性良好、毒性极低等的优点,在肿瘤诊断治疗领域受到广泛关注。
研究表明,癌细胞的不断增殖致使其血管内皮细胞的排列不紧密,产生10~1 000 nm的间隙(正常血管间隙为5~10 nm),导致血管的通透性增加[15-16]。粒径为20~200 nm纳米粒子可以通过肿瘤的高通透性和滞留效应(enhanced permeability and retention,EPR)渗透穿越血管累积在癌组织,同时癌组织缺乏正常的淋巴网络。因此,当纳米粒子经由血液循环累积在癌组织之后,便很难经由正常的淋巴网络离开,而延长其累积在癌组织的时间,因而纳米颗粒可通过EPR效应靶向肿瘤组织。
本研究制备的稻壳再生介孔硅纳米材料DOX-rMSN-Gd分散性良好,平均粒径约为150 nm,其表面具有序密集分布的介孔且生物相容性良好。研究证实了该材料可同时作为MRI显影剂与药物纳米载体,实现诊断治疗一体化。该材料作为显影剂,较一般显影剂其具有EPR介导的靶向性,可靶向聚集于肿瘤部位,从而减少其用量降低了其对正常组织的影响;作为纳米药物载体,其有一定的酸敏感性与肿瘤的微酸环境相适应,使得药物实现在肿瘤细胞内的集中释药,较游离药物具有更好活性,有效提高了药物治疗效率。
综上所述,稻壳再生多功能纳米材料DOX-rMSN-Gd作为具标靶性的智能型显影剂与智能纳米药物传递系统以实现诊断治疗一体化上有良好的应用前景。

