Mas 受体激动剂激活RAS 非经典通路对db/db 糖尿病小鼠胰岛α细胞功能的影响
张 珍,云 鹏,柳 丹,刘春燕,黄辛炜,汤嘉豪,胡 丹,李芳萍
0 引 言
糖尿病的患病率逐年升高,给国民健康及社会经济造成巨大危害。Unger 等[1]提出的“双激素异常假说”越来越受到研究者的关注,该假说以为糖尿病是由于胰岛素内源性生成不足或胰岛素抵抗与胰高血糖素不适当分泌共同作用的结果。胰高血糖素不适当分泌在糖尿病及其并发症的发生发展中起重要作用。如能发现调控胰高血糖素分泌的关键靶点,将为防治糖尿病提供新的方法与手段。
经典的肾素血管紧张素系统(renin angiotensin system,RAS)是氧化应激与炎症反应的重要来源。ACE2-Ang(1-7)-Mas非经典通路是近年发现的RAS的新通路,与经典Ang-AngⅡ-AT1R 通路相互制约,维持RAS 的自稳调节和相对平衡。血管紧张素1-7(angiotensin1-7,Ang1-7)是该通路的主要效应分子,主要由血管紧张素转化酶2(angiotensin converting enzyme2,ACE2)水解AngⅡ产生,通过作用于Mas受体,发挥抗炎、抗氧化应激、抗纤维化、舒张血管等拮抗ACE/AngII/AT1R 通路的功能[2-3]。我们前期研究发现经典RAS 通路ACE/AngII/AT1R 对胰岛α 细胞胰高血糖素分泌具有重要调控作用[4],但RAS新通路ACE2-Ang(1-7)-Mas对胰高血糖素分泌有何影响仍然未知。AVE 0991为2002年合成的非肽类Mas受体激动剂,化学名为5-甲酸基-4-甲氧基-2-苯基-1[[4-[2-乙胺羰基磺胺]-5-异丁烯-3-噻吩]-苯基]-甲基]-咪唑,分子式为C29H31N4NaO5S2,与Ang(1-7)作用位点相同,可模拟Ang(1-7)的诸多生物学效应[5]。本研究拟采用db/db糖尿病小鼠,探讨Mas受体激动剂AVE0991对胰岛α细胞胰高血糖素分泌功能的影响及可能机制。
1 材料与方法
1.1 实验动物8 周龄雄性2 型糖尿病db/db 小鼠,体重35~40 g,30 只及同周龄同窝出生的2 型糖尿病db/m 小鼠(diabetes misty mouse),体重20~25 g,15 只,由南京大学实验动物中心提供,实验动物合格证号:SYXK 苏2016-0012。饲养条件:SPF级动物实验室,温度保持在23 ℃,相对湿度60%~70%,12~12 h亮暗周期,自由饮食饮水。动物的处置均遵循实验动物看护原则(NIH Publication no.85-23,修订于1985年)。
1.2 主要仪器及试剂血糖仪(One Touch Ultra 美国Johnson);CO2培养箱(BPN-170RWP,上海一恒);荧光显微镜成像系统(CX41,日本Olympus);微量注射 泵(日 本Terumo);离 心 机(美 国Thermo);9700PCR 仪(美国ABI);Trizol 逆转录试剂盒(日本Morinaga);胰岛素、胰高血糖素ELISA 试剂盒(日本Morinaga);BCA 蛋白浓度检测试剂盒(日本Morinaga);豚鼠抗人胰岛素抗体、兔抗人胰高血糖素抗体、荧光标记二抗、兔抗豚鼠GCK 一抗、羊抗兔GCK 二抗(美国Santa Cruz);Ⅳ型胶原酶(美国Sigma);AVE0991(美国MCE)。
1.3 方法
1.3.1 动物分组及干预30 只db/db 小鼠随机数字表法分为AVE 组和模型组,每组15 只。AVE 组每日固定时间给予AVE0991(20 mg/kg,等渗盐水溶解为2 mg/mL)灌胃,模型组给予等容量的等渗盐水灌胃,连续给药6周。15只同周龄同窝出生的db/m 小鼠作为正常组,给予等渗盐水灌胃。试验期间未使用胰岛素及其他降糖药。
1.3.2 生理生化指标检测每周监测体重和随机血糖,灌胃前和灌胃6周后鼠尾取血测定空腹血糖、空腹胰岛素及胰高血糖素,血糖测定使用One Touch血糖仪,血浆胰岛素、胰高血糖素测定使用ELISA法。
1.3.3 腹腔葡萄糖耐量试验灌胃6 周后,禁食15 h,每组取5 只行腹腔葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT):给予500 mg/kg 葡萄糖腹腔注射,于0、30、60、120 min 采集鼠尾静脉血测定胰高血糖素及血糖。
1.3.4 体外胰岛灌流IPGTT 后各组小鼠行苯巴比妥麻醉后夹闭胆总管十二指肠乳头开口,体视显微镜下行胆总管穿刺后注射1 mg/mL 浓度的IV 型胶原酶2 mL,逆行进入胰管使胰腺膨大后,迅速分离胰腺。将胰腺置于含Ⅳ型胶原酶1 mg/mL 的Hanks平衡液中消化40 min,去除胶原成份后多次振荡洗涤,显微镜下成功分离胰岛。镜下手检胰岛,每孔50 个胰岛,置于装有Hanks 平衡液24 孔板中于CO2温箱孵育2 h。将体外胰岛灌流系统置于37℃水浴槽[6],并将微量泵输注系统与其连接。先使用含2.8 mmol/L 葡萄糖(低糖)的KRB 溶液充填至整个管道系统,在层析柱中加入100µL 预先配置好的葡聚糖凝胶,盖紧硅胶塞密闭胰岛舱。连接微量泵,先给予2.8 mmol/L 葡萄糖的KRB,以0.5 mL/h 速度灌流,30 min 后给予含16.7 mmol/L 葡萄糖(高糖)的KRB,以1 mL/h 速度灌流,每20 s 收集灌出液保存,5 min后改为每分钟收集1 次灌出液,留待ELISA 法测定胰高血糖素水平。根据胰高血糖素浓度绘制胰高血糖素动态分泌曲线。
1.3.5 免疫组化测定投药6周后,每组选取5只小鼠,给予苯巴比妥钠麻醉,经心脏灌注等渗盐水和4%多聚甲醛固定,剥离胰腺后置于4%多聚甲醛液中4~6 h,石蜡包埋,5µm厚度切片后于0.01 mmol/L的PBS中清洗3次。加入一抗(豚鼠抗人胰岛素抗体1∶100 和兔抗人胰高血糖素抗体1∶400)后4 ℃孵育过夜(14 h),加入二抗(Cy3 荧光标记山羊抗豚鼠IgG 抗体1∶100 和FITC 荧光标记羊抗兔IgG 1∶100)室温避光孵育1 h,PBS 冲洗后加入荧光抗萃灭封片剂后封片。显微共聚焦荧光显微镜观察胰岛素和胰高血糖素染色情况。所有切片经观察拍照获得数字照片后,使用Image-Pro Plus 6.0软件分析。每只小鼠随机选取15张胰岛照片,每组分析至少45张胰岛照片。计算胰岛α(或β)细胞含量的公式如下:

1.3.6 GCK mRNA 表达检测每组选取5 只小鼠,采用qRT-PCR 法检测胰岛GCKmRNA 的表达。引物设计根据GeneBank提供的基因序列:GCK上游5′-GTGGTGCTTTTGAGACCCGTT-3′,下 游5′-TTCGATGAAGGTGATTTCG-3′;β-actin 上 游5′-TCATCACTATCGGCAATG-3′,下游5′-ACAGCACTGTGTTGGCAT-3′,由Invitrogen公司合成。提取胰岛并匀浆化,Trizol 法提取总RNA。cDNA 合成条件为:37 ℃15 min,85 ℃5 s。按照PCR试剂盒配置反应体系后进行PCR 反应,反应条件:95 ℃60 s,预变性;95 ℃15 s、60 ℃15 s、72 ℃45 s,共40个循环。
1.3.7 GCK 蛋白表达检测采用Western blot 方法检测。将分离的胰岛匀浆化,PBS 清洗2 次,使用细胞溶解液消化1 h,1000 r/min 离心10 min(离心半径3 cm),收集上清液,采用BCA 试剂盒测定蛋白浓度。将蛋白质样品稀释至相同且合适的浓度后行SDS-PAGE 电泳,然后转移至PVDF 膜上在5%脱脂奶粉封闭液中室温封闭1 h,加入兔抗豚鼠GCK 抗体(1∶800),室温培育1 h 后加入羊抗兔IgG 二抗(1∶2000),室温培育2 h。最后加入ECL显色液置于UVP 图像成像仪中观察并分析结果。条件设置为曝光124 minCCD 自动获取图像。以β-actin 作为内参对照。以目的条带的灰度对β-actin 灰度的比值代表组织中目的蛋白的表达水平。
1.4 统计学分析使用SPSS 22.0 软件进行统计分析,定量资料以均数±标准差()表示,以P≤0.05为差异有统计学意义。
2 结 果
2.1 生理生化指标AVE0991干预前,AVE组和模型组小鼠体重、空腹血糖、空腹胰岛素及胰高血糖素水平均高于正常组(P<0.05)。干预6 周后,AVE组小鼠空腹血糖、空腹胰岛素水平均明显低于模型组(P<0.05),但高于正常组(P<0.05)。正常组干预前后体重、空腹血糖、空腹胰岛素及胰高血糖素水平均无明显改变(P>0.05)。见表1。
表1 各组干预前后生理生化指标()Table 1 Physiological and biochemical indicators before and after intervention()

表1 各组干预前后生理生化指标()Table 1 Physiological and biochemical indicators before and after intervention()
与正常组干预前比较,*P<0.05;与模型组干预后比较,#P<0.05
组别n 体重(g) (m血mo糖l/L) (胰m岛U/素L)胰(高p m血ol糖/L)素正常组干预前1523.7±0.76.1±0.65.2±0.521.4±2.6干预后1526.5±0.56.3±0.5#5.7±0.3#19.4±1.5模型组干预前1537.2±0.3*17.5±2.4*15.1±1.0*28.5±3.2*干预后1542.2±1.225.3±3.017.3±1.829.1±1.7 AVE组干预前1537.5±0.2*18.2±2.7*15.3±1.2*28.1±2.8*干预后1541.3±0.819.1±0.8#14.1±0.527.7±2.0#
2.2 糖耐量及胰高血糖素分泌功能在糖负荷后30、60 和120 min,AVE 组血糖值和胰高血糖素水平均低于模型组,但仍高于正常组(P<0.05)。见表2。
2.3 体外胰岛胰高血糖素分泌功能低糖灌流时,正常组小鼠胰岛的胰高血糖素分泌水平[(20.6±0.5 pmol/L)]低于模型组[(29.1±0.7)pmol/L)]及AVE 组[(27.6±0.8)pmol/L],差异有统计学意义(P<0.05),然而,AVE 组与模型组差异无统计学意义(P>0.05)。正常组小鼠胰岛在高糖灌流后15 min 左右胰高血糖素分泌水平即出现显著降低,之后缓慢下降,说明高糖对正常组小鼠胰高血糖素分泌有抑制作用。而模型组小鼠胰岛在高糖灌流后胰高血糖素分泌水平出现明显升高,60 min 时达42 pmol/L,说明高糖会刺激模型组小鼠胰高血糖素的分泌。高糖灌流后AVE 组胰高血糖素水平也有所升高,30min 时升至峰值36 pmol/L。与模型组比较,AVE组高糖灌流30、60 min 高血糖素水平差异均有统计学意义(P<0.05)。见图1。
表2 IPGTT血糖及胰高血糖素水平()Table 2 Blood glucose and glucagon results of IPGTT()
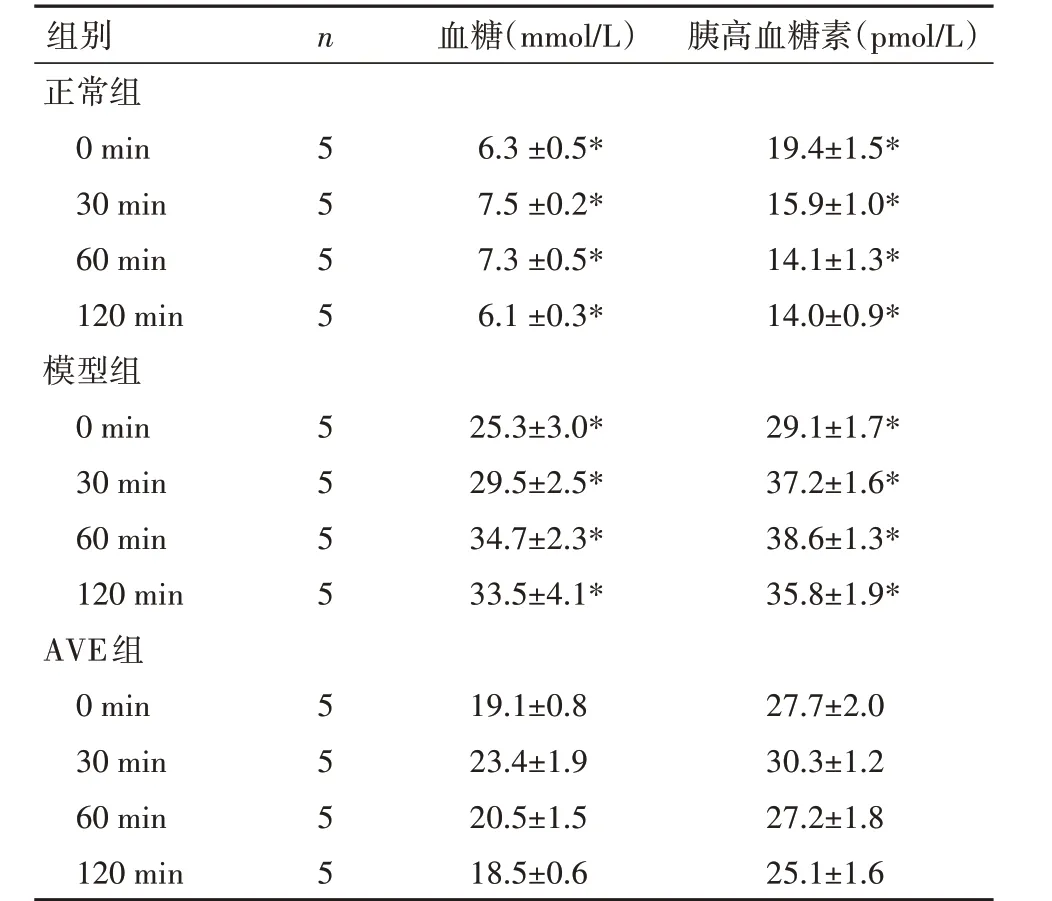
表2 IPGTT血糖及胰高血糖素水平()Table 2 Blood glucose and glucagon results of IPGTT()
与AVE组同一时间同一指标比较,*P<0.05
组别n 血糖(mmol/L) 胰高血糖素(pmol/L)正常组0 min56.3±0.5*19.4±1.5*30 min57.5±0.2*15.9±1.0*60 min57.3±0.5*14.1±1.3*120 min5 6.1±0.3*14.0±0.9*模型组0 min525.3±3.0*29.1±1.7*30 min529.5±2.5*37.2±1.6*60 min534.7±2.3*38.6±1.3*120 min5 33.5±4.1*35.8±1.9*AVE组0 min519.1±0.827.7±2.0 30 min523.4±1.930.3±1.2 60 min520.5±1.527.2±1.8 120 min518.5±0.625.1±1.6
2.4 胰岛α及β细胞含量正常组小鼠胰岛β细胞(红色)占比大,位于胰岛中央,α细胞(绿色)零星分布于胰岛周边;模型组小鼠β 细胞含量较正常组显著降低(P<0.05),α 细胞含量显著增加(P<0.05),且由胰岛周边向中间迁移;与模型组小鼠相比,AVE组小鼠β 细胞含量增加,α 细胞含量减少,差异均有统计学意义(P<0.05)。见图2。半定量分析表明模型组胰岛α 细胞含量较正常组明显升高,β 细胞含量较正常组明显降低(P<0.05);与模型组相比,AVE组胰岛α 细胞含量明显降低,β 细胞含量明显升高(P<0.05)。见表3。
2.5 胰岛GCK的表达模型组胰岛GCK mRNA及蛋白的表达均明显低于正常组(P<0.05);与模型组比较,AVE 组GCK mRNA 及蛋白表达升高(P<0.05)。见图3。

图1 各组胰岛体外灌流胰高血糖素分泌Figure 1 Glucagon secretion from islet perfusion

图2 镜下观察各组小鼠胰岛细胞(免疫组化染色)Figure 2 Immunohistochemical staining of islets of each group(IHC)
表3 各组胰岛α 与β 细胞含量(,mg)Table 3 Contentsofislet αandβcellsineachgroup(mg)

表3 各组胰岛α 与β 细胞含量(,mg)Table 3 Contentsofislet αandβcellsineachgroup(mg)
与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别nα细胞含量 β细胞含量正常组51.2±0.34.8±0.3模型组53.3±0.7*2.4±0.6*AVE组51.8±0.4#4.2±0.5#

图3 各组胰岛GCK的表达水平Figure 3 Expression levels of GCK in islets of each group
3 讨 论
ACE2-Ang(1-7)-Mas 通路是RAS 的重要分支,对血糖调节具有重要作用。以往关于ACE2-Ang(1-7)-Mas 通路对血糖调节的研究大多集中于对胰岛素的分泌及其作用方面[7-8],本研究首次发现Mas 受体激动剂AVE0991 可通过抑制db/db 糖尿病小鼠糖负荷后胰高血糖素的分泌而降低血糖,揭示了RAS非经典通路ACE2/Ang(1-7)/Mas 对胰岛α 细胞功能的调控作用。
胰高血糖素是胰岛α 细胞分泌的由29 个氨基酸组成的肽类激素。作为胰岛素的主要拮抗激素,胰高血糖素主要通过促进糖异生及糖原分解来升高血糖,防止低血糖发生。在生理状态下,进餐后血糖浓度升高可抑制胰高血糖素的分泌。然而,无论1 型还是2 型糖尿病患者均存在胰高血糖素分泌抑制受损,餐后血糖浓度升高并不能抑制胰高血糖素的分泌,甚至会进一步促进其分泌,造成肝糖输出增加和血糖水平的进一步恶化[9]。本研究通过体外胰岛灌流系统评估糖负荷后胰高血糖素的动态分泌功能。结果显示在低糖灌流时db/db 糖尿病小鼠胰高血糖素水平明显高于db/m 小鼠,高糖灌流后15 min 左右db/m 小鼠胰高血糖素分泌即出现明显下降,而db/db 糖尿病小鼠胰高血糖素分泌水平较低糖灌流时明显升高,激活ACE2/Ang(1-7)/Mas 通路可使高糖灌流后db/db 糖尿病小鼠胰高血糖素升高的幅度及持续时间减少。
在生理状态下,胰岛α 细胞约占胰岛细胞总数的20%,而β 细胞约占75%。胰岛α 与β 细胞比例适当是维持血糖稳态平衡的重要基础[10]。糖脂毒性引起的胰岛局部氧化应激加剧可造成胰岛β细胞凋亡增加或β 细胞去分化,去分化后的胰岛β 细胞可转化为分泌胰高血糖素的α 细胞。因此,糖尿病时胰岛α 与β 细胞比值增加。Cinti 等[11]发现2 型糖尿病患者胰岛内分泌细胞的数量与对照组没有显著差异,但β 细胞减少了32%,α 细胞增加了68%。本研究通过免疫荧光染色发现db/db 糖尿病小鼠胰岛细胞总数量较db/m 小鼠无显著差异,但胰岛α 细胞数量约为db/m 小鼠的3 倍,β 细胞数量不足db/m小鼠的1/2,而激活ACE2/Ang(1-7)/Mas 通路可部分逆转db/db 糖尿病小鼠胰岛细胞比例的失衡。那么激活ACE2/Ang(1-7)/Mas 通路逆转db/db 糖尿病小鼠胰岛细胞比例失衡的机制是什么?胰岛的发育受一系列转录因子调控,如胰腺十二指肠同源盒-1可促进胰岛β 细胞的增殖与分化,而配对盒基因6可促进胰岛α 细胞的增殖与分化[12-13]。激活ACE2/Ang(1-7)/Mas 通路对糖尿病小鼠胰岛α 与β 细胞数目的影响是否是通过影响上述转录因子的表达而产生尚有待进一步研究证实。
调节胰高血糖素分泌的因素众多,包括葡萄糖、氨基酸等营养物质,胰岛素、生长抑素、γ-氨基丁酸等旁分泌激素,以及神经系统的调节等[14]。其中,葡萄糖浓度升高是抑制胰高血糖素分泌的最直接因素。当血糖浓度升高时,葡萄糖经葡萄糖转运蛋白1 转运到α 细胞内,经GCK 催化并在线粒体内分解代谢产生ATP,使ATP/ADP 升高,导致ATP 敏感性钾通道关闭及细胞膜去极化,使T 型钙通道和电压依赖的钠通道失活,N 型及L 型钙通道关闭,钙内流减少,胰高血糖素分泌受到抑制[15]。糖尿病时胰岛α 细胞葡萄糖的敏感性下降可能与GCK 表达降低有关。研究发现α 细胞GCK 基因敲除小鼠可出现餐后胰高血糖素水平升高及糖耐量异常[16]。并且,GCK 激动剂可抑制α 细胞胰高血糖素分泌[17]。本研究发现激活ACE2/Ang(1-7)/Mas通路可增加胰岛GCK 的表达,这可能也是激活ACE2/Ang(1-7)/Mas通路抑制胰高血糖分泌的原因之一。
综上所述,本研究首次发现激活RAS 非经典通路ACE2/Ang(1-7)/Mas 可通过降低db/db 糖尿病小鼠糖负荷后胰高血糖素分泌改善糖代谢紊乱,其机制可能与纠正胰岛α 细胞与β 细胞比例失衡及增强胰岛GCK的表达有关。