枯草芽孢杆菌Prob1822复合抗热保护剂的研究
肖怀秋 ,李玉珍,林亲录,赵谋明,刘 军,周 全,姜明姣
(1.湖南化工职业技术学院 制药与生物工程学院,湖南 株洲 412000;2.中南林业科技大学 食品科学与工程学院,湖南 长沙 410004;3.华南理工大学 食品科学与工程学院,广东 广州 510640;4.湖南中威制药有限公司,湖南 株洲 412000)
枯草芽孢杆菌(Bacillus subtilis)具有调节肠道菌群失衡、增强免疫和安全性高等优点,是一种理想的益生菌[1],其活菌制剂口服液可用于肠炎和腹泻等疾病及烧伤感染的治疗[2-4]。近年来,益生菌固态制剂因储存运输、质量控制及生产便捷而受到广泛关注。然而,关于高生物活性和高存活率的固态制剂的保存鲜见报道[5]。喷雾干燥因热干燥时间短、料液温度低和生物活性损失小而广泛应用于益生菌菌体干燥[6-7],但喷雾干燥大规模制备高活性益生菌固体制剂的抗热性保护研究较少[8],研制高活性益生菌固态制剂的关键就是抗热保护剂的选择与使用[9],常用保护剂有低聚糖、糖醇、蛋白质、多肽和多糖等[10]。保护剂的使用能减轻喷雾干燥热损伤和脱水干燥对亚细胞结构与胞内生物大分子及细胞器的破坏[6]。低聚糖等小分子保护剂为多羟基化合物,具有很好的亲水性,可与细胞膜磷脂或蛋白质极性基团形成氢键或水化层,保护细胞膜、细胞器膜及胞内生物大分子结构的完整性,而蛋白质等大分子保护剂则主要通过“包埋”形成天然“隔热屏障”,两种保护剂的保护机制不同,可联合使用[11]。研究表明,单一保护剂相比未添加保护剂能增强益生菌菌体热耐受性,复合保护剂抗热保护效果更好[12]。范娜等[8]研究发现,保护剂之间存在协同作用,复合使用抗热保护效果更好;JACQUELINE A等[13]研究发现,蔗糖或海藻糖能提高保加利亚乳杆菌(L.bulgaricus)菌体存活率,复合型保护剂能将菌体存活率提高780倍[14];ZDENEK H等[9,15]等研究表明,蛋白质比糖类抗热保护效果要好,两者联用抗热保护效果更佳;ANANTA E等[16]也认为复合保护剂能提高益生菌存活率。
本试验以枯草芽孢杆菌(Bacillus subtilis)Prob1822为研究对象,研究了热诱激温度与时间对枯草芽孢杆菌喷雾干燥菌体存活影响,确定了热诱激处理条件;研究单一抗热保护剂对菌体存活率的影响,优选单一抗热保护剂;以稳定期菌体存活率为评价指标,采用中心组合设计(central composite design,CCD)响应面法优化技术对海藻糖、蔗糖和脱脂奶粉复配的复合抗热保护剂的配方,旨在可为枯草芽孢杆菌的喷雾干燥提供理论与技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
枯草芽孢杆菌(Bacillus subtilis)Prob1822:湖南化工职业技术学院生物技术实验室保藏。
1.1.2 化学试剂
牛肉膏、胰蛋白胨(均为生化试剂):北京博星生物技术有限公司;琼脂粉(生化试剂):天津市致远化学试剂有限公司;海藻糖(食品级):海北鹏宇生物科技有限公司;甘露醇、麦芽糖(均为食品级):郑州百思特食品添加剂有限公司;山梨醇(食品级):江苏采薇生物科技股份有限公司;乳糖(食品级):郑州裕和食品添加剂有限公司;脱脂奶粉(食品级):伊利集团;乳清粉(食品级):河北鹏宇生物科技有限公司;大豆分离蛋白(食品级):山西中诺生物科技有限公司;蔗糖(食品级):市售;其他试剂均为国产分析纯。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏3.0 g/L、蛋白胨10.0 g/L、NaCl 5.0 g/L、水1 000 mL,pH 7.0,121 ℃灭菌20 min。
牛肉膏蛋白胨琼脂培养基:在上述培养基中添加2%琼脂,121 ℃灭菌20 min。
发酵培养基:冷榨花生粕蛋白胨(自制)12 g/L、酵母膏5 g/L、NaCl 5 g/L,pH 7.4,121 ℃灭菌20 min。
1.2 仪器与设备
DK-98-11A型电热恒温水浴箱:天津市泰斯特仪器有限公司;UV-2500紫外可见分光光度计:日本岛津公司;PHS-3C型pH计:上海雷磁仪器厂;AL204分析天平:瑞士梅特勒-托利多公司;BBS-SSC超净工作台:济南腾览仪器有限公司;DH-360电热恒温培养箱:北京科伟永兴仪器有限公司;LDZX-50FAS立式压力蒸汽灭菌器:上海申安医疗器械厂;KRH-PJ-10L发酵罐:江苏镇江科海生物工程设备有限公司;SP-1500喷雾干燥机:上海顺仪实验设备有限公司。
1.3 方法
1.3.1 喷雾干燥菌体的制备
(1)菌种活化与种子液制备
将冷冻保存(-18 ℃)的枯草芽孢杆菌(Bacillus subtilis)Prob1822转接于斜面牛肉膏蛋白胨琼脂培养基中,37 ℃恒温培养24 h;活化完成后,用接种环从斜面刮取两环菌种接种至牛肉膏蛋白胨培养基中,装瓶量为100 mL/250 mL,37 ℃、120 r/min恒温振荡培养24 h,得菌株Prob1822种子液。
(2)菌体生长曲线绘制
按5%(V/V)接种量将种子液接种于发酵罐中,补充发酵罐装液量至7 L,37 ℃、120 r/min恒温培养48 h,每间隔2 h取出适量发酵液于波长600 nm处测定吸光度值,记为A600nm,以培养时间(h)为横坐标,以吸光度值A600nm为纵坐标绘制菌体生长曲线,确定菌体迟缓期、对数生长期、稳定期及衰亡期。
(3)喷雾干燥菌悬液的制备
收集培养至稳定期(26 h)的发酵液,于4 000 r/min条件下离心15 min,弃上清液,沉淀用无菌水洗涤并重新悬浮,操作重复3次。用无菌水重新悬浮菌体制备喷雾干燥用菌悬液。
(4)喷雾干燥
制备的菌悬液先进行热诱激预处理(55 ℃热预处理10 min),根据抗热保护剂试验设计方案,按预定比例加入保护剂,充分溶解后作为喷雾干燥用菌悬液,并将含有抗热保护剂的益生菌悬液(100 mL)加入到喷雾干燥设备中进行喷雾干燥。喷雾干燥条件为进风温度90 ℃、进料速率500 mL/h、通风量60 m3/h、出口温度50 ℃,干燥时间1.5 s,得到枯草芽孢杆菌(Bacillus subtilis)Prob1822益生菌粉剂。
1.3.2 热诱激处理
为提高菌体热耐受性和保持较高菌体存活率,取对数生长早期(8 h)、中期(16 h)、末期(20 h)和稳定期(26 h)的菌体100 mL于三角瓶中,分别于50 ℃、55 ℃、60 ℃和65 ℃的恒温水浴锅中进行热诱激处理10 min、30 min和60 min,热诱激处理完成后随即进行喷雾干燥。以喷雾干燥后菌体存活率为评价指标,确定最佳热诱激温度与热诱激时间。
1.3.3 活菌总数测定与菌体存活率计算
喷雾干燥前总活菌数测定方法:准确移取1.0 mL喷雾干燥用菌悬液,用无菌水进行梯度稀释(10-4~10-6),吸取0.1 mL菌悬液倾入牛肉膏蛋白胨琼脂平板上,涂布均匀后于37 ℃倒置培养48 h,记录培养皿上长出的菌落数(CFU),计算喷雾干燥的活菌总数(N)。
喷雾干燥后活菌总数测定方法:准确称取1.00 g喷雾干燥后的益生菌菌粉用9 mL无菌水充分混匀溶解,系列梯度稀释(10-7~10-9)后选取3个相邻稀释度的菌液0.1 mL倾入牛肉膏蛋白胨琼脂平板上,涂布均匀后于37 ℃倒置培养48 h,记录培养皿上菌落数(CFU),计算喷雾干燥后活菌总数,其公式如下:
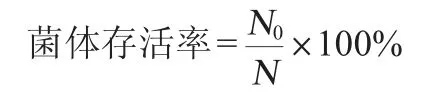
式中:N0为喷雾干燥后活菌总数,CFU/g;N为喷雾干燥前益生菌菌粉中的活菌总数,CFU/g。
1.3.4 抗热保护剂的优选
(1)单一抗热保护剂优化的单因素试验
在查阅文献[6,8,17-18]基础上,选取糖和蛋白质作为抗热保护剂。糖类保护剂包括海藻糖、甘露醇、山梨醇、乳糖、麦芽糖和蔗糖,蛋白质类保护剂包括脱脂奶粉、乳清粉、大豆蛋白和蛋清粉。各保护剂均设置2%、5%和8%三个水平,以菌体存活率为评价指标,对每个抗热保护剂菌体存活最高的组和不加任何抗热保护剂的对照组(CK)进行均数差异多重比较。选择菌体存活率较高的抗热保护剂继续进行响应面优化。
(2)抗热保护剂配方优化响应面试验
利用中心组合设计(CCD)响应面法优化复合抗热剂配方[19],各因素设计5个水平,即±r(上下星号臂),±1(上下水平点)和0(本试验中心点设置6个)。研究海藻糖添加量(X1)、蔗糖添加量(X2)和脱脂奶粉添加量(X3)对菌体存活率(Y)的影响。响应面优化试验因素、水平与编码如表1所示。
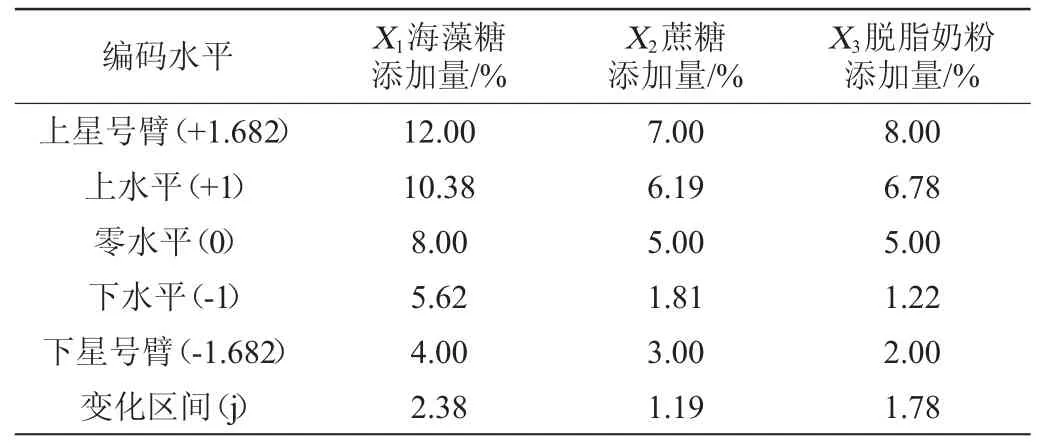
表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiments
1.3.5 数据处理方法
试验结果表示为平均值±标准差(±s)(n=3)。采用SPSS Statistics25进行单因素方差分析,选用最小显著性差异法(least significant difference,LSD)检验进行均值多重比较,显著性水平选用α=0.05;P<0.05为差异显著,P>0.05为差异不显著。均数多重比较仅比较每种单一保护剂中菌体存活率最高的一组与没有添加保护剂的对照组的差异显著性。
2 结果与分析
2.1 菌体生长曲线测定
按5%(V/V)接种量将种子液接种于发酵罐中,37 ℃、120 r/min恒温培养48 h,每隔2 h取样测定菌液在波长600 nm处的吸光度值(A600nm),以培养时间(h)为横坐标、A600nm为纵坐标绘制菌体生长曲线,结果如图1所示。

图1 枯草芽孢杆菌Prob1822生长曲线Fig.1 Growth curve of Bacillus subtilis Prob1822
由图1可以看出,0~4 h内菌体数量增长较为缓慢,为滞后期;6~20 h内菌体增长速度较快,为对数生长期。其中8 h为对数生长早期,16 h为对数生长中期,20 h为对数生长末期。20 h之后菌体增长速率放缓,进入稳定期。菌体培养30 h以后数量呈下降趋势,特别是培养36 h后菌体进入衰亡期。为系统研究热诱激处理对不同生长阶段菌体的菌体存活率影响,选择对数生长早期(8 h)、中期(16 h)、末期(20 h)及稳定期(26 h)进行热诱激处理,以提高菌体的热耐受性和菌体存活率。
2.2 热诱激处理对菌体存活率的影响
试验考察不同热诱激温度(50 ℃、55 ℃、60 ℃、65 ℃)和热诱激时间(10 min、30 min、60 min)对枯草芽孢杆菌对数早(8 h)、中期(16 h)、末期(20 h)和稳定期(26 h)菌体存活率的影响,结果如图2所示。
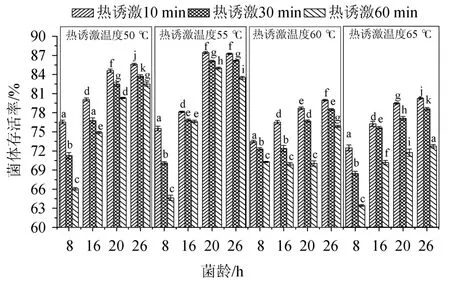
图2 热诱激处理对菌体存活率的影响Fig.2 Effect of thermal-inducible shock treatment on cell survival rate
由图2可以看出,在同一热诱激温度条件下,不同菌龄间的菌体存活率均存在显著差异(P<0.05)。热诱激温度为50 ℃时,稳定期(26 h菌龄)菌体热耐受性最好,特别是稳定期菌体热诱激处理10 min的样本菌体存活率最高(85.59±0.17)%,与热诱激30 min(83.73±0.26)%和60min(82.50±0.31%)的菌体存活率存在显著差异(P<0.05);热诱激温度为55 ℃时,对数生长末期(20 h)和稳定期(26 h)菌龄热诱激10 min和30 min时,菌体存活率差异不显著(P>0.05),但热诱激处理60 min时,存在显著差异(P<0.05);对数生长末期与稳定期菌株热诱激10 min时菌体存活率分别为(87.46±0.15)%和(87.26±0.11)%,差异不显著(P>0.05);当热诱激温度为60 ℃和65 ℃时,热诱激10 min的稳定期菌体存活率均最高,分别为(79.96±0.13)%和(80.27±0.13)%,与对数生长早、中期的不同热诱激时间的样本的菌体存活率均存在显著差异(P<0.05)。
对于相同菌龄的菌体在不同热诱激温度条件下(热诱激时间相同),50 ℃和55 ℃温度条件下菌体存活率相对较高,特别是热诱激温度为55 ℃时菌体热耐受性最好,菌体存活率最高(87.26±0.11%)。55 ℃热诱激30 min和60 min后,菌体存活率分别为降至(86.18±0.06)%和(83.50±0.23)%,差异显著(P<0.05);当热激温度达60 ℃和65 ℃时,菌体热耐受性变差,菌体存活率较低,该研究结果与TEIXEIRA P等[20]结论一致。因此,热诱激温度和热诱激时间的优选对于提高菌体热耐受性和菌体存活率极为重要。热诱激处理能增强菌体热耐热性主要是由于热诱激处理可诱导菌体产生高度保守热应激蛋白,并作为分子伴侣参与蛋白质合成、折叠、装配、运输和降解等生化过程,激发益生菌逆境下的热抵抗力[21-23]。
由图2还可看出,相同热激温度条件下对数生长末期(20 h)和稳定期(26 h)菌体热耐受性相对较好,对数生长早期和中期热耐受性相对较差[24]。可能是因为处于对数生长早、中期的细胞菌体代谢非常活跃,胞内细胞器和生物大分子对热更趋敏感,特别是在热诱激温度较高(如>60 ℃)时,对枯草芽孢杆菌细胞器及胞内生物大分子产生热损伤。考虑到后续的喷雾干燥过程中热损伤和脱水干燥可能对益生菌菌体的亚细胞结构和胞内生物大分子或细胞器的可逆或不可逆损伤[6,23-24]和保持较高的菌体存活率,本试验选择稳定期菌株进行热诱激处理,热诱激参数为55 ℃、10 min。
2.3 抗热保护剂优化的单因素试验
考察了糖类和蛋白质类抗热保护剂对菌体存活率的影响,以未添加抗热保护剂的菌体存活率作对照,结果如图3所示。
由图3可以看出,糖类保护剂与对照相比均存在显著性差异(P<0.05),说明糖类保护剂对菌体均存在较好的抗热保护作用。在不同保护剂添加量的对比试验中,以8%海藻糖、5%蔗糖、8%甘露醇、8%山梨醇和5%麦芽糖试验条件下菌体存活率相对较高,特别是8%海藻糖和5%蔗糖条件下菌体存活率最高,分别为(80.92±0.17)%和(80.29±0.46)%,差异不显著(P>0.05),但显著高于其他糖类保护剂(P<0.05);甘露醇组(8%)、山梨醇组(8%)和麦芽糖组(5%)组间菌体存活率差异不显著(P>0.05),与乳糖组(5%)有显著差异(P<0.05)。因此,选择海藻糖和蔗糖进行后续响应面法优化。糖类保护剂对菌体能实现抗热保护的原因是因为糖类物质主要通过结构中的羟基与细胞膜、细胞器膜或蛋白质极性基团形成众多氢键或在蛋白质表面形成水化层,从而保护细胞(器)膜及蛋白质生物大分子的结构稳定性[14,25]。如海藻糖化学结构中的羟基可以极性基团形成氢键,代替极性基团周围丢失的水分子,形成水化层,维持生物大分子天然结构与细胞(器)膜的完整性[8,18],糖类保护剂还可起到渗透保护[25]。
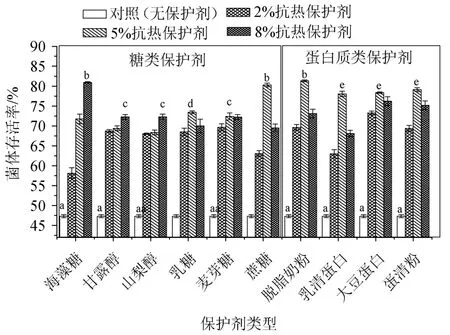
图3 单一抗热保护剂对枯草芽孢杆菌Prob1822菌体存活率的影响Fig.3 Effect of single anti-thermal protectant on cell survival rate of Bacillus subtilis Prob1822
由图3还可知,蛋白质类抗热保护剂与对照组相比也存在显著差异(P<0.05),其中,以脱脂奶粉(5%)菌体存活率最高(81.36±0.23)%,与其他蛋白质类保护剂存在显著性差异(P<0.05);乳清粉组(5%)、大豆蛋白组(5%)和蛋清粉组(5%)组间差异不显著(P>0.05)。因此,选择脱脂奶粉进行后续响应面优化。蛋白质类保护剂对菌体实现抗热保护的原因主要是通过“包埋”在菌体表面形成“隔热屏障”实现抗热保护[11]。脱脂奶粉的多孔结构可使菌体干燥过程中失水更容易[26]。
糖类保护剂与蛋白质类保护剂相比,脱脂奶粉(5%)与海藻糖(8%)和蔗糖(5%)差异不显著(P>0.05),均可以对枯草芽孢杆菌实现较好的抗热保护并保持较高的菌体存活率。糖类和蛋白质类抗热保护剂的抗热保护机制不同,两者联用能起到更好的抗热保护[6,8,22]。鉴于脱脂奶粉、蔗糖和海藻糖组菌体存活率相对较高,且糖类与蛋白质类保护剂的抗热保护机制不同,为充分发挥复合抗热保护剂的保护效果,选择海藻糖、蔗糖和脱脂奶粉联用作为复合抗热保护剂,以进一步提高对菌体的抗热保护效果。
2.4 复合抗热保护剂的响应面优化
基于单因素试验结果,以菌体存活率(Y)为响应值,应用响应面法优化技术对海藻糖添加量(X1)、蔗糖添加量(X2)和脱脂奶粉添加量(X3)进行配方优化。响应面试验设计与试验结果见表2,方差分析结果见表3。
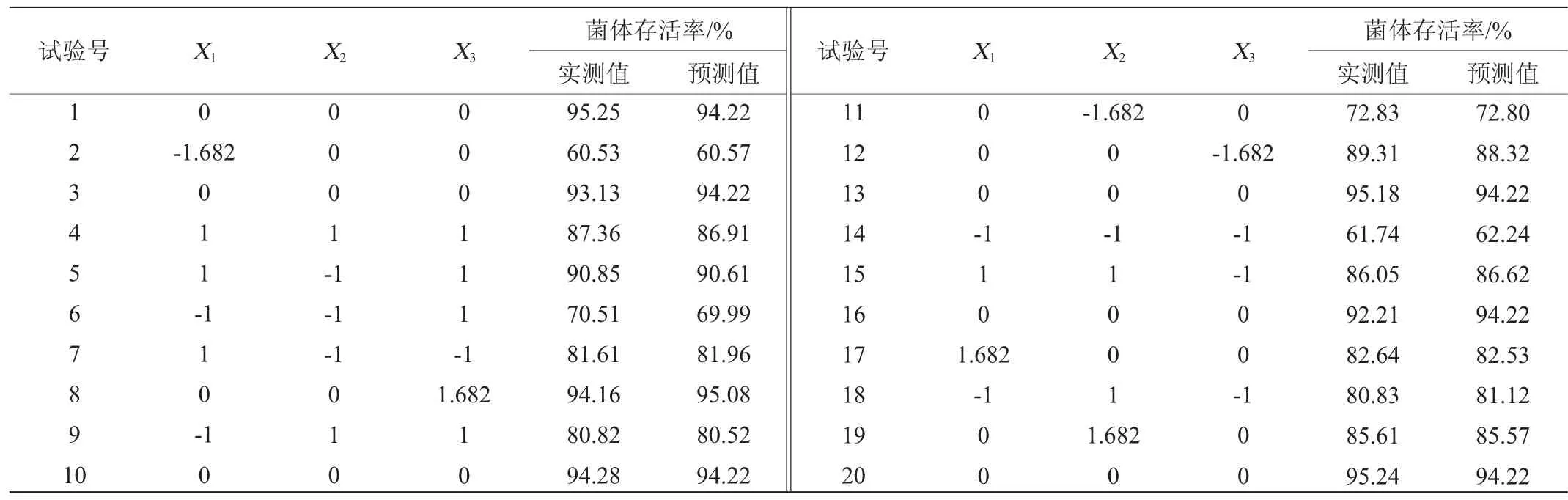
表2 响应面优化试验设计与结果Table 2 Design and results of response surface methodology
对表2数据通过Design-Expert 10.0分析软件进行响应面分析,建立多元二次回归方程:Y=94.22+6.53X1+3.80X2+2.01X3-3.56X1X2+0.22X1X3-2.09X2X3-8.01X12-5.32X22-0.89X32。
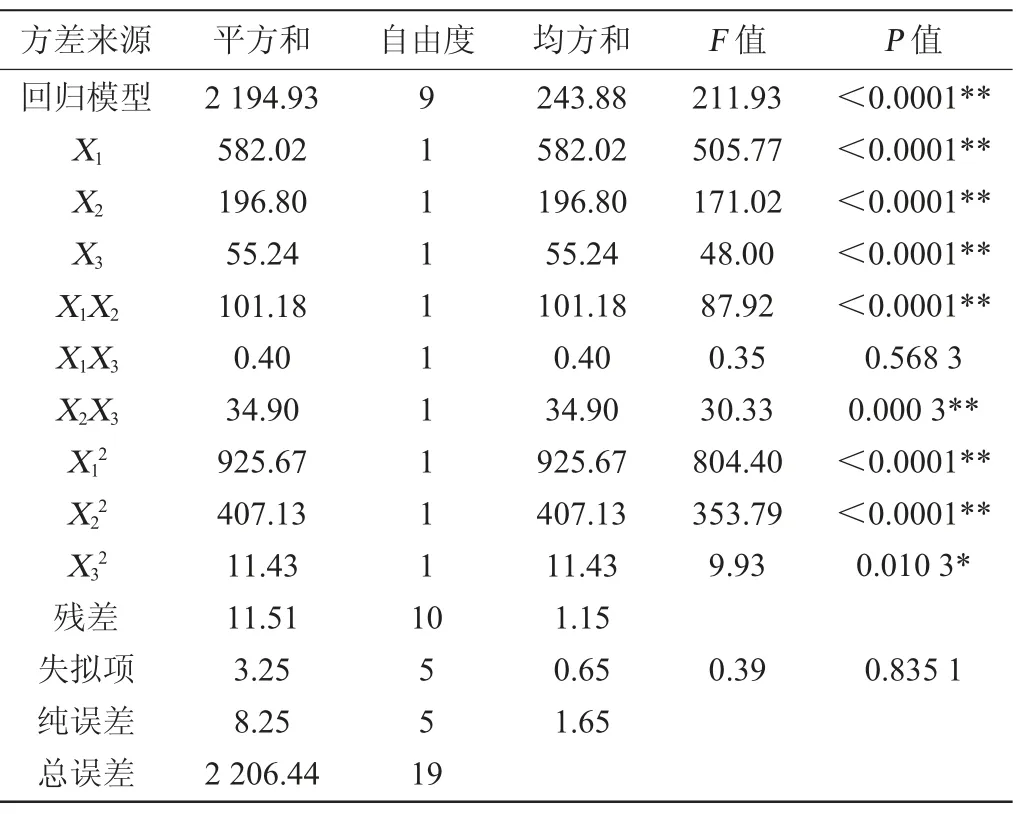
表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可看出,模型极显著(P<0.01),失拟项P=0.835 1>0.05,不显著,表明回归方程拟合程度良好,可用此模型对响应值进行分析和预测。模型信噪比(signal to noise ratio,SNR)是评价和应用模型进行数据拟合和评价结果预测受干扰的程度,常要求SNR>4[19]。本模型SNR=45.497>4,说明模型抗干扰较好;模型变异系数(coefficient of variation,CV)是衡量模型精密度和可靠性的重要评价指标,数值越小表示模型精密度越高,本模型=1.27%,表明模型可靠。模型决定系数R2=0.994 8,表明模型在99.48%程度上能够解释菌体存活率与各因素变量之间的关系,而调整决定系数R2adj=0.990 1,表明模型预测值与实际值具有较好的相关性。各阶系数显著性分析发现,模型一次项X1,X2,X3、交互作用项X1X2,X2X3以及二次项X12,X22对结果影响极显著(P<0.01),交互项X1X3影响不显著(P>0.05),二次项X32影响显著(P<0.05)。
观察两因素交互作用对响应值的影响可采用降维分析(dimension reduction analysi,DRA),即其他因素保持在零水平情况下,观察两个因素交互作用对响应值的影响并得到其响应面及等高线见图4。由图4可以看出,交互作用项X1X2,X2X3影响显著,而X1X3影响不显著。

图4 海藻糖、蔗糖和脱脂奶粉添加量交互作用对菌体存活率影响的响应面及等高线Fig.4 Response surface plots and contour lines of interaction between trehalose,sucrose and skimmed milk powder addition on cell survival rate
将回归方程分别对各自变量求偏导数并令其等于零,联立可得到三元一次方程组,通过规划求解可求出回归方程编码水平最优解,即X1=0.41,X2=0.02,X3=1.00,对应因素实际水平为海藻糖8.975 8%、蔗糖5.023 8%及脱脂奶粉6.78%。为操作方便,将各保护剂添加量修正为海藻糖9.0%、蔗糖5.0%和脱脂奶粉6.8%。在此最优条件下进行3次验证试验,菌体存活率为(95.24±0.84)%,与模型预测值96.762 1%接近。
3 结论
研究发现,热诱激处理能提高菌体的热耐受性和菌体存活率,最佳热诱激条件为稳定期菌体55 ℃热处理10 min;糖类保护剂中以8%海藻糖与5%蔗糖抗热保护效果较好;蛋白质类抗热保护剂以5%脱脂奶粉抗热保护效果较好。采用中心组合设计响应面优化技术研究了海藻糖(X1)、蔗糖(X2)和脱脂奶粉(X3)联用作为复合抗热保护剂对菌体存活率的影响,并对复合抗热保护剂配方进行了优化,获得了优化的抗热保护剂组分,即海藻糖添加量9.0%、蔗糖添加量5.0%和脱脂奶粉添加量6.8%。在此最优条件下,菌体存活率为(95.24±0.84)%,与模型预测值96.762 1%接近。研究结果表明,糖类保护剂与蛋白质类保护剂联用作为复合抗热保护剂比单一保护剂抗热保护效果更好,可较好的实现对益生菌枯草芽孢杆菌的抗热保护,能较好的提高菌体的热耐受性。

