核心蛋白变构调节剂的研究进展
高倩倩,韩开林,王国成*,陆 涛
(1天士力控股集团有限公司研究院化学药品开发中心,天津 300410;2中国药科大学理学院,南京 210009)
乙型肝炎是由乙型肝炎病毒(HBV)引起的可能危及生命的肝脏感染。据世界卫生组织(WHO)统计,截至2018年7月,全球约有2.57亿人长期感染HBV,其中有90%的慢性乙型肝炎(CHB)患者仍未确诊,仅有5%的患者得到治疗,每年因其并发症(包括肝硬化和肝癌)死亡的人数超过78万人[1-3]。市场专家预计到2024年,全球治疗乙型肝炎用药的市场规模将达到30亿美元。
核心蛋白变构调节剂是以核心蛋白为靶点的一类HBV抑制剂,其通过改变核心蛋白的构象来干扰核衣壳装配,进而影响病毒分子组装和逆转录等过程,最终抑制HBV的复制。相较于现有的抗病毒药物,该类抑制剂的作用更持久且药物耐受性更好。本文对核心蛋白变构调节剂的治疗机制和研究进展进行综述,旨在为抗HBV的新药开发提供参考。
1 核心蛋白
1.1 HBV复制过程
HBV病毒颗粒与肝细胞表面的细胞受体牛磺胆酸钠协同转运多肽(NTCP)相结合,通过巨胞饮作用被逐渐内化到肝细胞中[4]。病毒外膜与内体膜融合将核衣壳释放到细胞质中,然后病毒基因组松弛环状DNA(rcDNA)脱壳并被递送到肝细胞核中。rcDNA是由一条完整环状负链和一条半环状正链组成,在HBV DNA聚合酶作用下,正链以负链为模板延长,形成共价闭合的环状DNA(cccDNA)[5]。cccDNA作为游离型微染色体,转录形成多种病毒RNA,其中前基因组RNA(pgRNA)翻译生成核心蛋白和DNA聚合酶。DNA聚合酶与pgRNA5′端的ε序列结合,继而引发病毒DNA合成并启动核衣壳组装[6]。然后衣壳化的pgRNA逆转录生成负链病毒DNA,以其为模板合成正链DNA。随着rcDNA的形成,核衣壳成熟,将装配为新病毒颗粒并从细胞中分泌出来,或递送到细胞核中以扩增核cccDNA库(图1)。
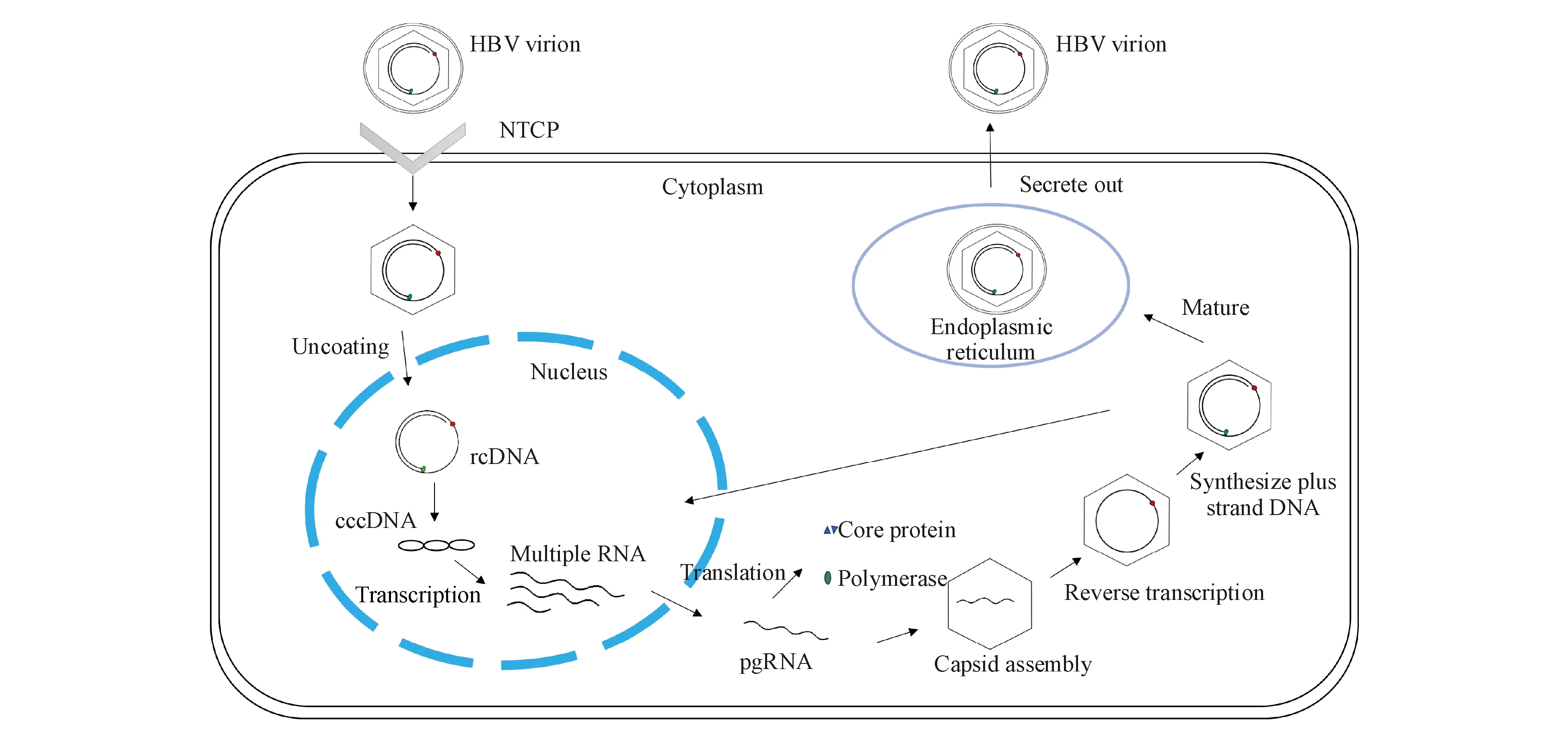
Figure1 Process of HBV replication
1.2 cccDNA
cccDNA最初是由来自病毒核衣壳的rcDNA合成的。此外在感染的早期,新合成的细胞质rcDNA可通过细胞内扩增途径产生额外的cccDNA。这两种途径最终导致每个被感染的肝细胞形成含5~50个cccDNA分子的受调节稳态群体。cccDNA是最稳定的HBV复制中间体,因此,治愈HBV感染需要消除cccDNA[7]。
当前,主要有两类药物被批准用来控制慢性HBV,即核苷(酸)类似物(NA)和干扰素(IFN)。NA可以抑制HBV DNA的合成,但不能直接消除cccDNA库和钝化的免疫反应。而IFN虽然影响病毒复制的多个步骤,但其疗效适中且药物耐受性差[8]。总之现有药物尚无法通过消除cccDNA来实现乙型肝炎的功能性治愈。
1.3 核心蛋白与核衣壳
HBV核心蛋白是一种多功能的小分子蛋白,其大小为21 kD,通常被认为是一种自组装形成病毒核衣壳的结构蛋白[9]。pgRNA和HBV聚合酶被封装于封闭的外壳内形成具有生物活性的核衣壳,而pgRNA的逆转录和rcDNA的形成就发生在此外壳中。核衣壳自组装是病毒生命周期中的关键步骤,且核心蛋白极度保守,是耐药性产生的天然屏障,故以核心蛋白为靶点的抗HBV药物已成为当前研发的热点。
2 核心蛋白变构调节剂(CpAMs)
核心蛋白变构调节剂(core protein allosteric modulators,CpAMs)是通过变构机制干扰核衣壳组装的小分子化合物。这些小分子能够改变核心蛋白二聚体的亚基或干扰亚基间的相互作用,形成有缺陷的核衣壳[8],进而影响HBV分子组装、逆转录、包装等过程,使HBV抑制得以实现,即CpAMs能够不同程度地调控来自新感染的cccDNA的生物合成和细胞内扩增途径,有望彻底治愈乙型肝炎[10]。
2.1 CpAMs的分类
根据作用机制的不同,CpAMs主要分为两类:Ⅰ类:形成异常装配的核衣壳,主要包括杂芳基二氢嘧啶类化合物(HAPs),其代表药物有Bay41-4109、GLS4等[11]。Ⅱ类:阻断pgRNA的衣壳化,主要包括苯基丙烯酰胺类化合物(PPAs)和氨磺酰苯甲酰胺类化合物(SBAs)。PPAs的代表药物有AT-61、AT-130等[12];SBAs的代表药物有NVR 3-778、AB-423等[13]。化合物结构见图2。

Figure2 Chemical structures of core protein allosteric modulators
2.2 CpAMs的临床研究进展
近年来,已有多个CpAMs被开发并逐步进入临床研究阶段,见表1。
Table1 Advances in clinical research of core protein allosteric modulators (CpAMs)
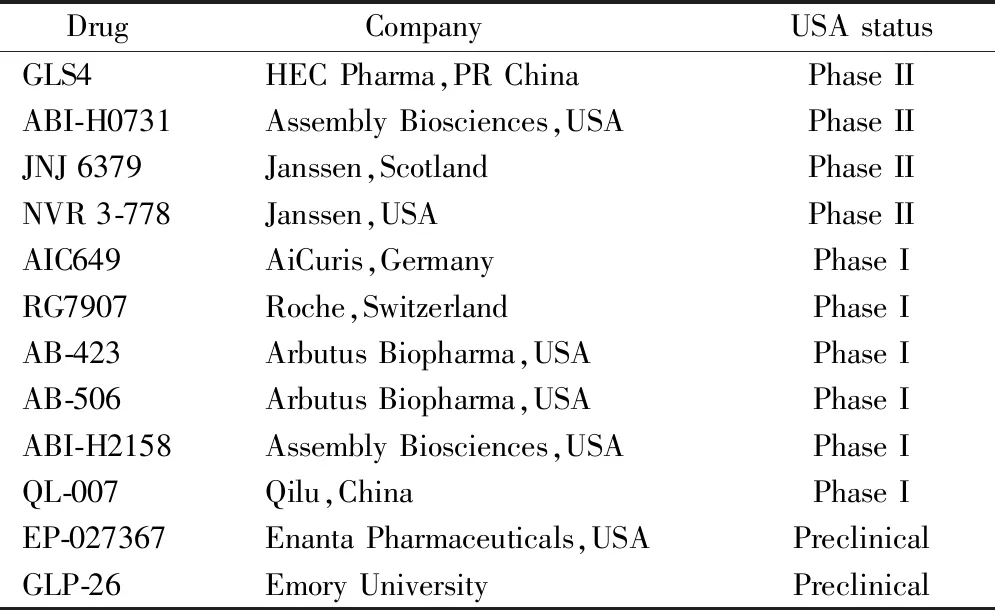
DrugCompanyUSAstatusGLS4HECPharma,PRChinaPhaseIIABI-H0731AssemblyBiosciences,USAPhaseIIJNJ6379Janssen,ScotlandPhaseIINVR3-778Janssen,USAPhaseIIAIC649AiCuris,GermanyPhaseIRG7907Roche,SwitzerlandPhaseIAB-423ArbutusBiopharma,USAPhaseIAB-506ArbutusBiopharma,USAPhaseIABI-H2158AssemblyBiosciences,USAPhaseIQL-007Qilu,ChinaPhaseIEP-027367EnantaPharmaceuticals,USAPreclinicalGLP-26EmoryUniversityPreclinical
2.2.1 GLS4 GLS4是由我国广东东阳光药业自主研发的一款Ⅰ类HBV核心蛋白变构调节剂(图3),目前处于Ⅱ期临床研究阶段。该抑制剂能够干扰HBV衣壳组装,加速异常衣壳形成,从而强烈抑制HBV的复制及成熟病毒颗粒的形成[14]。在HepAD38细胞系中,GLS4诱导了乙型肝炎核心抗原(HBcAg)的核周聚集并加速降解,随后高效阻断衣壳组装,即GLS4可以双重调节HBV衣壳的装配和分解[15]。
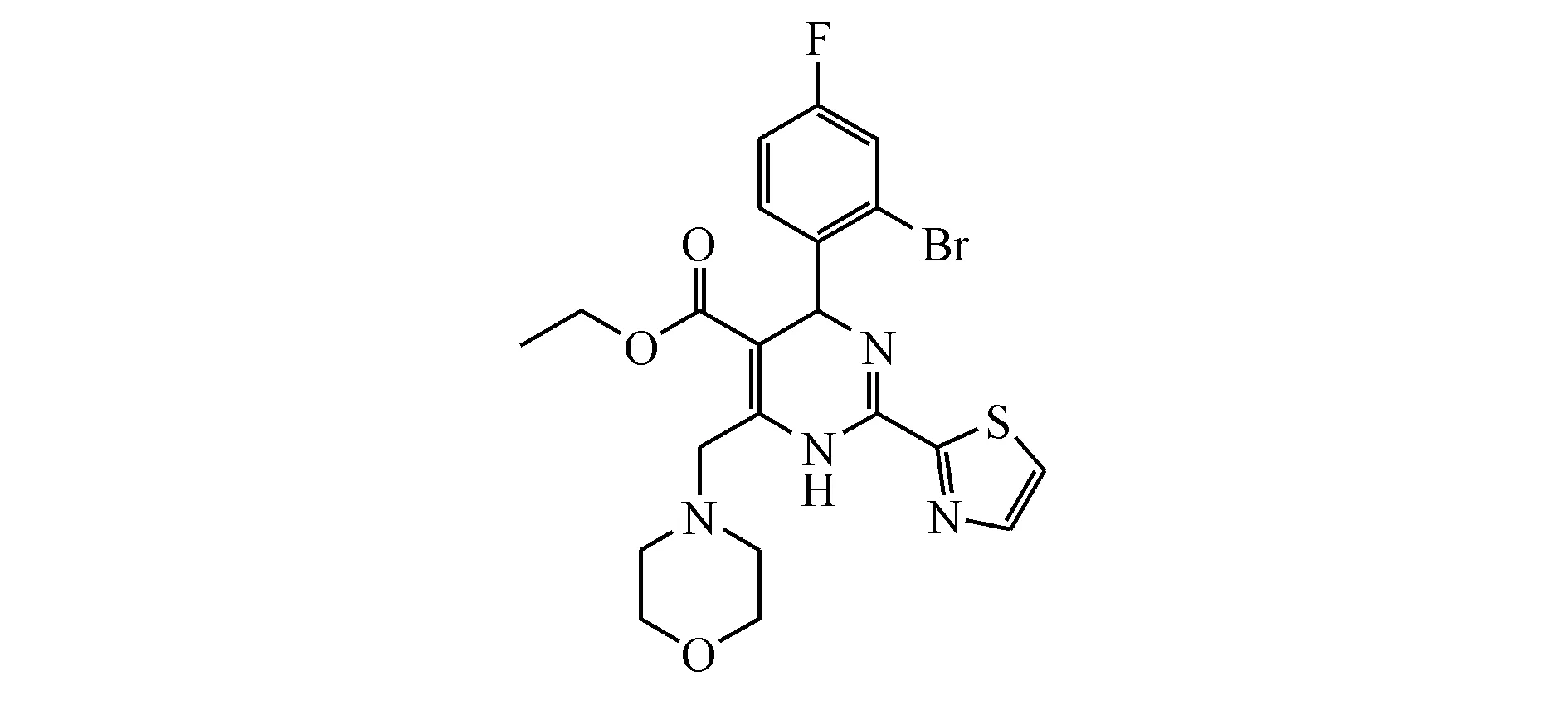
Figure3 Chemical structure of GLS4
体外研究发现GLS4能够有效抑制野生型和阿德福韦耐药型HBV的复制,IC50为12 nmol/L。在原代肝细胞中,GLS4的CC50(50%的细胞死亡的细胞毒性剂量)为115 μmol/L(P<0.001)。在HepAD38细胞系中,GLS4的CC90为190 μmol/L(P<0.01)[16]。
Ⅱ期临床数据显示,GLS4在患者体内达到稳态的平均时间约为10~14 d。对于乙型肝炎e抗原(HBeAg)阳性和阴性患者,GLS4能够有效抑制HBV DNA。在队列A和B中,HBV DNA的平均最大减少量分别为1.90×103和2.51×104IU/mL;HBsAg分别为1.58和2.75 IU/mL;HBeAg分别为3.72和11.5 IU/mL。此外,GLS4耐受性良好,多数为轻度不良反应(AE)[17]。
2.2.2 ABI-H0731 ABI-H0731是Assembly Biosciences公司研发的一款有效的选择性Ⅱ类HBV核心蛋白变构调节剂(结构尚未公布),目前处于Ⅱ期临床研究阶段。
Ⅰ期临床研究数据显示,所有剂量水平(100,200,300,400 mg)均产生有效的抗病毒活性,最大HBV DNA减少量为6.31×102IU/mL(300 mg)。在100 mg/d的最低剂量测试中,观察到HBeAg阳性和阴性患者体内的HBV含量分别降低了20.0和1.58×102IU/mL[18]。发现HBV RNA降低通常与血浆HBV DNA降低成正比。在400 mg剂量下,有1例患者发生单一3级紧急不良反应,导致药物中断。其他所有不良反应都是轻度(1级)且与研究药物无关。
ABI-H0731通常是安全且耐受良好的,患者具有与健康志愿者相似的剂量比例PK曲线,并且每日一次给药能够产生有效的抗病毒活性。
2.2.3 JNJ 6379 JNJ 6379是Janssen公司研发的一种新型有效的选择性Ⅱ类HBV核心蛋白变构调节剂(结构尚未公布),目前处于Ⅱ期临床研究阶段。
Ⅰ期临床研究中有1例严重的不良反应(右额叶肿块,与研究药物无关),1例由不良反应导致的停药(ALT/AST突升,但胆红素没有升高,可能与研究药物有关),未发现剂量限制性毒性[19]。
在有效性研究中,将HBeAg阳性或阴性慢性乙型肝炎患者以3∶1的比例随机分组,给予28 d的JNJ-6379或安慰剂进行治疗。在3个治疗组中都观察到HBV DNA和HBV RNA的显著降低,未观察到HBsAg的显著变化。25 mg组平均HBV DNA水平自基线下降1.44×102IU/mL,75 mg组平均HBV DNA水平自基线下降7.76×102IU/mL,25 mg 组的HBV RNA降低程度高于75 mg组[20]。
JNJ-6379通常耐受良好并且能够产生有效的抗病毒活性。
2.2.4 NVR 3-778 NVR 3-778是Janssen公司研发的一款Ⅱ类HBV核心蛋白变构调节剂(图4),目前处于Ⅱ期临床研究阶段。
Ⅰ期临床数据显示,NVR 3-778在所有剂量下都具有良好的耐受性。所有不良反应均为常见类型,除两个与研究药物无关的2级不良反应(扭伤和牙齿疼痛)外,其他均是短暂且轻度(1级)的[21]。

Figure4 Chemical structure of NVR 3-778
研究发现NVR 3-778+聚乙二醇干扰素的联合疗法使患者平均HBV DNA含量下降程度最大(93.3 IU/mL),其大于单独的NVR 3778(52.5 IU/mL)疗法或单独的PegIFN(11.5 IU/mL)疗法。此外,使用NVR 3-778+PegIFN、单独的PegIFN或单独的NVR 3-778疗法后,患者的定量血清HBeAg水平分别降低了1.62、1.86和2.14 IU/mL[22]。
在HepG2.2.15细胞系中,NVR 3-778、LMV(拉米夫定)、TFV(替诺福韦)和ETV(恩替卡韦)的平均EC50分别为0.47 μmol/L、0.11 μmol/L、1.4 μmol/L和3.2 nmol/L。NVR 3-778分别与3个核苷类似物联合使用,均可产生额外的抗病毒效果。在用最高化合物浓度处理的所有样品中,单独或联合治疗,细胞活力都保持在90%以上[23]。
NVR 3-778通常耐受良好且与PegIFN或NA联合治疗时能够增强抗病毒效果。
2.2.5 AIC649 AIC649是AiCuris公司研发的一款Ⅱ类HBV核心蛋白变构调节剂(结构尚未公布),目前已经完成了Ⅰ期临床研究。
在CHB土拨鼠动物模型研究中,用AIC649治疗诱导了独特的双相反应模式,发现土拨鼠肝炎病毒(WHV)DNA和表面抗原(WHsAg)比治疗前明显降低[24]。在AIC649+ETV的联合组中观察到显著,甚至更强且持续的抗病毒效果:WHV DNA和WHsAg在数月内保持显著抑制,甚至检测不到。该抑制剂可能实现乙型肝炎的功能性治愈。
Ⅰ期临床数据显示在所有剂量组中AIC649都是安全且耐受良好的,未发现剂量限制性毒性。虽然试验中患者存在个体差异,但是观察到单剂量的AIC649能够刺激患者的免疫系统,例如血浆中免疫调节细胞因子(包括IL-1β、IL-6、IL-8及IFN-γ)水平的升高和IL-10的降低[25]。
研究发现AIC649除抗病毒活性外,还可以预防和改善纤维化,且具有有效的抗肿瘤特性[24]。
2.2.6 RG-7907(RO7049389) RG-7907为Roche公司研发的Ⅰ类HBV核心蛋白变构调节剂(结构尚未公布)。该抑制剂能够诱导异常HBV核心聚集体的生成,致使衣壳组装缺陷,最终抑制HBV复制[26]。目前处于Ⅰ期临床研究阶段。
Ⅰ期临床研究第一部分显示,75名健康志愿者中有36名发生了55例不良反应。第二部分发现在7名慢性乙型肝炎患者中有3名发生了14例不良反应。所有不良反应均为轻微的,其中5例事件(恶心、腹部不适、皮疹和两例头痛)与RG-7907有关,没有严重的不良反应致使参与者停止服用该药。
Ⅰ期临床研究第二部分显示,在7名HBV患者中有6名完成了28 d每日两次的治疗。患者出现持续的HBV DNA下降情况,最大下降了2.51×103IU/mL[26]。其中有3人的病毒载量低于检测线。在所有接受RG-7907治疗的患者中未出现病毒学反弹。RG-7907通常耐受性良好,并且在CHB患者给药28 d后表现出强大的抗HBV活性。
2.2.7 AB-423 AB-423为Arbutus公司研发的Ⅱ类HBV核心蛋白变构调节剂(图5),AB-423通过阻断pgRNA衣壳化来抑制HBV复制[27]。目前处于Ⅰ期临床研究阶段。
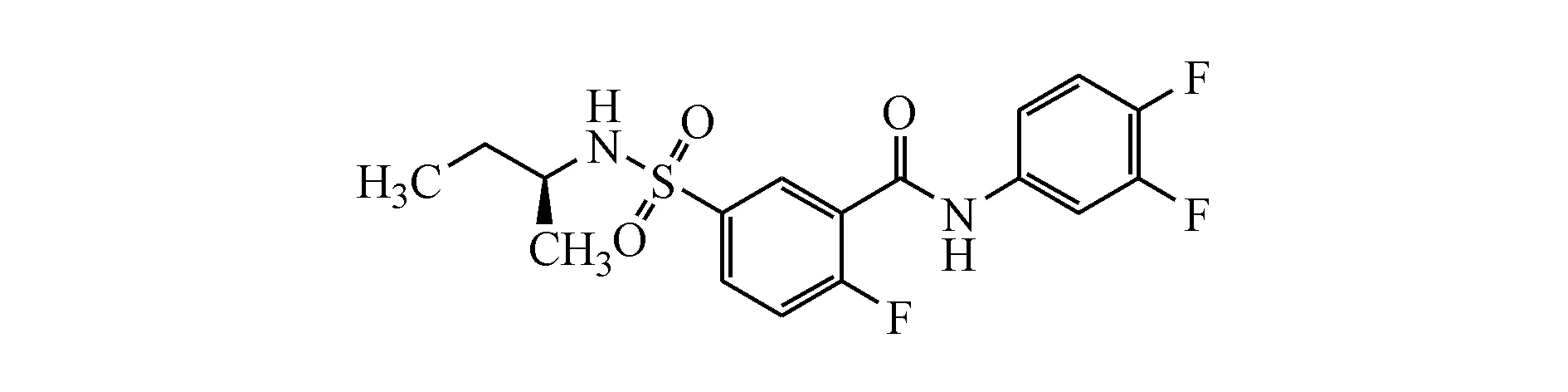
Figure5 Chemical structure of AB-423
AB-423在小鼠细胞中有效抑制HBV rcDNA的形成,平均EC50为275 nmol/L,CC50>10 μmol/L[28]。在肝癌细胞中,cccDNA的形成受到类似的抑制作用。给予从uPA/SCID嵌合小鼠体内分离的受染原代人肝细胞1.0 μmol/L的AB-423,细胞外HBV DNA库下降了约10.0 IU/mL[28]。
Ⅰ期临床研究过程中没有出现严重的不良反应。虽然在6名受试者中有7例不良反应报道考虑跟药物有关,但均为轻度,稀松状的大便较为常见。
AB-423是一种很有前途的抗病毒药物,安全性和耐受性良好。其在细胞培养系统和HBV小鼠模型中,单独以及与恩替卡韦或TKM-HBV联合使用时均能够有效抑制HBV复制[27]。
2.2.8 AB-506 AB-506为Arbutus公司研发的一款Ⅱ类HBV核心蛋白变构调节剂(结构尚未公布)。目前处于Ⅰ期临床研究阶段。
临床前数据显示,在小鼠、大鼠和狗中,AB-506(10~100 mg/kg)暴露良好,肝脏蓄积明显,t1/2分别为2.6、4.3和11.4 h,生物利用度约为100%。注射AB-506(10~100 mg/kg)后,血清HBV DNA呈剂量依赖性减少。与恩替卡韦相比,AB-506在血清HBV DNA抑制相当的剂量下,对肝脏HBV DNA有更强的抑制作用[29]。
研究发现使用AB-506+AB-452,AB-506+TDF和AB-452+TDF联合治疗HBV感染的小鼠7 d后,血清HBV DNA水平分别比对照组降低了25.1、79.4和1.58×102IU/mL[29]。而三联组合使血清HBV DNA的降低幅度更大,相较于对照组下降了6.30×102IU/mL。
与衣壳抑制剂AB-423相比,AB-506具有更好的药效和药代动力学,此外其联合疗法的抗病毒效果较为显著。
2.2.9 ABI-H2158 ABI-H2158为Assembly Biosciences公司研发的一款Ⅱ类HBV核心蛋白变构调节剂(结构尚未公布),用于HBV感染的潜在口服治疗,目前处于Ⅰ期临床研究阶段。
临床前研究发现,在HBV感染的HepG2-NTCP 细胞系中,ABI-H2158能够有效阻断cccDNA的形成,抑制病毒DNA的复制。
Ⅰa期临床研究过程中出现的不良反应均为轻度,ABI-H2158有良好的耐受性。在口服使用后,ABI-H2158显示出50%~100%的高生物利用度。单剂量PK结果显示其被迅速吸收,t1/2为10~18 h,表明可以每日给药1次[30]。该抑制剂将进入Ⅰb期临床研究(NCT03714152)。
2.2.10 QL-007 QL-007为齐鲁药业研发的一款Ⅰ类HBV核心蛋白变构调节剂,目前处于Ⅰ期临床研究阶段。
2017年8月开始Ib期研究(NCT03244085;QL007002),主要针对慢性乙型肝炎患者(预计n=18)进行不同剂量QL-007的安全性、有效性和药代动力学特征的评估。目前Ⅰ期临床结果尚未公布。
2.2.11 EP-027367 EP-027367是Enanta制药公司开发的一款Ⅱ类CpAMs(结构尚未公布)。其能够误导HBV衣壳组装并在体外阻断HBV的pgRNA衣壳化,目前处于临床前研究阶段。
临床前数据显示在HepG2.2.15、HepAD38及HepDE19细胞系中,EP-027367抑制HBV rcDNA的形成,EC50分别为20、24和40 nmol/L。EP-027367还能够抑制HBV的多种基因型,对基因型A至H的EC50分别为11、9、7、12、10、34、24和21 nmol/L[31]。28 d内,每日两次给与人肝嵌合小鼠该抑制剂(50、100和200 mg/kg),发现HBV DNA水平相比基线分别降低了1.58×102、5.01×102和1.00×103IU/mL[31]。此外,EP-027367与ETV以及GLS4均有协同抗HBV作用。
EP-027367具有强大的体外和体内抗病毒活性,是一种有前途的抗病毒候选药物。
2.2.12 GLP-26 GLP-26为美国埃默里大学医学院研发的一款Ⅱ类HBV核心蛋白变构调节剂(图6),目前处于临床前研究阶段。
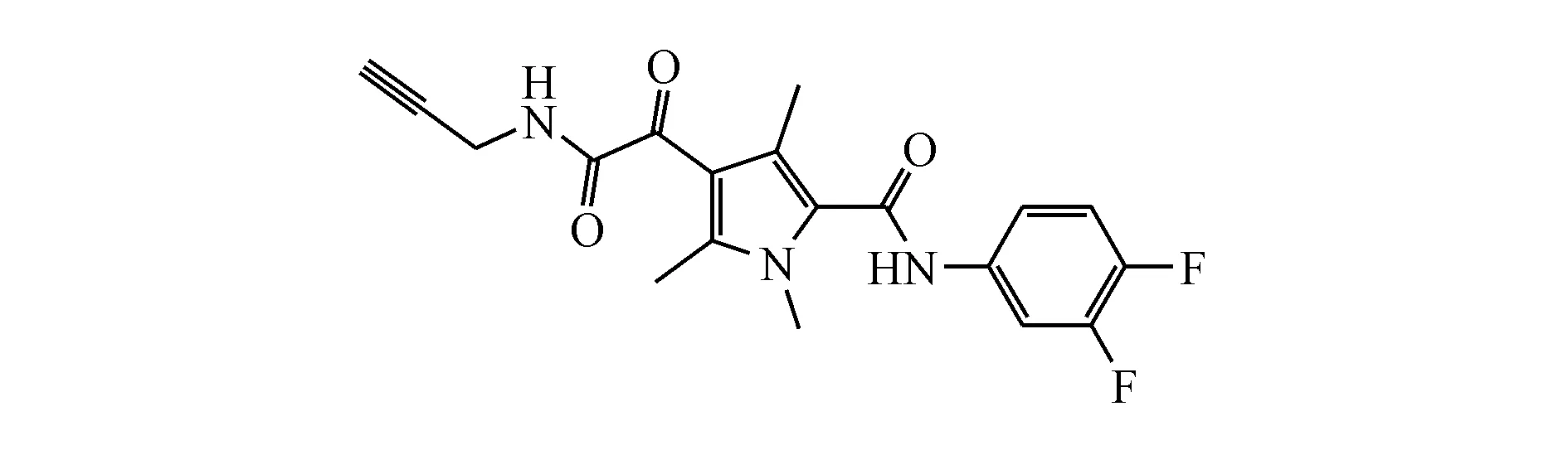
Figure6 Chemical structure of GLP-26
临床前研究数据显示在野生型HBV转染的HepNTCP-DL细胞系中,GLP-26和GLS4均可降低HBeAg的分泌,EC50分别为0.7和1.7 μmol/L。在HBV核心T109I突变体(对HAP耐药)转染的HepNTCP-DL细胞系中,GLP-26能够有效抑制cccDNA的形成和HBeAg的分泌,其使cccDNA含量下降了31.6 IU/mL,而GLS4没有该效果。两种CpAMs均对pgRNA或小分子RNA没有影响。GLP-26与ETV的联合疗法抑制了T109I突变体转染的细胞中cccDNA的扩增,并可产生强烈的协同抗病毒效果,在HepAD38细胞系中加权平均组合指数为0.4[32]。而GLS4没有协同抗病毒作用。
综上,GLP-26可以对抗耐药的HBV,其与抗病毒剂的联合应用可以阻断cccDNA形成,有望功能性治愈乙型肝炎。
3 结语与展望
虽然现有抗病毒药物(核苷酸类似物和干扰素等)可以有效抑制HBV复制,但其在研发过程中仍存在一些问题:核苷酸类似物不能清除细胞核内的cccDNA,停药后cccDNA可以复制生成新的病毒颗粒,所以患者需要长期用药;干扰素的疗效适中且药物耐受性差[8]。目前乙型肝炎尚不能被彻底治愈,其瓶颈即为核cccDNA库无法被完全清除。研究发现,核心蛋白参与HBV生命周期的多个方面:病毒衣壳的形成、pgRNA衣壳化及其逆转录,以及作为病毒微染色体的组成部分等,因此核心蛋白是很有潜力的新型抗HBV靶点[9]。
核心蛋白变构调节剂以核心蛋白为靶点,可以影响HBV复制的多个步骤,不同程度地调控来自新感染的cccDNA的生物合成和细胞内扩增途径,有望完全治愈乙型肝炎。近年来,越来越多的CpAMs进入临床研究,且数据显示该类抑制剂的不良反应较少、GLS4和GLP-26可以对抗HBV耐药变体,以及多个CpAMs(NVR 3-778、AIC649等)与PegIFN或NA联合治疗时能够增强抗病毒效果。这些表明CpAMs有望解决NA的耐药问题,该类抑制剂与其他抗病毒药物的联合疗法将有可能成为抗HBV的趋势。
然而,当前进入临床阶段的核心蛋白变构调节剂仅直接作用于核衣壳,针对核心蛋白其他功能的药物还需进一步探索。随着研究的深入,相信会有更多更好的抗HBV新药出现,争取早日实现乙型肝炎的功能性治愈。

