乙草胺除草剂的环境行为及去除技术研究进展
刘静陈鲲宇王杰高正阳商卓
(1.山东建筑大学市政与环境工程学院,山东 济南 250101;2.山东省环境保护科学研究设计院,山东 济南250013)
0 引言
乙草胺除草剂化学名称为2-乙基-6-甲基-N-乙氧基甲基-α-氯代乙酰苯胺,是一种芽前选择性酰胺类化合物,主要用于玉米、大豆、花生等作物的杂草防除。乙草胺已在全世界范围得到广泛使用,尤其是在中国[1],每年的使用量超过10 000 t[2]。乙草胺具有结构稳定、不易挥发和光解、在水体和土壤中易迁移[3]、浓度会产生季节性变化等特点[4],且其代谢产物醌亚胺具有致癌作用,美国环境保护局已确定其为B-2类致癌物质[5]。鹿特丹公约最后管制行动通知中乙草胺位列其中,欧盟委员会已决定不再注册乙草胺除草剂[6]。
毒理研究表明:乙草胺对哺乳动物的心血管系统、免疫系统和内分泌系统均有损害[7],可以诱导氧化应激行为和细胞凋亡[8],并且已证明其具有遗传毒性[9]。由于土壤、地面和地表水的污染,乙草胺及其残留物可通过生物累积作用[10]存在于食物和饮用水中,人类直接或间接接触,易对环境和人体健康造成严重的危害[11]。研究乙草胺的环境行为及其去除技术,旨在降低乙草胺的环境残留,为减缓乙草胺的药物危害和减轻环境污染提供科学依据。
1 乙草胺除草剂的环境行为研究进展
乙草胺的环境行为与其分子结构和物理化学性质有不可分割的联系,其分子式为C14H20ClNO2,摩尔质量为269.77 g/mol,分子结构式如图1所示。
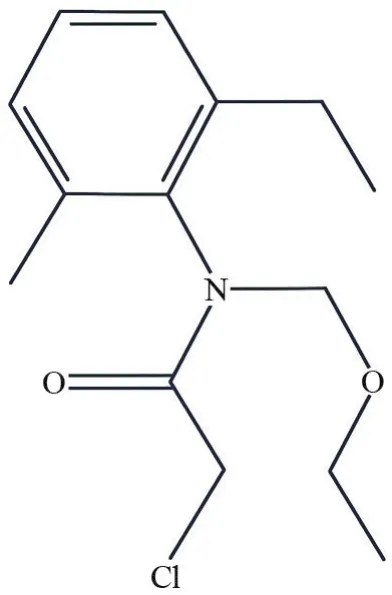
图1 乙草胺的分子结构式图
1.1 乙草胺的迁移规律
土壤生态环境是一个复杂的多介质、多界面体系,包括固土矿物和有机质、地下水和地表径流以及各种植物及微生物,与大气相连。乙草胺虽直接施用在土壤中,但因其具有半挥发性、疏水性和易迁移的特性[3],可通过淋溶进入地表和地下水体,在土壤、大气、水体等多介质中造成扩散性污染。
在土壤—水环境中,乙草胺的迁移主要受吸附和脱附影响。土壤中乙草胺的吸附主要以土壤有机质为主,有机质含量越高,土壤的吸附能力越强[13]。张燕飞等[14]研究红壤对乙草胺的吸附属于吸热、化学吸附、熵变增加过程,水稻土、潮土对乙草胺的吸附均属自发、吸热、物理吸附、熵变增加的过程。乙草胺在土壤中的迁移包括纵向和横向移动,主要是借助渗透水的作用,以下移为主[15]。地表水及浅层地下水具有较强的流动性,不易积累残留于水环境中的乙草胺,且季节性变化明显[16-17]。美国地质调查局在美国中西部地区和密西西比河及其支流中检测到了乙草胺及其代谢产物[18],印证了乙草胺的多介质迁移特性会导致扩散性污染。
1.2 乙草胺的转化规律
乙草胺在环境中迁移的同时还发生光解、水解和生物转化行为,转化主要发生在土壤和水环境中。微生物种类、湿度、类型、pH值、光照等土壤特性直接影响乙草胺的转化行为,微生物的降解是乙草胺在土壤中耗散的主要作用[1]。朱九生等[19]发现乙草胺在土壤中的降解速率符合一级反应动力学方程,微生物的存在可显著加快土壤环境对乙草胺的降解。另外,土壤湿度增加、pH值增大、温度升高均能加快乙草胺的降解,主要原因可能是促进了土壤微生物的生长繁殖和酶促反应,加速了乙草胺的生物降解。蚯蚓协助微生物降解有机污染物是一种新的环境友好型生物修复方法。蚯蚓可以中和土壤pH值,增加酶活性,间接增加土壤微生物的丰富度和活性,提高有机污染物的生物利用度,显著改善土壤的营养状况[20],促进土壤中微生物对乙草胺的降解。同时,蚯蚓也可以在一定程度上修复由乙草胺引起的土壤微生物损伤[21]。Tan等[22]研究发现乙草胺与土壤之间可能存在化学键和氢键,氢键的形成方式如图2所示。冯慧敏等[23]对2类土壤微生物降解乙草胺的行为进行了系统研究,证明细菌对乙草胺的降解作用远大于真菌,但真菌的耐受能力远大于细菌。低剂量乙草胺可以在一定程度上改变微生物群落结构,长期应用对土壤质量有潜在影响。此外,土壤中的一些其他农药和重金属离子对乙草胺的降解也有一定影响[24]。
图2 土壤和乙草胺之间的氢键图
乙草胺在水体环境中的降解途经主要为水解和光解(非生物降解),水解的影响因素主要为温度和pH值等,光解的主要影响因素为光源、溶解性有机物(主要指腐殖质)、无机盐、颗粒物、pH值等。水解时,温度会影响乙草胺的整体水解速率;温度确定时,pH值的改变对乙草胺的水解速率影响不大[25]。水中硝酸盐和亚硝酸盐等无机盐的存在也会显著加快乙草胺的水解效果[26]。此外,适量腐殖质的添加对乙草胺的水解呈促进作用,原因可能为腐殖质中大量的羧基在低添加时对乙草胺水解有催化作用。光解时,陈茜茜等[25]的实验证实当pH值<6时,有利于光解;而>6时,则会抑制光解。花日茂等[27]研究了乙草胺在水环境中的光解速度,发现其随水体pH值升高而增大,结论不同的原因可能是两者使用的灯源及初始实验浓度不同。乙草胺的光解受腐殖质和颗粒物抑制,原因可能为添加腐殖质和颗粒物时会产生光掩蔽效应,腐殖质吸附农药分子,使其光解效率降低[28]。整体来看,硝酸盐和亚硝酸盐等无机盐、pH值和腐殖质对水解的影响程度普遍大于光解。光源是影响乙草胺光解速率的一个重要因素,赖晓丹等[29]研究表明乙草胺在水溶液中的光解属于一级动力学反应,光解速率次序为:汞灯>氙灯+H2O2/Fe2+>氙灯+H2O2>氙灯,且乙草胺添加H2O2、乙草胺添加H2O2/Fe2+与乙草胺不添加任何试剂所产生的降解产物不同。乙草胺的最大吸收光谱为194.0 nm,对于太阳光不能有效吸收,仅能够有效吸收紫外光[27],这也为利用紫外光降解乙草胺的技术打下了理论基础。
1.3 乙草胺在环境中的归趋
环境现状调查显示:在水环境中,乙草胺及其降解产物往往具有最高的检测率和浓度[30-31]。我国36个重点城市的水源水和出厂水中的乙草胺检出率为66.9%,其平均浓度为33.9 ng/L[32]。在美国中西部的饮用水源和溪流中检测到的乙草胺浓度为10~100 ng/L[33],且部分城市雨水中检测出含有乙草胺[34]。另外,在土壤环境中,我国东北河流沿岸土壤中检出0.03~709.37 mg/kg的乙草胺,玉米土壤中乙草胺残留量为54.76 mg/kg[35]。可见,无论是在水环境还是土壤环境中,乙草胺造成的污染都十分严重,研究乙草胺的污染去除技术显得极为重要。
2 乙草胺除草剂的去除技术研究进展
2.1 微生物降解法
近年来,乙草胺的微生物降解因其处理费用低、效果好、对环境的影响小、处理操作简单而广受关注[36],新开发出的高效降解菌种也有很多,如Rhodococcus、Klebsiella variicola、Bacillus subtilus和Methylobacillus等。Hou等[37]从被乙草胺污染的土壤中连续富集获得了乙草胺降解富集培养物并将其命名为Rhodococcussp.T3-1。菌株T3-1可以通过去乙氧基甲基的方式降解乙草胺并将其转化为2-氯-N-(2-乙基-6-甲基苯)乙酰胺(CMEPA),而后菌株Delftiasp.T3-6能够通过酰胺键的裂解将CMEPA降解为2-甲基-6-乙基苯胺(MEA),但菌株T3-6和 T3-1不能降解 MEA。最终,菌株Sphingobiumsp.MEA3-1将代谢物MEA完全矿化为CO2和H2O。乙草胺的完全降解依赖于菌株T3-1、T3-6和MEA3-1的生化配合,这3种菌株的组合降解能力远高于之前报道的单一纯培养物,并可在6 d内完全降解100 mg/L乙草胺,具体的降解机理如图3所示[37]。然而,乙草胺去乙氧基甲基的代谢机制和MEA的矿化过程尚不清楚。Wang等[38]从菌株T3-6中纯化了可以催化CMEPA酰胺键裂解的高活性芳基酰基酰胺酶DamH,推测DamH可以分解酰胺键。在其他菌种的研究中,Bacillus subtilisL3在48 h内对乙草胺的降解率为 52.01%[39],Klebsiella variicolaB-2在30℃条件下培养5 d,对乙草胺的降解率可达90.31%[40]。
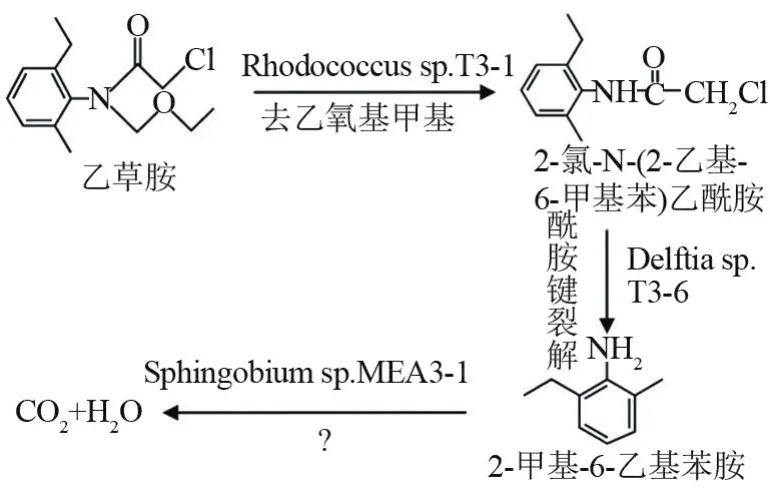
图3 Rhodococcus sp.T3的降解机理图
因为微生物的降解作用受多种因素影响,如温度、pH值、土壤肥力、土壤含氧量等[41],所以简单地将这些微生物添加到土壤中并不能有效地降解乙草胺。以Rhodococcussp.T3-1为例,菌株T3-1降解乙草胺的最适温度为37℃,最适pH值范围为6~10,且 Ba2+、Co2+、Mn2+、Fe3+和 Cu2+对菌株 T3-1 降解乙草胺具有较强的抑制作用,而Ca2+、Li+、Mg2+和Ni2+则可加快其对乙草胺的降解效率[42]。
除此之外,还可以通过生物强化,即向土壤中添加易于吸收的底物来促进降解。然而,这种方法也存在低基质时的有效性问题[43]。因此,为微生物创造合适的生存环境或增强微生物的耐受性成为包括乙草胺在内的有机污染物生物修复的主要研究方向。
2.2 物理化学法
混凝法和Fenton法是2种较常规的降解废水中乙草胺的方法。李新惠等[44]研究了混凝法在pH=7、聚合氧化铝用量为1 g/L、n(聚合氧化铝)︰n(聚丙烯酰胺)=20︰1时,混凝效果最好,对实验的影响程度排序为聚合氧化铝用量>聚合氧化铝/聚丙烯酰胺>pH值。Fenton法在pH=4、H2O2用量为16.65 mg/L,n(H2O2)︰n(Fe2+)=5∶1,反应时间为90 min时,使废水COD下降最大且对实验影响最大的是H2O2用量。在Fenton单因素实验中,随H2O2用量的增加,废水化学需氧量 COD(Chemical Oxygen Demand)先下降后上升;当 H2O2为22.2 mg/L时,COD最小。根据Fenton试剂氧化原理,适量的H2O2与Fe2+反应可以产生大量具有强氧化能力的·OH,但是过量的H2O2也是·OH的俘获剂,会抑制溶液中·OH的产生,所以当H2O2用量过高时COD会升高,如图4所示[44]。

图4 废水Fenton单因素实验图
黑碳具有较大的比表面积和丰富的官能团,可以有效地吸附疏水性污染物,因此对有机污染物在环境中的迁移转化有很大的影响。生物炭是黑炭的一种,具有密度低、比表面积大、稳定性强等特点,在土壤改良、污染土修复等方面具有广泛应用前景[45]。王子莹等[46]对2种来源的生物炭(松木屑和猪粪便)进行了深入研究,灰分含量高的生物炭对乙草胺具有较强的吸附能力,生物炭的表面极性[(O+N)/C]和吸附能力lgKoc之间为正相关关系,表面极性官能团的氢键作用可能是控制低温生物炭(热解温度<450℃)吸附乙草胺的主要因素;高温生物炭(热解温度≥450℃)的芳香度和lgKoc之间成显著的正相关关系,说明高温生物炭吸附乙草胺主要受芳香碳组分的影响。张桂香等[47]采用了400、500和600℃下制备的玉米秸秆生物炭降解乙草胺,乙草胺在生物炭和土壤中的吸附等温线符合Freundlich模型(R2≥0.99),随着生物炭热解温度的升高,吸附乙草胺的非线性指数n值减小,但lgKoc值增大,这表明随着生物炭炭化程度增强(H/C降低)、疏水性增强(O/C减小)和比表面积增大,生物炭对乙草胺的吸附非线性程度和吸附能力增强,且以表面吸附为主(如疏水作用、孔填充作用等)。然而,乙草胺的土壤吸附n值接近1,几乎为线性吸附。3种不同温度下制备的生物炭对乙草胺的吸附能力都高于土壤,且较高温度下制备的生物炭比土壤对乙草胺的吸附能力高1个数量级以上,将其施加到农田土壤中可使土壤对乙草胺的吸附能力增强,有效降低乙草胺的迁移性。
实现土壤—生物炭—除草剂三者之间形成最佳的环境效应是今后研究的一个重点。虽然生物炭对乙草胺的吸附能力显著,但并未将乙草胺最终降解为无毒、无害的简单小分子,对环境仍然具有潜在危害。而光催化氧化技术可在光照条件下将乙草胺最终降解为CO2和H2O等无机小分子,并具有环境友好和无二次污染等优点,故利用光催化氧化技术降解乙草胺已经成为研究热点。
李岩[48]以α-Fe2O3纳米材料降解水中乙草胺。由于Fe2O3纳米材料是半导体的能带结构,在光能的作用下,可生成具有强氧化性的·OH,可将乙草胺最终降解为无毒无害的简单小分子。但Fe2O3的形貌、添加量以及反应时的pH值都会对乙草胺的降解效果产生影响,其原因可能为形貌不同时纳米Fe2O3的比表面积不同,使得有效反应面积不同。pH值以及纳米Fe2O3的添加量不同可能导致纳米Fe2O3产生的电子-空穴对密度不同,进而产生的·OH的量不同,故而影响对乙草胺的降解效果。Fu等[49]分析了紫外光催化条件下,在初始乙草胺浓度为 50 mg/L、pH=7、H2O2用量为40 μL且 α-Fe2O3的添加量为200 mg/L时,乙草胺的降解效率可高达91%,比传统Fenton氧化降解乙草胺的降解效率大幅提高[50],有效降低了废水毒性,提高了可生化处理性,为后续的生物处理提供了保障。俞娥[51]制备了银掺杂的TiO2纳米管并将其负载到微孔滤膜上,在紫外光催化的条件下进行了光催化和共过滤实验,当掺银量为1%时催化剂的活性最大,对乙草胺的降解效率最高可达90.8%。但由于纳米TiO2带隙较宽,只能由短波长的紫外光激发,而太阳光谱中紫外光仅占5%,导致其对太阳能的利用率很低。光生载流子的高复合率使得量子效率较低,且纳米TiO2光催化剂颗粒小、难以分离,不利于回收利用,所以不能将纳米TiO2大规模投入应用。
随着人们对TiO2改性方法研究的不断加深,出现了一些新兴的方法,石墨烯负载就是其中一种热门的方法。石墨烯是单层C原子以sp2杂化方式形成的一种新颖二维碳材料,是构建其他维数碳材料的基本单元,具有良好的导电性、巨大的比表面积、优异的吸附性能[52]。李翠霞等[53]采用溶胶—凝胶法制备还原氧化石墨烯/TiO2复合材料并进行性能测试,石墨烯/TiO2复合纳米材料大幅度提高了对光的吸附和催化性能。Kim等[54]研究了氮掺杂石墨烯可将材料的光吸收范围由紫外光拓展至可见光,且氮的掺杂还可以显著提高复合材料的光催化稳定性[55]。
总体而言,物理吸附法虽然对乙草胺具有较高的吸附效率,能有效降低乙草胺的迁移性,但并未对其进行化学降解,对环境仍然具有潜在的危害。而高级催化氧化法可以将乙草胺最终降解为CO2和H2O等无机小分子,且具有环境友好和无二次污染等优点。随着石墨烯以及改性石墨烯的引入,在为纳米粒子提供最佳载体的同时,还可吸附大量污染物,提高纳米半导体材料的光催化性能,石墨烯负载的纳米半导体材料是光催化降解乙草胺的理想材料。
3 展望
乙草胺是我国使用最多的除草剂之一,对环境的污染十分严重。在自然土壤环境中,乙草胺主要依靠细菌、真菌和蚯蚓等土壤生物协作降解。目前研究的乙草胺高效降解菌对土壤肥力、pH值、土壤溶解氧等土壤要求较高,大多限于实验室阶段,并未大规模投入应用。因此,为土着微生物创造合适的生存环境或增强土着微生物的耐受性,使其能够大规模投入应用成为包括乙草胺在内的有机污染物生物修复的主要研究方向。在自然水体中,乙草胺的降解主要依靠水解和光解共同作用。由于光催化氧化技术能将乙草胺最终降解为CO2和H2O等无机小分子,且具有不造成二次污染、环境友好等优点,故光催化氧化技术是降低乙草胺环境风险的理想方法。但大多数光催化氧化技术都需紫外光催化作为反应条件,耗费较高。随着石墨烯及改性石墨烯的引入,可将光催化条件由紫外光拓展至可见光,以石墨烯负载纳米半导体材料,在可见光催化条件下利用吸附和高级氧化耦合技术降解乙草胺成为主要的研究方向。

