Caspase-1信号通路介导的细胞焦亡在放射性肠炎中的作用*
李静,吴东明, 喻叶,王越峰,许颖
610500 成都,成都医学院第一附属医院 检验科
腹盆腔恶性肿瘤是发生率最高的恶性肿瘤之一,放射疗法在腹盆腔恶性肿瘤患者治愈和姑息治疗中扮演重要角色[1]。尽管随着放射物理学和技术的发展,放疗在“物理精准”上已经取得了很大进步,但“物理精准”方法仍然无法彻底解决辐射对正常组织毒性作用的问题[2]。在放射治疗腹内或盆腔恶性肿瘤时,辐射场不可避免地会包括健康肠道,引发不良后果,随后表现为辐射诱导的肠损伤[3]。据报道,接受腹内或盆部放疗后的患者,约60%~80%会出现急性消化道不适症状,其中,约50%的患者会出现不同程度的慢性肠功能障碍[3]。放射性肠损伤过程复杂,发生机制尚不明确。近年来,越来越多的证据表明炎症在放射性肠损伤中起重要作用[3-4]。细胞焦亡是近年来新发现的一种依赖半胱天冬酶活化的促炎程序性细胞死亡方式,以细胞肿胀裂解并伴随大量促炎因子释放为主要表现形式[5],但胱天蛋白酶1 (cysteinyl aspartate specific protease 1,Caspase-1) 介导的细胞焦亡是否参与放射性肠炎的发生发展,至今尚少见相关报道。因此,本研究拟结合动物和细胞水平探讨Caspase-1信号通路介导的细胞焦亡在放射性肠炎中的作用,为开发预防或缓解性治疗提供新的思路。
1 材料和方法
1.1 实验材料
6~8周龄,雌性BALB/c小鼠,体重(18±2)g,购于达硕动物科技有限公司,动物饲养严格遵守实验标准进行。正常人肠上皮细胞株(normal human intestinal epithelial cells,HIEC)为本课题组保存。gasdermin D的N末端(GSDMD-N)、含pyrin结构域核苷酸结合寡聚化结构域样受体家族3[nucleotide-binding oligomerization domain (NOD)-like receptor family,pyrin domain containing 3,NLRP3]抗体、胱天蛋白酶1特异性抑制剂(Z-YVAD-FMK,YVAD)购自Abcam公司。Caspase1、含CARD结构域凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、白细胞介素18(interleukin-18,IL-18)、IL-1β、Caspase1-p20抗体购自CST公司。GAPDH抗体,辣根过氧化物酶标记的山羊抗小鼠IgG和山羊抗兔IgG购自Proteintech公司。Caspase-1活性检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)释放检测试剂盒、CCK-8试剂盒、蛋白浓度测定试剂盒购自上海碧云天生物技术公司。免疫组化试剂盒及二氨基联苯胺(diaminobenzidine,DAB)显色液购于北京中杉金桥。本实验所用细胞96孔板、六孔板、培养皿均购于Corning公司。MEM培养基、0.25%胰酶购于hyclone公司,胎牛血清、青-链霉素购于Gbico公司。RNA提取试剂盒购于北京索莱宝生物公司。逆转录及扩增试剂盒购于BIO-RAD公司。ELISA试剂盒购自贝塞维斯(深圳)生物科技公司。
1.2 实验方法
1.2.1 标本收集及处理 随机将10只健康小鼠分为对照组(n=5)和辐射组(n=5)。辐射组小鼠经麻醉后仰卧固定,腹部辐射野30mm×50mm,X线一次性辐射15Gy[6],对照组麻醉后不做处理。辐射7d后,取对照组和辐射组血清用于ELISA检测,然后断颈处死,迅速切开腹腔取小鼠小肠,取部分置于100g/L甲醛溶液中固定,部分存放于-80℃。
1.2.2 细胞培养和处理 将复苏的HIEC细胞用含有15%的FBS,100μg/mL链霉素和100U/mL青霉素的MEM培养基,于37℃、5%CO2培养箱中培养。待细胞达到70%~80%汇合时,分为对照组、电离辐射(ionizing radiation,IR)组和YVAD+IR组。IR组采用X线一次性辐照15Gy,YVAD+IR组用YVAD(100μM)处理后[7],X线一次性辐照15Gy[6],辐照后继续培养24h用于后续实验。
1.2.3 细胞活力测定 取对数生长期的细胞以5 000个细胞/孔接种到96孔培养板上,每组设置6个复孔,培养过夜。处理后24h,根据制造商说明书检测细胞活力。重复实验3次。
1.2.4 Caspase-1活性分析 将达到70%~80%汇合的细胞分为对照组、IR组和YVAD+IR组。IR组采用X线一次性辐照15Gy;YVAD+IR组用YVAD(100μM)处理后[7],X线一次性辐照15Gy[6],辐照后继续培养24h,收集细胞。辐射处理小鼠后,收集对照及辐射组小鼠肠组织,根据制造商说明书检测Caspase-1活性。重复实验3次。
1.2.5 LDH释放测定 将对数生长期的细胞以5 000个细胞/孔接种到96孔培养板,每组设置3个重复孔,培养过夜。处理后24h,收集细胞培养液。根据制造商说明书检测LDH水平。重复实验3次。
1.2.6 ELISA检测IL-1β、IL-18含量 将对数生长期的细胞以5 000个细胞/孔接种到96孔培养板,每组设置3个重复孔,培养过夜,处理后24h,收集细胞培养液。辐射处理小鼠后,收集对照及辐射组小鼠血清,根据制造商说明书检测IL-1β、IL-18含量。重复实验3次。
1.2.7 蛋白质印迹分析 使用RIPA裂解液裂解处理后的小鼠肠组织与细胞,使用BCA蛋白质测定试剂盒测定总蛋白质含量水平,随后进行SDS-PAGE电泳,将凝胶中蛋白质转移至PVDF膜上,5%脱脂牛奶室温封闭1h,将膜与一抗4℃摇床孵育过夜。次日用TBST洗10min×3次,然后二抗室温孵育2h,TBST洗10min×3次,显影、成像。重复实验3次。
1.2.8 实时荧光定量PCR(qRT-PCR) 检测肠组织和HIEC中IL-6、IL-8、TNF-α、IL-1β、IL-18的mRNA水平,引物由上海生工生物公司合成(表1、2)。参照RNA提取试剂盒说明书提取各组RNA,用BIO-RAD逆转录试剂盒进行逆转录,分别将2μg的总RNA逆转录为cDNA,操作按照试剂盒说明书进行。利用BIO-RAD的SYBR-Green PCR Mix试剂盒检测mRNA表达水平,按照试剂盒说明书进行操作。重复实验3次。
表1 小鼠基因PCR引物
Table 1. PCR Primer of Mouse Genes

Gene (mouse) PrimerSequence length (bp)IL-1βForward 5′-TGAAATGCCACCTTTTGACAGTGAT-3′ 120Reverse 5′-AGCTGGATGCTCTCATCAGGA-3′ IL-18 Forward 5′-ACTTTGGCCGACTTCACTGT-3′125Reverse 5′-GGGTTCACTGGCACTTTGAT-3′β-actin Forward 5′-GGGTTCACTGGCACTTTGAT-3′ 174Reverse 5′-ATGCCACAGGATTCCATACC-3IL-6Forward 5′-GGGAAATCGTGGAAATGAGA-3′ 131Reverse 5′-TCCAGTTTGGTAGCATCCATC-3′IL-8 Forward 5′-CTAGGCATCTTCGTCCGTCC-3′200Reverse 5′-TTCACCCATGGAGCATCAGG-3′TGF-αForward 5′-GCCAACGGCATGGATCTCAA-3′181Reverse 5′-TCTTGACGGCAGAGAGGAGG-3′
TGF-α: Transforming growth factor alpha.
表2 人源基因PCR引物
Table 2. PCR Primer of Human Genes

Gene(automatic)PrimerSequence length(bp)IL-1βForward 5′-GCGGCATCCAGCTACGAATCTC-3′101Reverse 5′-AACCAGCATCTTCCTCAGCTTGTC-3′ IL-18 Forward 5′-TGGCTGCTGAACCAGTAGAAG-3′ 180Reverse 5′-GAGGCCGATTTCCTTGGTCA-3′ β-actin Forward 5′-CCTGGCACCCAGCACAAT-3′144Reverse 5′-GGGCCGGACTCGTCATAC-3IL-6Forward 5′-TTCAATGAGGAGACTTGCCT-GGTG-3′127Reverse 5′-TTGTACTCATCTGCACAGCTC TGG-3′

Gene(automatic)PrimerSequence length(bp)IL-8 Forward 5′-GGACCACACTGCGCCAACAC-3′93Reverse 5′-AACCCTCTGCACCCAGTTTTCC-3′TGF-αForward 5′-AGCTGGTGGTGCCATCAGAGG-3′ 124Reverse 5′-TGGTAGGAGACGGCGATGCG-3′
TGF-α: Transforming growth factor alpha.
1.2.9 免疫组织化学染色 将对照组和辐射组小鼠肠组织石蜡包埋、切片,脱蜡、水化,用柠檬酸缓冲液高压10分钟修复抗原,待自然冷却,30mL/L H2O2室温避光封闭15min,PBS洗涤5min×3次,山羊血清37℃封闭30min,4℃过夜孵育NLRP3抗体、Caspase-1抗体、ASC抗体。次日,PBS洗涤5min×3次,37℃孵育30min生物素化山羊抗兔IgG,PBS洗涤5min×3次,37℃孵育30min辣根过氧化酶标记链亲和素,PBS洗涤5min×3次,DAB显色,流水冲洗15min,复染苏木素1min后,流水冲洗30min,待返蓝色后,脱水封片,于显微镜下观察采集图像。
1.2.10 HE染色 将对照组和辐射组小鼠肠组织,4%多聚甲醛固定,石蜡包埋、切片,根据凯基生物HE染色试剂盒说明书进行染色,于显微镜下观察采集图像。
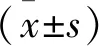
2 结 果
2.1 辐射引起肠组织形态改变
由HE染色结果可见:与对照组小鼠相比,辐射组小鼠肠组织隐窝结构破坏,炎性细胞浸润,绒毛萎缩(图1)。
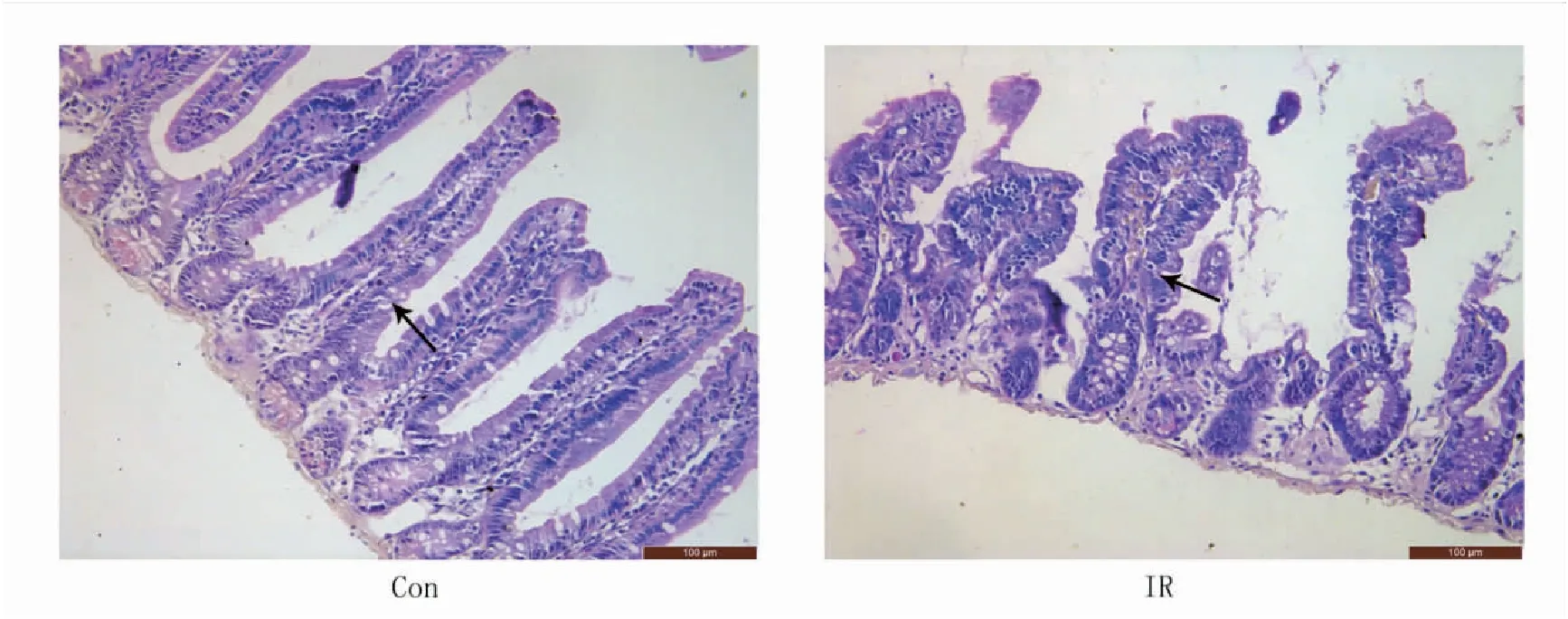
图1 小鼠肠组织病变情况(HE染色,×200)
Figure1.IntestinalTissueLesionsinMice(HEStaining,×200)
Con: The control group; IR: The ionizing radiation group.
2.2 辐射引起肠组织炎性因子的 mRNA 水平增加
与对照组小鼠相比,qRT-PCR检测结果发现,辐射组小鼠中IL-8、TNF-α、IL-6、IL-18、IL-1β的mRNA水平增高,差异具有统计学意义(P<0.05或P<0.001,图2)。
图2 辐照引起肠组织炎性因子的 mRNA 水平增加
Figure2.AnIncreaseinthemRNALevelofIntestinalInflammatoryFactorsCausedbyIrradiation
Panel A and B show the mRNA levels of IL-8, TNF-α, IL-1β, IL-18 and IL-6 in two groups detected by quantitative reverse transcriptase polymerase chain reaction. *P<0.05,**P<0.01, ***P<0.001,n=3. Con: The control group; IR: The ionizing radiation group.
2.3 辐射引起 NLRP3 激活并诱导肠组织发生细胞焦亡
免疫组化结果显示:与对照组小鼠相比,辐射引起NLRP3、Caspase-1、ASC在辐射组小鼠肠组织中表达增强(图3A)。蛋白质印迹结果显示,与对照组小鼠相比,辐射组小鼠肠组织中IL-1β、IL-18、Casp1-p20、GSDMD-N表达增强(图3B)。ELISA实验结果显示,与对照组小鼠相比,辐射组小鼠血清中IL-1β、IL-18含量明显增加,差异有统计学意义(P<0.05,图3C)。Caspase-1活性检测试验发现,辐射组小鼠肠组织中Caspase-1活性明显增强,差异有统计学意义(P<0.001,图3D)。

图3 辐照引起 NLRP3 激活并诱导肠组织发生细胞焦亡
Figure3.NLRP3ActivatedandIntestinalTissuePyroptosisInducedbyIrradiation
Panel A shows the expression of NLRP3, Caspase-1, ASC in mouse intestinal tissue (immunohistochemical staining, ×200); Panel B shows the detection of IL-1β, IL-18, GSDMD-N in mouse intestinal tissue detected by Western blotting, and N-terminal, Casp1-p20 protein level; Figure C shows the levels of IL-1β and IL-18 in serum of mice determined by enzyme-linked immunosorbent assay; Figure D shows the activity of Caspase-1 in mouse intestinal tissue. **P<0.01, ***P<0.001,n=3. Con: The control group; IR: The ionizing radiation group.
2.4 YVAD抑制辐射性细胞焦亡的发生
蛋白质印迹结果发现,与IR组细胞相比,IR+YVAD组细胞中Caspase-1、caspa1-p20、GSDMD-N、IL-1β、IL-18蛋白表达降低(图4A);Caspase-1活性检测试验显示IR+YVAD组细胞中Caspase-1活性明显低于IR组细胞,差异有统计学意义(P<0.05,图4B);ELISA实验结果显示,与IR组细胞培养液相比,IR+YVAD组细胞培养液中IL-1β、IL-18含量明显降低,差异有统计学意义(P<0.01,图4C-D)。
2.5 YVAD减轻放射性炎性损伤
与IR组细胞相比,qRT-PCR检测结果发现IR+YVAD组细胞中TNF-α、IL-18、IL-8、IL-6、IL-1β的 mRNA水平降低,差异有统计学意义(P<0.05,图5A-E)。LDH释放检测与CCK-8活性检测实验发现,与IR组细胞相比,IR+YVAD组细胞中LDH释放水平明显降低,细胞活性明显增强,差异有统计学意义(P<0.05,图5F-G)。
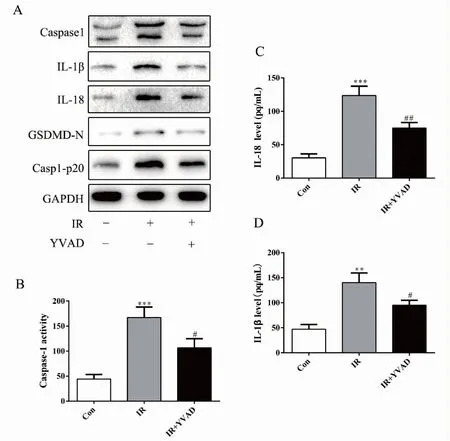
图4 YVAD抑制辐射性细胞焦亡的发生
Figure4.OccurrenceofRadioation-InducedPyroptosisInhibitedbyYVAD
Panel A shows the levels of Caspase-1, IL-1β, IL-18, GSDMD-N, and Casp1-p20 protein in each group of cells detected by Western blotting; Panel B shows the activity of Caspase-1 in each group of cells; Panel C and D show the levels of IL-1β and IL-18 in the culture medium of each group determined by enzyme-linked immunosorbent assay. The IR group and the control group, **P<0.01, ***P<0.001,n=3; the IR+YVAD group and the IR group, #P<0.05, ##P<0.01,n=3. Con: The control group; IR: The ionizing radiation group.
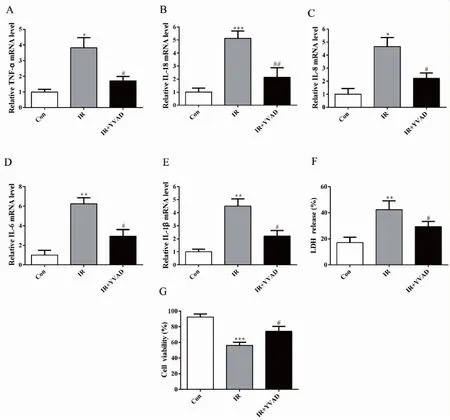
图5 YVAD减轻放射性炎性损伤
Figure5.RadiationInflammatoryInjuryReducedbyYVAD
Panel A, B, C, D, E, F, and G show the mRNA levels of TNF-α, IL-18, IL-8, IL-6, and IL-1β in each group detected by quantitative reverse transcriptase polymerase chain reaction. Panel F shows the release of LDH in each group. Panel G shows the activity level of cells in each group measured by cell counting kit-8 assay. The IR group and the control group, *P<0.05, **P<0.01, ***P<0.001,n=3; the IR+YVAD group and the IR group, #P<0.05, ##P<0.01,n=3. Con: The control group; IR: The ionizing radiation group.
3 讨 论
放疗是腹盆腔恶性肿瘤患者治疗的重要组成部分,对于原发、复发或转移病灶均有确切疗效[1]。然而,放疗在损伤肿瘤细胞的同时,不可避免会损害机体正常细胞,进而引发多种并发症[8-9]。据报道,世界上每年接受腹、盆部放疗的肿瘤患者高达50万,其中约70%~80%的患者会出现急性肠道症状,严重影响患者治疗进展和生存质量[3,10-11]。因此,迫切需要更好地理解放射性肠损伤的疾病机制,以便为寻求新的治疗、预防方法提供新的见解。
RE是腹部或盆腔照射后的一种常见并发症,可发生于任何节段肠道,约有5%~17%的发生率[3,11]。有研究发现RE本质上是一种炎症,在放射性肠损伤过程中有多个炎性相关基因被上调,并通过不断募集炎症细胞,导致细胞内或细胞间炎症反应被不断放大[12-14]。本研究通过X射线一次性辐射小鼠腹部15Gy模拟放射性肠损伤,实验结果显示,辐射组小鼠肠组织中炎性细胞浸润明显,IL-6等炎性因子的mRNA水平明显升高。这些结果,提示辐射导致的放射性肠损伤的主要表现为炎性损伤,RE动物模型构建成功[5]。
细胞焦亡是近期发现的一种高度依赖于Caspase-1活化的促炎程序性细胞死亡方式[15-16]。多项研究发现,NLRP3炎性小体诱导的细胞焦亡与痛风 、阿尔茨海默病等多种炎症相关疾病的进展关系密切[17-20]。 因此,我们进一步检测细胞焦亡相关标志物在肠组织中的表达,探讨RE的炎性反应过程是否有NLRP3炎性体诱导的Caspase-1依赖性细胞焦亡参与。实验结果发现,辐射组小鼠肠组织中NLRP3炎性体与GSDMD-N、Caspsae1-p20等焦亡标志蛋白表达明显增加;Caspase-1活性增强;且辐射组小鼠血清中的IL-18、IL-1β含量水平均高于未照射的正常小鼠,提示NLRP3炎性体诱导的Caspase-1依赖性细胞焦亡可能参与放射性肠损伤的发生、发展过程。
由于细胞焦亡是一种炎症性细胞死亡方式,它有通过释放炎性因子促进清除病原体的作用,但也有研究表明,发生肿胀破裂的焦亡细胞,继而会释放内容物引发级联放大的炎症反应,可能会加重疾病进展[21-22]。为了进一步明确Caspase-1信号通路介导的细胞焦亡在RE中的作用,我们进行了体外细胞相关实验。实验结果发现,IR+YVAD组细胞中的焦亡水平、IL-6等炎性因子的mRNA水平及LDH释放水平明显低于IR组细胞,细胞活力明显高于IR组细胞,提示抑制细胞焦亡的发生可以减弱辐射诱导的炎性反应,从而减轻放射性损伤。
综上,本实验成功建立了RE动物模型,并检测了辐射后肠组织中NLRP3炎性小体的激活情况及Caspsae1-p20等焦亡相关指标,得出NLRP3诱导的Caspase-1依赖性细胞焦亡参与了RE的发病。接着我们通过体外细胞实验,检测YVAD处理后辐射的焦亡水平及炎性损伤情况,得出Caspase-1信号通路介导的细胞焦亡可能在RE发生发展中具有一定的致病作用。本研究结果为揭示RE这一复杂疾病的发病机制及寻求有效途径预防治疗提供了一定的理论基础。 但NLRP3炎性小体是被怎样的途径激活及如何抑制细胞焦亡的具体下游成分来达到治疗RE的目的,仍需深一步的研究。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

