脂蛋白(a)水平与主动脉瓣狭窄及冠状动脉疾病发生风险的相关性研究
钙化性主动脉瓣疾病是一类常见的心脏瓣膜疾病。近年来的一系列研究表明,年龄、瓣膜结构、代谢及基因等多方面因素共同作用导致主动脉瓣的钙化,最终造成主动脉瓣狭窄(aortic valve stenosis,AVS)和(或)主动脉瓣返流[1]。既往研究发现,在早期的AVS中观察到与动脉粥样硬化类似的病理改变,特别是脂蛋白a [Lp(a)]可参与瓣膜受损部位脂质沉积、瓣膜细胞异常成骨样分化等一系列病理过程,提示Lp(a)的异常在这类疾病的发生发展中具有十分重要的作用[2]。因此,临床上进一步明确其发生的危险因素,并探讨Lp(a)与其发生的相关性是十分必要的。此外,在AVS人群伴随或不伴随临床冠状动脉疾病(CAD)表现的情况下,Lp(a)与AVS的独立相关性数据亦非常有限。该研究旨在通过有无临床CAD表现分层研究Lp(a)与AVS的条件相关性,为制定有效的临床干预方案提供参考。
1 资料与方法
1.1 研究对象和分组 回顾性纳入2014~2017年于南京医科大学第一附属医院心脏内科或心脏外科门诊及病房确诊的215例重度AVS病人,另纳入215例2017年1~12月曾在心脏内科或心脏外科门诊及病房接受治疗且已排除AVS的病人作为对照组,对照组病人满足与AVS组年龄和性别的配对。AVS组病人符合国际心脏病学会和WHO关于AVS的诊断标准。AVS定义为经胸超声心动图提示平均主动脉瓣压力阶差≥40 mmHg或经胸食管超声心动图计算主动脉瓣有效瓣口面积<1cm2,依据临床表现、超声心动图确诊有无AVS。对照组病人住院原因是异质性的,包括CAD、心力衰竭、其他结构性心脏病或心律失常。其中CAD定义为稳定型心绞痛、不稳定型心绞痛、非ST段抬高性心肌梗死和ST段抬高性心肌梗死,但均已排除AVS诊断。所有病人在门诊或住院期间均接受了超声心动图和Lp(a)水平的评估。
1.2 方法 收集所有病人的年龄、性别、收缩压、舒张压,是否伴有高血压、糖尿病、冠心病,是否接受了降脂治疗等临床资料;辅助检查包括血浆Lp(a)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖和糖化血红蛋白水平等。高血压定义为收缩压>140 mmHg和(或)舒张压>90 mmHg,或服用降压药。糖尿病定义基于空腹血糖水平、糖化血红蛋白水平和接受药物治疗。如果病人在住院前或住院期间接受过经皮冠状动脉介入术或搭桥术,则被定义为有临床CAD表现。

2 结果
2.1 病人基本情况 该研究共纳入了430例病人,总体平均年龄(65±5)岁,男性比例为52%。Lp(a)为[21.5(11.1, 44.8)]mg/dL。AVS组和对照组病人的年龄和性别分布相同(由于匹配),但对照组高血压、冠心病以及接受降脂治疗的比例明显高于AVS组,而AVS组HDL-C水平以及合并糖尿病比例明显高于对照组,差异有统计学意义(P<0.05)。而Lp(a)在2组间比较无差异统计学意义。见表1。
2.2 Lp(a)水平在不同分组方法中的比较分析 在430例病人中,有临床CAD表现的有171例(AVS组39例,对照组132例)。有临床表现的CAD病人的Lp(a)水平明显高于无临床CAD表现的病人[CAD组: 26.9(13.1, 52.6) mg/dL,无CAD组: 18.8 (9.8, 39.5) mg/dL,P=0.002]。根据临床CAD表现分层时,Lp(a)水平在有无AVS的病人中并没有显著差异[CAD组: 30.1 (15.2,51.7)mg/dL vs 25.8(13.0,55.3)mg/dL,P=0.795,无CAD组: 19.4(9.9,39.3)mg/dL vs 17.1(8.9,42.2)mg/dL,P=0.950]。相反,在根据有无AVS分层时,Lp(a)水平在有临床CAD表现组均明显高于无临床CAD表现组 [AVS组: 30.1(15.2,51.7)mg/dl vs 19.4(9.9,39.3)mg/dL,P=0.032,对照组: 25.8(13.0,55.3)mg/dL vs 17.1(8.9,42.2)mg/dL,P=0.04]。
2.3 Lp(a)与AVS及临床CAD发生的相关性分析 在回归分析中,未调整模型[OR(95%CI): 0.99 (0.99~1.00),P=0.06]和风险因素调整模型[OR(95%CI): 1.00 (0.99~1.01),P=0.51]中Lp(a)水平与AVS均无明显相关性。在未调整模型[OR(95%CI): 1.01 (1.00~1.02),P=0.005]和风险因素调整模型[OR(95%CI): 1.01 (1.00~1.02),P=0.006]中Lp(a)水平与临床CAD发生均有显著统计学关联。此外,以CAD和(或)AVS调整模型并没有改变上述结果[对于AVS:OR(95%CI): 1.00 (0.99~1.01),P=0.65;对于CAD:OR(95%CI): 1.01(1.00~1.02),P=0.03]。见表2。
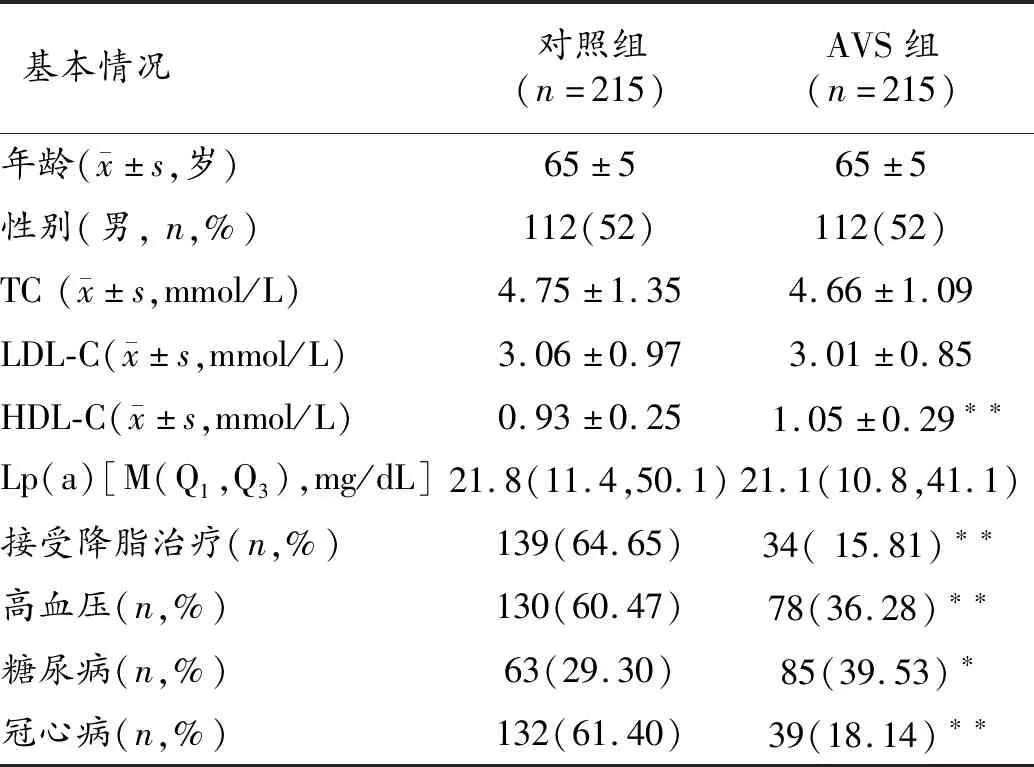
表1 对照组和AVS组病人一般资料比较
注:与对照组比较,*P<0.05,**P<0.01

表2 Lp(a)与AVS及临床CAD表现相关性的Logistic回归分析
3 讨论
钙化性主动脉瓣疾病是一种进展性疾病,临床上最常见的表现为AVS,其发病率随着年龄呈指数级增长。有研究对家族性高胆固醇血症病人进行分析,发现血脂异常可能引起主动脉瓣疾病的发生[3-4]。早期临床研究发现,有一些促进临床动脉粥样硬化发展的危险因素,包括男性、高血压、糖尿病、Lp(a) 水平异常以及LDL-C水平异常等,同样会增加CAD 的发病风险[5]。然而SEAS 研究以及ASTRONOMER研究均发现降脂治疗并不能延缓轻度或者中度AVS 的疾病进展[6-7]。目前对于血脂在钙化性主动脉瓣疾病中的作用多集中于Lp(a),欧洲一项大规模的临床研究在随访了11年后发现,LPA基因变异可以调控Lp(a)水平导致AVS的发生[8]。但即便如此,对于Lp(a)和AVS发生的相关性研究仍然存在很多的争议。
从我们的研究中发现,2组病人按年龄和性别匹配后,对照组高血压、冠心病以及接受降脂治疗的发生率明显高于AVS组,AVS组HDL-C水平以及合并糖尿病比例明显高于对照组,而Lp(a)在2组间比较差异无统计学意义。相反,有临床表现的CAD病人Lp(a)水平明显高于无临床CAD表现的病人。进一步分层分析后发现,无论在有CAD还是无CAD临床表现的人群,Lp(a)水平与AVS均不相关,而无论有无AVS,Lp(a)水平在有临床表现的CAD病人中均明显高于无临床表现的CAD病人,可以区分有无CAD的发生。这和Mahabadi等[9]发现在年龄≥70岁的人群中Lp(a)水平与主动脉瓣钙化和临床AVS无相关性这一结论是一致的。同样,Capoulade等[10]发现,与年轻人群AVS进展密切相关的代谢综合征在57岁以上人群中与AVS的发生并无明显相关性。总体而言,年龄的增长和二叶瓣是导致AVS进展的2个主要危险因素,而男性、吸烟、高血压、肥胖、代谢综合征、继发性甲状旁腺功能亢进、肾功能衰竭和Lp(a)升高等因素与AVS进展加快有关[11]。然而,随着年龄的增长,混杂因素的影响变得不那么重要。Ljungberg等[12]在最近的一项研究中,对Lp(a)水平与AVS发生的相关性进行了长达10年的前瞻性调查研究。虽然Lp(a)水平可以预测伴发CAD病人的AVS,但在无伴发CAD的病人中没有发现两者的相关性。这一结果在年龄>60岁(平均年龄67.2岁)的病人中被观察到。我们的发现与这一队列病人中的发现部分一致,观察到Lp(a)水平仅与CAD相关,而与AVS无关。
该研究的局限性包括这是一项回顾性研究,同时受限于样本量小、选择偏倚等限制因素,部分AVS病人可能未监测Lp(a)值,因此在纳入研究时被排除。虽然观察结果在描述性统计、亚组分析、未调整的模型以及风险因素调整模型中保持稳定,但不能排除未测量的混杂因素影响了结果,这是观察性研究固有的局限性。考虑到该研究的回顾性,因此无法评估基因与AVS发生进展的相关性。最后,临床CAD表现仅从已知的临床诊断进行评估,而非狭窄性CAD表现在本研究中未进行评估。虽然我们队列中大部分AVS病人都接受了有创冠状动脉造影检查作为评估的一部分,但并非所有非AVS病人都接受了冠状动脉造影。
综上所述,在年龄>60岁(平均年龄67.2岁)的人群中,Lp(a)与临床CAD的发生相关,但与AVS无相关性。在未调整的模型以及风险因素调整模型中其结果均保持稳定。因此,未来可以围绕以下2个方向开展更为深入的研究:(1)筛选Lp(a) 介导的LPA基因座及异常易感基因,针对易感人群进行早期精确风险评估;(2)研发更为精确敏感的影像学检查手段,做到早发现、早诊断、早干预,并对干预效果进行研究。

