基于Fe@Fe3O4诊断和治疗平台的研究进展
陶诚 杨广令 杨仕平


摘 要: Fe@Fe3O4纳米粒子(NPs)由于Fe 核的存在具有很大的饱和磁化率和横向弛豫率,能够表现出比Fe3O4 NPs更好的磁共振成像(MRI)和光/磁热治疗效果,并且由于其具备光声和磁共振(MR)造影功能,可引导Fe@Fe3O4 NPs对肿瘤进行治疗.该材料因生物相容性好、成像和治疗方式多元化等优点而受到越来越多的关注.通过介绍和总结Fe@Fe3O4 NPs的几种成像模式和治疗方式,描述了目前该材料的最新研究进展,以深入了解Fe@Fe3O4 NPs在癌癥治疗中的潜在应用.
关键词: Fe@Fe3O4纳米粒子(NPs); 磁共振成像(MRI); 光声成像; 光热疗法(PTT); 磁热治疗
中图分类号: O 614.24 文献标志码: A 文章编号: 10005137(2019)04044911
Abstract: Due to the large saturation magnetic susceptibility and lateral relaxation rate of the Fe nucleus,the Fe@Fe3O4 nanoparticles(NPs) can exhibit better magnetic resonance imaging(MRI) and photo/magnetothermal treatment than the Fe3O4 NPs,and because of its photoacoustic and MRI capabilities,the Fe@Fe3O4 NPs can be directed to treat the tumor.The material has received more and more attention due to its advantages of good biocompatibility,diversification of imaging and treatment methods.This paper introduces and summarizes several imaging modes and treatment methods of Fe@Fe3O4 NPs to describe the latest research progress of this material,so that everyone can deeply understand the potential application of Fe@Fe3O4 NPs in cancer treatment.
Key words: Fe@Fe3O4 nanoparticles(NPs); magnetic resonance imaging(MRI); photoacoustic imaging; photothermal therapy(PTT); magnetocaloric therapy
0 前 言
癌症是对人类生命和健康的最大威胁之一[1].为了制定有效和全面的治疗策略来应对这种严重疾病,研究人员在过去的几十年中一直致力于开发诊断和治疗技术[2].早期诊断、术中定位和术后影像学检查是提高肿瘤治疗疗效的重要因素.然而,传统的成像技术仅限于观察手术后肿瘤组织,并存在一定的滞后性.因此,跟踪肿瘤的准确定位,在成像指导下实现有效治疗是肿瘤研究的热点之一.另一方面,传统治疗,包括手术、光热疗法(PTT)、化学疗法和放射疗法(RT)有许多缺点.例如,总是观察到非特异性杀伤作用、RT中的抗性效应、细胞毒性作用以及化学治疗药物在化学疗法中的其他副作用.鉴于此,探索新的治疗方法并整合其优势以实现协同医疗效果具有重要意义.纳米技术的出现为解决上述问题开辟了新的可能性[3].近年来,纳米技术的蓬勃发展带动了纳米医学研究的大发展.已有各种关于纳米药物的研究试图解决传统医学所遇到的生物医学挑战[4],这些药物都是基于不同的纳米材料构建的,例如聚合物纳米颗粒(NP)、脂质体、无机NP等.由于它们独特的物理化学性质,各种有机或无机纳米材料可以与多种治疗和成像造影剂相结合,作为治疗诊断的理想平台.基于“一体化”方法的治疗平台旨在及早发现疾病,优化治疗,并及时监测治疗反应,从而改善患者的预后和安全性[5].
磁共振成像(MRI)是利用生物体的不同组织在强磁场影响下产生不同的共振信号,经过图像重建而形成的一种成像技术,该技术能够实现无损检测,具有很高的组织分辨率[6].近年来,MRI技术在肿瘤的诊断中得到了广泛的应用,作为一种新型影像手段,其具有对比度高、对人体无害、可以从任意方位断层等诸多优势,因此利用MRI技术可以实现对早期肿瘤的有效诊断[7].目前,大部分的MRI检查都是增强检查,即需要利用造影剂实现磁共振增强,达到有效诊断的目的.人体中含有约65%以上的水,且不同的组织器官之间含水量也往往不同,当组织发生病变时,含水量亦会随之发生变化,MRI就是利用了这一特点,凭借不同组织的不同含水量在外加磁场的作用下产生不同的射频信号,再经过处理后即可得到图像[8].而仅凭体内含水量的略微变化,往往不足以产生足够的信号来判断组织是否发生病变,故而急需一种加强病变部位信号的手段.MRI造影剂就是解决这一问题的关键所在,其可以引起病变部位与正常组织间的成像效果的明显差异,从而达到有效诊断的目的.造影剂通常可分为T1造影剂和T2造影剂,T1造影剂可以增加T1加权成像的信号强度,使图像变亮,而T2造影剂则会降低T2加权成像的信号强度,导致图像变暗[9].
由于临床上广泛应用的以钆配合物为代表的顺磁性造影剂的稳定性和神经毒性仍然存在一定的问题,基于磁性NPs如Fe3O4、铁酸盐、合金、氧化锰(MnO 或者Mn3O4)、稀土复合物等的磁共振(MR)造影剂是研究的热点[10].磁性NPs具有许多独特的特征,如高生物安全性、易合成,以及突出的物理化学性质.这些特征引起了研究人员的注意,开发了多种多功能磁性NPs,用于众多实际医学应用.例如,磁性NPs已被用作成像造影剂、放射增敏剂、光热处理剂等[11].然而,由单一成分组成的磁性颗粒不能完全满足肿瘤诊断和治疗的需要.因此,迫切需要开发基于磁性NPs的混合纳米材料,从而实现更大的多功能性.最近,磁性混合纳米颗粒(MHN)已经被广泛开发并用于肿瘤的诊断和治疗研究.其中,Fe@Fe3O4 NPs由于Fe 核的存在具有很大的饱和磁化率和横向弛豫率,能够表现出比Fe3O4 NPs更好的MRI和光/磁热治疗效果,是最近发展起来的一种优良的诊疗试剂.本文作者主要综述了基于Fe@Fe3O4纳米诊疗平台的最新研究进展,包括材料的设计、合成,以及在肿瘤诊断和治疗中的应用.
1 基于Fe@Fe3O4的影像介导的PTT
1.1 MRI介导的PTT
1.1.1 用于磁性靶向MRI和近红外PTT的铁/氧化铁核壳NPs
近红外激光诱导PTT已成为癌症治疗中吸引人的策略.使用近红外光作为高度正交的外部刺激,允许肿瘤区域中的空间和时间暴露,以使治疗功效最大化同时使副作用最小化.典型的PTT大于等于50 nm的尺寸对于产生高光热转换效率是必不可少的.不幸的是,大尺寸限制了它们在体内生物学研究中的应用.此外,与金NPs一样,其他贵金属基的光热剂(PTA),包括锗(Ge)NPs和钯(Pd)基纳米片,表现出强烈的近红外光吸收.然而,从长远来看,这些贵金属的不确定毒性阻碍了它们的临床研究.因此,迫切需要寻找替代性PTA,使之最终成为临床上有用的癌症治疗工具.此外,选择性靶向PTA的能力对于进一步增强PTT功效和减少副作用非常重要.
由于铁的良好生物相容性,Fe@Fe3O4 NPs已应用于MRI、诊断磁共振生物传感器和磁热疗.开发具有良好的稳定性、低毒性、高靶向能力,以及良好的光热转换效率的PTA是体内近红外PTT的先决条件.ZHOU等[12]报道了容易获得的聚乙二醇化Fe@Fe3O4 NPs,它具有特性靶向、PTT和成像三重功能.与金(Au)纳米棒相比,它们具有相同的光热转换效率(约为20%)和更高的光热稳定性.它们还显示出高磁化值和横向弛豫,适用于磁靶向MRI.值得注意的是,NPs在肿瘤中固有的高光热转换效率和选择性磁靶向作用,能在体外和体内高效消融癌细胞中起到协同作用.
图1(a)为磁靶向MRI和近红外热疗法示意图.聚乙二醇(PEG)化Fe@Fe3O4 NPs表现出从紫外到近红外区域的宽吸收,吸收光谱如图1(b)所示.通过照射808 nm近红外激光(0.38 W·cm-2)500 s来评估不同浓度的光热效应,如图1(c)所示.根据文献报道的计算方法,Fe@Fe3O4 NPs的光热转换效率为20.3%,与相似条件下的Au纳米棒相近(24.4%).NPs的吸收光谱和形态非常稳定,如图1(d)所示.经过5次激光开/关循环后,NPs的温度增加没有明显的变化,如图1(e)所示.这些数据均表明PEG化的Fe@Fe3O4 NPs具有高的光热转换效率和光热稳定性.PEG化Fe@Fe3O4NPs的优异光热性能使它们具备作为癌症PTA的可能性.因此,有必要评估NPs的体内毒性.健康ICR大鼠静脉内注射剂量为1.46 g·kg -1的PEG化Fe@Fe3O4 NPs.一个月后,处死大鼠进行血液和组织学分析,切除心脏、肝脏、肺脏、肾脏和脾脏等器官,然后用苏木精-伊红染色法(H&E)染色,如图1(f)所示.此外,与静脉注射后对照组的血液指數相比,没有观察到其他血液参数的明显差异,如图1(g)所示.这些数据清楚地表明,在实验条件下,PEG化的Fe@Fe3O4 NPs在体内具有非常低的毒理学.
为了证实PEG化Fe@Fe3O4 NPs在体内的磁性靶向能力,在磁性靶向组中,给携带HeLa肿瘤的裸鼠静脉注射NPs,然后将NdFeB磁体(0.5 T)置于肿瘤旁12 h.首先,如使用3.0T系统的体内T2加权MRI,如图1(i)所示,磁性靶向组中肿瘤的T2加权信号强度减少了51%,而对照组2中肿瘤的T2加权信号强度仅减少17%.肿瘤的温度由红外热像仪测定.在磁性靶向组中,肿瘤内的温度在10 min内升高11.6 ℃.这些结果均表明体内PEG化的Fe@Fe3O4 NPs在外部磁场下应具有优异的磁性靶向作用,这有利于体内癌细胞的磁靶向光热处理.
总之,开发PEG化Fe@Fe3O4 NPs作为一种新型三功能PTT剂,具有独特的磁靶向、近红外PTT和MRI,可有效消融肿瘤.固有的高光热转换效率和NP的选择性磁靶向作用以合法的方式发挥作用,并且这些特征已经在体外和体内研究中转化为对肿瘤的高杀伤效率.结合其易得性、高光热稳定性和低毒性,PEG化Fe@Fe3O4 NPs作为PTA,具有很好的临床应用前景.
1.1.2 扩增细胞凋亡归巢纳米平台用于肿瘤治疗诊断
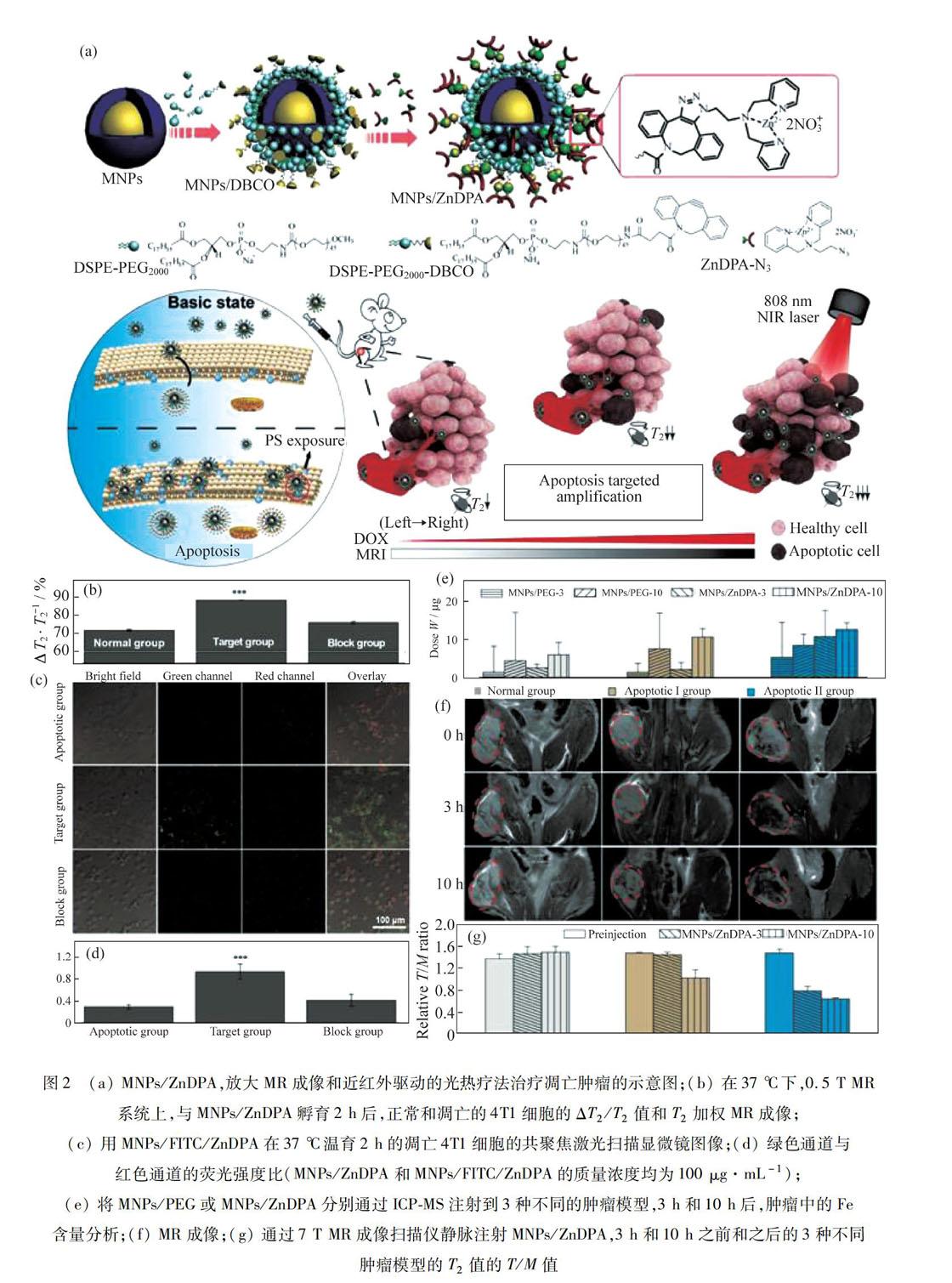
纳米医学已经显著影响了癌症治疗学.然而,其治疗效率受到纳米材料渗透性有限,保留(EPR)效应以及肿瘤细胞受体的密度、特异性不足等限制.基于此,ZHAO等[13]开发了一种基于锌(II)二苯胺(ZnDPA)缀合的Fe@Fe3O4 NPs(MNPs/ZnDPA)的凋亡归巢纳米平台,其展示了放大的磁共振信号和PTT.在由阿霉素构建的凋亡异种移植模型中,由于ZnDPA与凋亡癌细胞外表面上磷脂酰丝氨酸(PS)的高度亲和性,肿瘤/肌肉比例增加,MNPs/ZnDPA的积累值增加了2倍.与正常异种移植模型相比,T2值降低至50%.在凋亡异种移植模型中,放大PTT通过相对肿瘤体积和末端脱氧核苷酸转移酶介导的dUTP-生物素缺口末端标记染色的变化来确认.该纳米平台可以提高NPs的靶向效率,增强肿瘤靶向治疗诊断.
一般来说,纳米材料的被动肿瘤靶向性是通过增强的渗透性和EPR效应实现的,原因是血管系统增多,血管结构缺陷和肿瘤淋巴引流受损,因此,对不同肿瘤模型的有限EPR效应降低了其有效性[14].然而,肿瘤细胞受体的密度和特异性不足仍然限制了肿瘤靶向性的效率[15].作为癌症治疗中广为接受的靶点,PS通常位于正常细胞的内细胞膜上,易位至凋亡细胞表面,其表达可进一步升高,作为在癌症治疗期间对增强细胞凋亡的反应.因此,凋亡依赖性PS提供了提高NPs靶向效率的机会,并提高肿瘤治疗诊断的准确性[16].最近,由于能量的最小衰减和对健康组织的不期望的热损伤,PTT在癌症治疗领域引起了极大的兴趣.许多新型NPs PTT已经开发出来[17].
根据上述原理,通过抗癌药物多柔比星(DOX)上调肿瘤的凋亡程度,从而提高肿瘤中PS的含量.上调的PS被用作受体以改善凋亡归巢NPs的靶向功效.药物诱导的PS通常被用作细胞凋亡的生物标志物,然而,这种策略从未被用于扩大肿瘤治疗诊断的效率.在此,构建了MNPs/ZnDPA,其中ZnDPA与PS具有高亲和力[18],Fe@Fe3O4NPs呈现高横向弛豫[19].在具有不同PS表达水平的凋亡4T1异种移植模型中详细研究了它们对体内肿瘤的MNPs/ZnDPA、MR信号和PTT的积累的扩增.
图2(a)为MNPs/ZnDPA,放大MR成像和近红外驱动的光热疗法治疗凋亡肿瘤的示意图.考虑到Fe@Fe3O4NPs的高横向弛豫,评估MNPs/ZnDPA的凋亡靶向性质,通过0.5 T MR系统测量DOX诱导的正常和凋亡4T1细胞的T2值,分别与MNPs/ZnDPA一起孵育2 h.孵育后,凋亡的4T1细胞(约为88%)显示出比正常4T1细胞更高的ΔT2/T2值(约为71%),如图2(b)所示.凋亡4T1细胞仅显示相对低的绿色荧光信号.绿色通道与红色通道的荧光强度比仅为0.30左右.为了验证MNPs/ZnDPA的凋亡靶向性质,在MNP表面上标记异硫氰酸荧光素(FITC),用MNPs/FITC/ZnDPA表示.形成鲜明对比的是,在凋亡的4T1细胞与MNPs/FITC/ZnDPA孵育后,观察到强烈的绿色荧光信号.所有结果证实MNPs/ZnDPA表现出对凋亡细胞的优异靶向性质.它们在体内肿瘤的积累和MR成像的扩增,如图2(c)和2(d)所示.静脉注射MNPs/ZnDPA 3 h后,正常、凋亡I和凋亡II组的每克肿瘤的Fe注射量分别为(2.6±1.0) μg,(2.2±1.7) μg和(1.0±6.8) μg,如图2(e)所示.如图2(f)所示,随着细胞凋亡程度的增加,肿瘤的MR图像变得更暗.如图2(g)所示,在注射后10 h,正常组至凋亡I再至凋亡II组的T2 MR肿瘤-肌肉(T/M)比值,从1.51±0.10降至1.03±0.14再至0.64±0.02,表明随着PS表达水平的增加,体内肿瘤的MR信号的扩增.所有数据均表明,随着PS表达水平的增加,MNPs/ZnDPA在肿瘤中表现出优异的扩增凋亡靶向作用.
ZHOU等[13]通过菌株促进的点击化学成功地开发了ZnDPA结合的Fe@Fe3O4 NPs.由于ZnDPA和PS在凋亡的癌细胞外细胞表面具有高亲和力,MNPs/ZnDPA在肿瘤中表现出优异的扩增凋亡靶向MR成像,具有不同的凋亡程度.由于扩增了肿瘤中细胞凋亡的特性,MNPs/ZnDPA可以作为一种纳米治疗剂,用于体内增强的PTT.ZHOU等[13]的工作为制备临床转化的有效治疗剂提供了重要的方法.
1.2 MRI/SPECT双模式介导的PTT
随着个性化医疗的发展,利用不同分子成像技术相结合的多模态成像已经在临床诊断中得到广泛应用,克服了单一成像模式的局限性.在生物医学成像技术中,MR成像具有最高的空间分辨率和软组织对比度,但显示出有限的灵敏度.单光子发射计算机断层成像(SPECT)成像高度敏感,但空间分辨率低,缺乏解剖信息.它已被常规应用于活体受试者的定量體内监测.MR和SPECT成像的组合可实现高灵敏度和高分辨率的互补,使体内可视化影像更准确[20-24].使用MR /SPECT造影剂应通过增强癌组织和正常组织之间的对比来帮助更准确地检测肿瘤,特别是在癌症发展的早期阶段[25].一般而言,PEG化NPs策略的使用可以通过在一定程度上增强体内成像、治疗的渗透性和EPR效应来有效靶向肿瘤[26].开发一种将诊断和治疗结合起来的多功能纳米平台,可实现有效的肾脏清除和单核吞噬细胞系统(MPS)器官的低积累.
由于良好的生物相容性、高磁化值和高光热转换效率,PEG化铁基NPs已被应用于高灵敏度、近红外PTT和磁热疗的MR成像.迄今为止,没有研究关注Fe@Fe3O4 NPs的药代动力学和生物分布.WANG等[19]开发了125Ic(RGDyK)肽缀合的PEG化Fe@Fe3O4 NPs(125IRGDPEGMNP),以获得靶向肿瘤的多功能纳米治疗剂.在MR/SPECT成像的指导下取得了优异的靶向光热疗效果.
图3(a)为MRI/SPECT双模式介导的光热治疗示意图.为了研究RGDPEGMNP的长期体内毒性,向健康ICR小鼠静脉内注射RGDPEGMNP盐水溶液.分别在24 h和30 d时,收集小鼠血液和器官,用于血液分析和组织学检查.通过H&E染色对器官切片进行染色.与对照组相比,器官仍然保持与实验组相似的形态,如图3(b)所示.肝功能和肾功能均保持正常水平,表明对肝脏和肾脏没有明显毒性,如图3(c)所示.实验结果清楚地证明了RGDPEGMNP在体内具有非常低的毒性.受到Fe@Fe3O4NPs的良好横向弛豫特性的鼓舞,在静脉注射后,对体内进行了T2加权靶向MR成像.在7 T MR成像扫描仪上从携带U87MG肿瘤的小鼠中获得RGDPEGMNP,如图3(d)所示.在注射后6 h,与注射前相比,肿瘤的ΔT2/T2值增加约50.1%,如图3(e)所示.然而,对于阻断组,肿瘤中的放射性信号在48 h内几乎检测不到,如图3(f)所示.这些结果证明125IRGDPEGMNP通过整联蛋白αvβ3-受体介导的内吞作用进入具有特异性靶向性质的肿瘤.在体外PTT结果的基础上,进行光热成像以测量肿瘤中的温度.如图3(g)所示,肿瘤的温度升高约8.2 ℃.对于对照组,给小鼠静脉内注射盐水溶液,并且在相同条件下肿瘤的温度仅增加1.7 ℃左右.该结果进一步证实了RGDPEGMNP的靶向性质,并且对于之后体内光热治疗是有益的.
通过使用它们良好的横向弛豫和放射性,125IRGDPEGMNP已被开发用于体内肿瘤的MR和SPECT成像.此外,由于高光热转换效率,NPs可以作为MR/SPECT成像的多功能纳米治疗剂,由体内高效PTT引导.WANG等[19]的工作将来成为临床转化的新型治疗剂提供了一种可行的方法.
2 基于Fe@Fe3O4的影像介导的磁热治疗
在一个系统中实现治疗和成像功能的治疗诊断学正在成为个性化医疗的一个有前途的范例.通常,治疗诊断平台集成了成像和治疗.然而,构造这些平台通常需要合成多个步骤,并且需要额外的成本.它们的降解通常很慢,生物分布和药代动力学不均匀.为了克服这些挑战,已经开发了一些基于单一材料的治疗诊断纳米平台.值得注意的是,大多数报道的基于单一材料的治疗诊断剂都集中在光学驱动的肿瘤治疗上,其临床转化受到光线组织穿透不良的限制.
最近,已經开发出多种纳米材料用于各种生物医学应用,例如药物递送、生物催化剂,以及分子传感和细胞内纳米载体.Fe@Fe3O4NPs的多功能性为构建基于单一材料的治疗剂提供了固有的优势.首先,它们在交变磁场(AMF)下的磁热疗特性可用于无限组织穿透深度的治疗.另外,这些Fe@Fe3O4NPs可以是光声(PA)活性的,能够在治疗过程中对它们进行成像.利用低成像信号散射和PA成像在组织中的高分辨率/灵敏度,PA成像和磁性高温的组合可以提供最有前景的治疗技术,它具有高灵敏度和对肿瘤的无限穿透深度.基于此,ZHOU等 [27]探索了RGDPEGMNP在PA引导的磁热疗领域中对体内肿瘤的诊疗应用.通过整合素αvβ3蛋白和c(RGDyK)肽之间的特异性相互作用,在U87MG胶质母细胞瘤异种移植模型中通过PA成像证实了RGDPEGMNP的高效体内肿瘤靶向能力,并且极好地证明了靶向磁热疗的可行性.
图4(a)为RGDPEGMNP和PA引导的体内磁热治疗的示意图.受益于PA成像对体内诊断的优势和Fe@Fe3O4 NPs的优异PA特性,在胶质母细胞瘤异种移植模型中进行了RGDPEGMNP的靶向PA成像.在静脉内施用量为40 mg·kg-1的RGDPEGMNP后,记录注射后不同时间点的光声图像,如图4(b)所示.与预注射相比,靶向组的PA信号强度在注射6 h后,光声信号强度增强了2.2倍,如图4(c)所示.这些结果表明RGDPEGMNPs在体内具有优异的PA成像能力,并且通过整合素αvβ3-受体介导的胞吞作用具有特异性靶向特性而深深地嵌入肿瘤中.基于磁热疗特性和体内PA成像的结果,在胶质母细胞瘤异种移植模型中进行体内靶向磁热疗,监测肿瘤大小以评估靶向磁热疗的效率.盐水组、RGDPEGMNP组和生理盐水+AMF组第15天相对肿瘤体积大约分别是第1天的13.7,8.5和10.8倍,如图4(d)所示.如图4(f)所示,在磁热疗处理后观察到肿瘤的显著宏观变化.值得一提的是,在磁热疗15 d后,没有观察到明显的体重变化和小鼠的明显异常行为,这表明磁热疗期间的副作用低.为了进一步评估磁热疗效率,提取肿瘤并进行TUNEL,H&E和HSP70染色.与3个对照组相比,TUNEL染色显示磁性高温治疗组中的凋亡肿瘤细胞被广泛染成棕色,如图4(g)所示.在磁热疗组中观察到(50.7±0.3)%TUNEL阳性细胞,如图4(h)所示.这些结果表明在如此短的治疗期内具有显著的癌症治疗效果.同样,根据H&E染色的结果,在磁热疗组中明显观察到核碎裂和收缩,如图4(g)所示.如图4(h)所示,在RGDPEGMNP和盐水+ AMF组中HSP70的免疫反应性分别为267.7±45.2和244.3±30.7,在AMF组中HSP70的免疫反应性为280.3±53.2.所有这些证据表明RGDPEGMNP是高效靶向磁热疗的潜在试剂.
RGDPEGMNP被开发为用于体内高效PA成像引导的磁热疗法的新型纳米治疗剂.Fe@Fe3O4 NPs具有中等的近红外吸光度和高磁化强度.受益于这些出色的性能,基于Fe@Fe3O4的纳米平台显示出增强的PA成像和有效的磁热疗.由于c(RGDyK)肽的靶向作用,RGDPEGMNP呈现出优异的肿瘤消融.这项工作突出了Fe@Fe3O4 NPs在成像指导癌症治疗的多功能纳米平台方面的巨大潜力.
3 总结与展望
本文总结了Fe@Fe3O4 NPs的性质,并介绍了其在成像和治疗上的一些应用,展示了该材料很好的应用前景.然而,这并不意味着该材料已经被完全开发,它具备很大的潜力,需要继续挖掘.
参考文献:
[1] PAN Y,XUE P,LIU S,et al.Metalbased hybrid nanoparticles as radiosensitizers in cancer therapy [J].Colloid and Interface Science Communications,2018,23:45-51.
[2] DING M,SONG N,He X,et al.Toward the nextgeneration nanomedicines:design of multifunctional multiblock polyurethanes for effective cancer treatment [J].ACS Nano,2013,7(3):1918-1928.
[3] HU Y,MIGNANI S,MAJORAL J,et al.Construction of iron oxide nanoparticlebased hybrid platforms for tumor imaging and therapy [J].Chemical Society Reviews,2018,47(5):1874-1900.
[4] CHEN G,ROY I,YANG C,et al.Nanochemistry and nanomedicine for nanoparticlebased diagnostics and therapy [J].Chemical Reviews,2016,116(5):2826-2885.
[5] RYU J,LEE S,SON S,et al.Theranostic nanoparticles for future personalized medicine [J].Journal of Controlled Release,2014,190:477-484.
[6] LEMASTER J,WANG Z,HARIRI A.Gadolinium doping enhances the photoacoustic signal of synthetic melanin nanoparticles:a dual modality contrast agent for stem cell imaging [J].Chemistry of Materials,2019,31(1):251-259.
[7] SCHNEIDER M G M,MARTIN M J,CORAL D,et al.Selective contrast agents with potential to the earlier detection of tumors:insights on synthetic pathways,physicochemical properties and performance in MRI assays [J].Colloids and Surfaces B:Biointerfaces,2018,170:470-478.
[8] LYU Y,ZHEN X,MIAO Y,et al.Reactionbased semiconducting polymer nanoprobes for photoacoustic imaging of protein sulfenic acids [J].ACS Nano,2017,11(1):358-367.
[9] BOGDANOV A,DIXON A,GUPTA S,et al.Synthesis and testing of modular dualmodality nanoparticles for magnetic resonance and multispectral photoacoustic imaging [J].Bioconjugate Chemistry,2016,27(2):383-390.
[10] VILLARAZA L,BUMB A,BRECHBIEL M.Macromolecules,dendrimers,and nanomaterials in magnetic resonance imaging:the interplay between size,function,and pharmacokinetics [J].Chemical Reviews,2010,110(5):2921-2959.
[11] SHEN S,KONG F,GUO X,et al.CMCTS stabilized Fe3O4 particles with extremely low toxicity as highly efficient nearinfrared photothermal agents for in vivo tumor ablation [J].Nanoscale,2013,5(17):8056-8066.
[12] ZHOU Z G,SUN Y A,SHEN J C,et al.Iron/iron oxide core/shell nanoparticles for magnetic targeting MRI and nearinfrared photothermal therapy [J].Biomaterials,2014,35:470-7478.
[13] ZHAO H,ZHOU P,HUANG K,et al.Amplifying apoptosis homing nanoplatform for tumor theranostics [J].Advanced Healthcare Materials,2018,7(14):1800296.
[14] MAEDA H.Toward a full understanding of the EPR effect in primary and metastatic tumors as well as issues related to its heterogeneity [J].Advanced Drug Delivery Reviews,2015,91:3-6.
[15] SYKES E,CHEN J,ZHENG G,et al.Investigating the impact of nanoparticle size on active and passive tumor targeting efficiency [J].ACS Nano,2014,8(6):5696-5706.
[16] SMITH B,SMITH B D.Biomarkers and molecular probes for cell death imaging and targeted therapeutics [J].Bioconjugate Chemistry,2012,23(10):1989-2006.
[17] CHENG X,SUN R,YIN L,et al.Lighttriggered assembly of gold nanoparticles for photothermal therapy and photoacoustic imaging of tumors in vivo [J].Advanced Materials,2017,29(6):1604894.
[18] HANSHWA R,SMITH B.New reagents for phosphatidylserine recognition and detection of apoptosis [J].Bioorganic & Medicinal Chemistry,2005,13(17):5035-5042.
[19] WANG J,ZHAO H,ZHOU Z G,et al.MR/SPECT imaging guided photothermal therapy of tumortargeting Fe@Fe3O4 nanoparticles in vivo with low mononuclear phagocyte uptake [J].ACS Applied Materials & Interfaces,2016,8(31):19872-19882.
[20] SANDIFORD L,PHINIKARIDOU A,PROTTI A,et al.Bisphosphonateanchored PEGylation and radiolabeling of superparamagnetic iron oxide:longcirculating nanoparticles for in vivo multimodal (T1 MRISPECT) imaging [J].ACS Nano,2013,7(1):500-512.
[21] PARK J,KIM J,LEE Y,et al.Gadolinium complex of 125I/127IRGDDOTA conjugate as a tumortargeting SPECT/MR bimodal imaging probe [J].ACS Medicinal Chemistry Letters,2013,4(2):216-219.
[22] YANG Y,ZHANG L,CAI J,et al.Tumor angiogenesis targeted radiosensitization therapy using gold nanoprobes guided by MRI/SPECT imaging [J].ACS Applied Materials & Interfaces,2016,8(3):1718-1732.
[23] PARK J,KIM J,KIM H,et al.Heteronuclear Gd99mTc complex of DTPAbis(histidylamide) conjugate as a bimodal MR/SPECT imaging probe [J].ACS Medicinal Chemistry Letters,2012,3(4):299-302.
[24] FAN Q,CHENG K,HU X,et al.Transferring biomarker into molecular probe:melanin nanoparticle as a naturally active platform for multimodality imaging [J].Journal of the American Chemical Society,2014,136(43):15185-15194.
[25] TANG Y,ZHANG C,WANG J,et al.MRI/SPECT/fluorescent trimodal probe for evaluating the homing and therapeutic efficacy of transplanted mesenchymal stem cells in a rat ischemic stroke model [J].Advanced Functional Materials,2015,25(7):1024-1034.
[26] NICOLAS J,MURA S,BRAMBILLA D,et al.Design,functionalization strategies and biomedical applications of targeted biodegradable/biocompatible polymerbased nanocarriers for drug delivery [J].Chemical Society Reviews,2013,42(3):1147-1235.
[27] ZHOU P,ZHAO H,WANG Q,et al.Photoacousticenabled selfguidance in magnetic hyperthermia Fe@Fe3O4 nanoparticles for theranostics in vivo [J].Advanced Healthcare Materials,2018,7(9):1701201.
(責任编辑:郁 慧)

