白花丹醌对大鼠肝星状细胞活性氧及TGF-β1/Smad信号通路的影响
王声善,赵 川,陈永欣,唐爱存,彭 岳,刘雪梅,林宇宁,陈婉君,韦燕飞
(1. 广西中医药大学基础医学院生理学教研室,广西 南宁 530021;2. 广西中医药大学第一附属医院药剂科,广西 南宁 530023)
肝纤维化是由慢性肝病引起的,与肝硬化高发病率和高死亡率密切相关。慢性氧化应激是启动肝脏纤维化过程的重要病因。肝星状细胞(hepatic stellate cell,HSC)是内源性、肝脏特异性间充质细胞,在肝脏炎症和纤维化发生中起关键作用[1]。在正常肝脏中,HSC含有维生素A脂滴。通过肝损伤激活,静息HSC成为活化的HSC,其特征在于α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达,产生炎性细胞因子、趋化因子和细胞外基质蛋白(extracellular matrix,ECM)[2]。研究表明,氧化应激可以刺激HSC的活化,其中活性氧(reactive oxygen species,ROS)与HSC激活密切相关。ROS是由各种肝脏损伤产生的,如酒精滥用、肝炎病毒感染和慢性胆汁淤积,并有助于肝纤维化[3]。ROS可刺激胶原蛋白I的产生,是转化生长因子β1(transforming growth factor β1,TGF-β1)和Smad作用于肝纤维化的细胞内信号传导介质[4]。由于HSC在ECM形成中的重要作用,HSC的活化被认为是肝纤维化的重要部分。TGF-β1是引起ROS产生的主要细胞因子,可通过激活其下游Smad信号通路,刺激HSC的激活和增殖[5]。因此,TGF-β1/Smad信号被认为是预防和治疗肝纤维化的潜在靶标。
白花丹(PlumbagozeylanicaL)别名为“白雪花”“三钱三”或“猛老虎”,白花丹有效成分为白花丹醌(plumbagin)。众多研究结果表明,白花丹醌具有抗炎、抗菌、抗氧化应激、抗肝纤维化、抗肿瘤等药理学作用[6-8]。然而,白花丹醌对肝纤维化的作用机制尚不清楚,需要进一步研究。本实验分离培养原代HSC,经TGF-β1诱导,观察白花丹醌对原代HSC的影响,检测其对ROS表达及TGF-β1/Smad信号的影响,探讨白花丹醌的潜在抗肝纤维化机制,为民族医药深入开发利用及其临床应用提供实验基础和理论依据。
1 材料
1.1 实验动物SD大鼠,体质量(140~180) g,购自广西医科大学实验中心,生产批号:SCXK-Gui-2014-0002。
1.2 药物与试剂白花丹醌(Sigma公司,批号:20071028);0.25%胰酶(Gibco公司,批号:15050065);BCA蛋白浓度测定试剂盒(批号:P0010)、磷酸酶抑制剂(批号:S1873),均购自碧云天公司;兔多抗p-Smad2/3(CST公司,批号:8828);兔单抗Smad2/3(Abcam公司,批号:Ab202445);兔多抗Smad7(武汉博士德生物工程有限公司,批号:BA1399);DCFH-DA(批号:S0033)、DAPI(批号:C1002),均购自碧云天公司;Collagen III抗体(三鹰公司,批号:22734-1-AP);TGF-β1(Peprotech公司,货号:100-21)。
1.3 仪器IX51倒置显微镜(Olympus公司);MULTISKAN MK3酶标仪(Thermo公司);DYCZ-24DN垂直电泳槽(北京六一仪器厂);HI650离心机(湖南湘仪实验室仪器开发有限公司);T8-1磁力搅拌器(江苏省金坛市中大仪器厂)。
2 方法
2.1 原代大鼠HSC的分离与培养大鼠以戊巴比妥钠麻醉,同时皮下注射5 000 U肝素钠抗凝;皮肤常规消毒后打开腹腔,钝性分离门静脉及下腔静脉;以16号套管针作门静脉插管,37 ℃灌注D-Hanks液,10 mL·min-1至肝脏充盈,剪开下腔静脉放血后结扎。立即打开胸腔,以16号套管针作上腔静脉插管,形成门静脉-上腔静脉循环;以0.1%链霉蛋白酶E 5 mL·min-1灌注3~4 min,0.03%Ⅱ型胶原酶5 mL·min-1灌注3~4 min;取出肝脏,去肝包膜,用眼科剪剪碎。加入链霉蛋白酶E至终浓度为0.006%、DNA酶至终浓度为10 pug/mL。37 ℃、5% CO2孵箱内消化30 min;过200目筛网,培养液洗4次,将细胞铺于制备好梯度的细胞分离管中,对照管中加入等量培养液;4 ℃、800×g平抛离心30 min。吸取1.040密度层的上层细胞,培养液洗2次,加入无血清RPMI l640培养液,于37 ℃、5% CO2孵箱孵育15 min,吸取细胞悬液,在6孔板中以含20%胎牛血清的RPMI 1640培养。24 h后换液,此后每3 d换液1次[9]。
2.2 MTT法检测HSC增殖情况经过原代细胞的分离培养,用完全培养基调整细胞密度到3×104个接入96孔板,每孔100 μL细胞悬液,每组设3个复孔,分别加入白花丹醌(1、2、4、8、16 μmol·L-1),同时设空白组。37 ℃培养24 h;接着每孔加入10 μL MTT,37 ℃培养4 h;吸出培养基,加入150 μL DMSO震荡10 min。酶标仪测定各孔吸光度值(OD568),计算细胞活力抑制率。细胞活力抑制率/%=(1-实验组OD值/空白对照组OD值)×100%。
2.3 荧光探针法测定细胞内ROS水平取对数生长期细胞,用完全培养基调整细胞密度到3×104个接种于96孔板,每组3个复孔,同时设空白对照组,每孔100 μL细胞悬液,同时设空白组,37 ℃培养过夜;按分组更换100 μL含白花丹醌(2、4、8 μmol·L-1完全培养基,37 ℃培养48 h;每孔更换终浓度为10 μmol·L-1DCFH-DA的无血清DMEM培养基100 μL,37 ℃培养20 min;无血清培养基洗涤细胞3次;荧光酶标仪检测(激发光488 nm,发射光525 nm)。
2.4 Western blot检测Smad蛋白表达制备裂解液,低温提取总蛋白,用BCA蛋白浓度测定试剂盒检测各组蛋白浓度;将提取的蛋白上清与5×蛋白上样缓冲液放入沸水中,沸水浴10 min;制备5%浓缩胶和12%分离胶,上样后电泳分离,电转移120 min,用含5%脱脂奶粉的TBST封闭PVDF膜,室温摇床封闭2 h,磷酸化蛋白用1%~3%的BSA封闭。一抗4 ℃孵育过夜,TBST洗膜5~6次,每次5 min。加入HRP标记二抗(1 ∶50 000稀释),37 ℃摇床孵育2 h,TBST洗膜5~6次,每次5 min。将ECL工作液滴加于PVDF膜上,X线胶片压片后依次放入显影液显影、定影液定影,冲洗胶片。晾干胶片,扫描胶片,用BandScan分析胶片灰度值。

3 结果
3.1 原代大鼠HSC形态变化倒置显微镜下观察大鼠HSC,在分离后d 1,HSC开始贴壁,细胞呈卵圆形状态,胞体变大、变平;细胞呈散在分布,可见单核或双核肝细胞;分离后d 3,细胞全部贴壁,胞质中脂滴减少、逐渐消失,HSC形态多样,部分细胞已出现多角伪足,呈星状;分离后d 5,HSC呈现不规则多角形,相邻HSC连接更加紧密,形成岛状或条索状;细胞呈对数生长期,细胞增殖速度增加,呈梭形;分离后d 8,细胞铺满培养板,细胞形态由梭形变为类纤维状(Fig 1)。
3.2 免疫荧光法鉴定HSC中α-SMA的表达通过观察典型的HSC形态变化,分离的原代细胞活化后,经α-SMA免疫组织荧光鉴定,呈阳性表达,阳性率达91%,获得了高纯度的大鼠原代HSC(Fig 2)。
3.3 白花丹醌对HSC增殖的抑制作用MTT结果显示(Tab 1),白花丹醌2~16 μmol·L-1对细胞活力的抑制率明显,且抑制率随浓度的增加而提高。为避免高浓度白花丹醌对细胞毒性的未知影响,后续实验选择白花丹醌2、4、8 μmol·L-1作为实验浓度。
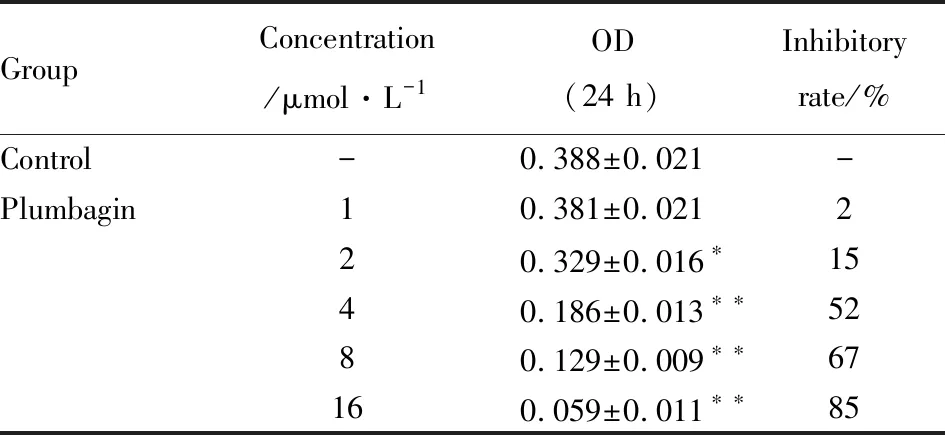
GroupConcentration/μmol·L-1OD(24 h)Inhibitoryrate/%Control-0.388±0.021-Plumbagin10.381±0.021220.329±0.016∗1540.186±0.013∗∗5280.129±0.009∗∗67160.059±0.011∗∗85
*P<0.05,**P<0.01vscontrol
3.4 白花丹醌对HSC形态的影响如Fig 3所示,正常的HSC随着培养天数的增加,数量不断扩增,细胞形态由原来的星状结构变为肌纤维状。从细胞的形态来看,与空白组比较,TGF-β1组越来越多细胞更接近于肌纤维状;与TGF-β1组比较,NADPH氧化酶抑制剂DPI及白花丹醌各浓度组可以抑制HSC向肌纤维状变化,保持HSC的星状结构,使细胞更长时间处于静息状态。
3.5 白花丹醌对HSC内ROS水平的影响荧光探针法检测结果显示(Fig 4),与空白对照组相比,模型组HSC内绿色荧光明显增强,表明ROS水平明显升高。与模型组相比,给药组细胞内绿色荧光信号明显减弱,DPI组和白花丹醌各浓度组可不同程度下调ROS的水平,随着白花丹醌浓度的增加,HSC内荧光强度明显减弱,且绿色荧光的细胞数明显减少。另外,与模型组相比,DPI组和白花丹醌组ROS荧光密度值明显降低,与正常组比较,差异无显著性。

Fig 1 Morphological changes of primary rat HSC(×400)

Fig 2 Immunofluorescence identification of α-SMA(×200)

Fig 3 Morphological observation of HSC(×200)

Fig 4 Effect of plumbagin on ROS production in HSC(×200)
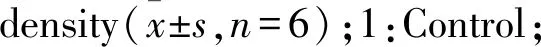
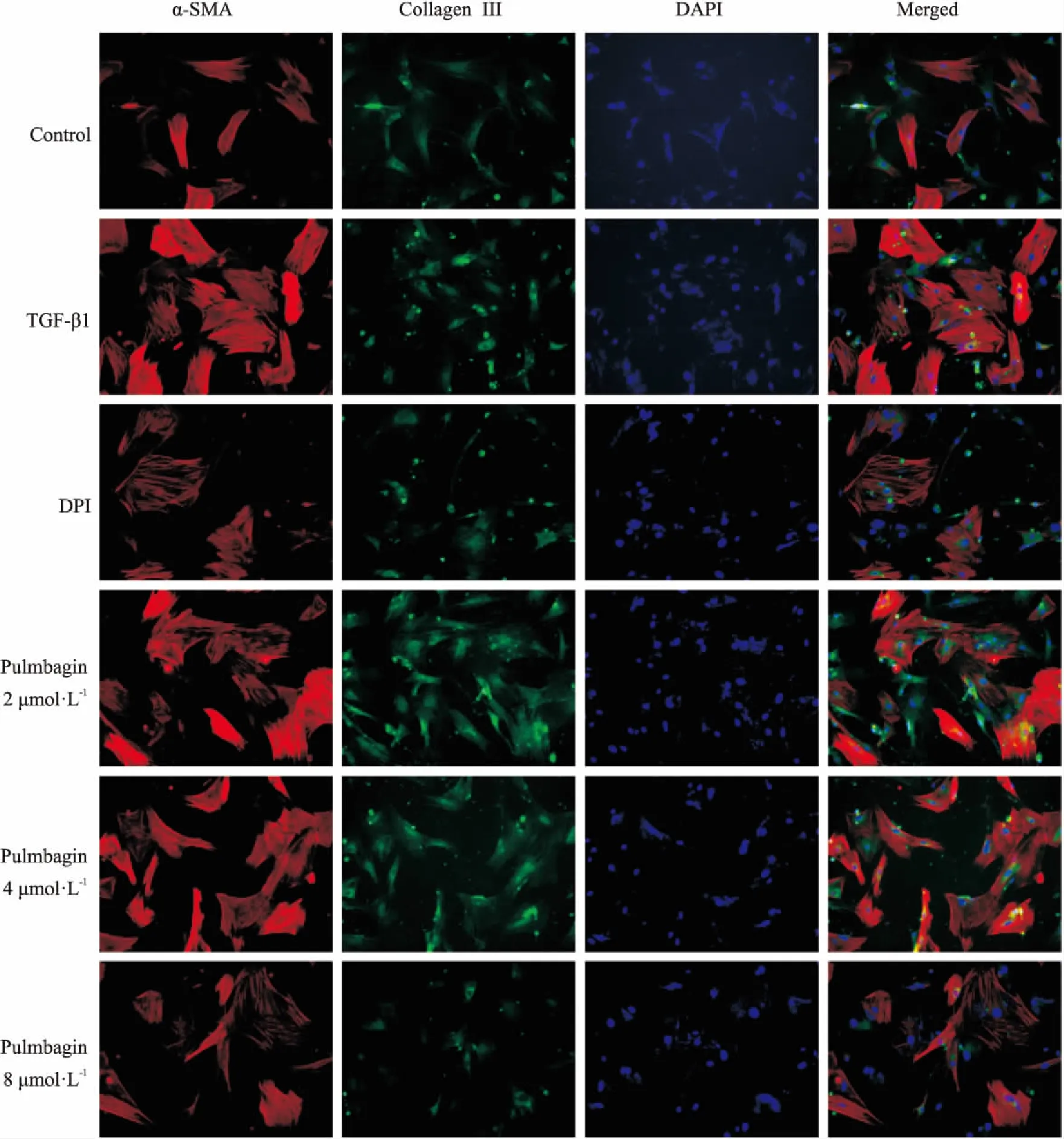
Fig 5 Effect of plumbagin on α-SMA in HSC(×200)
3.6 白花丹醌对HSC中α-SMA和collagen III蛋白表达的影响如Fig 5所示,与对照组比较,TGF-β1刺激的HSC中α-SMA和collagen III呈现阳性表达,表明细胞造模成功。随着白花丹醌浓度的增加,α-SMA和collagen III表达逐渐下调,DPI组与白花丹醌处理组中α-SMA和collagen III表达均降低。
3.7 白花丹醌对HSC中Smad蛋白表达的影响Fig 6的Western blot结果显示,与对照组比较,TGF-β1刺激组中p-Smad2/3、Smad2/3表达升高,而Smad7表达降低;与TGF-β1组比较,DPI组及白花丹醌各浓度处理组中p-Smad2/3的表达降低,抑制其活性,但总Smad2/3无明显变化;相反,DPI及白花丹醌各浓度处理组中,Smad7蛋白水平明显上升,差异有统计学意义。
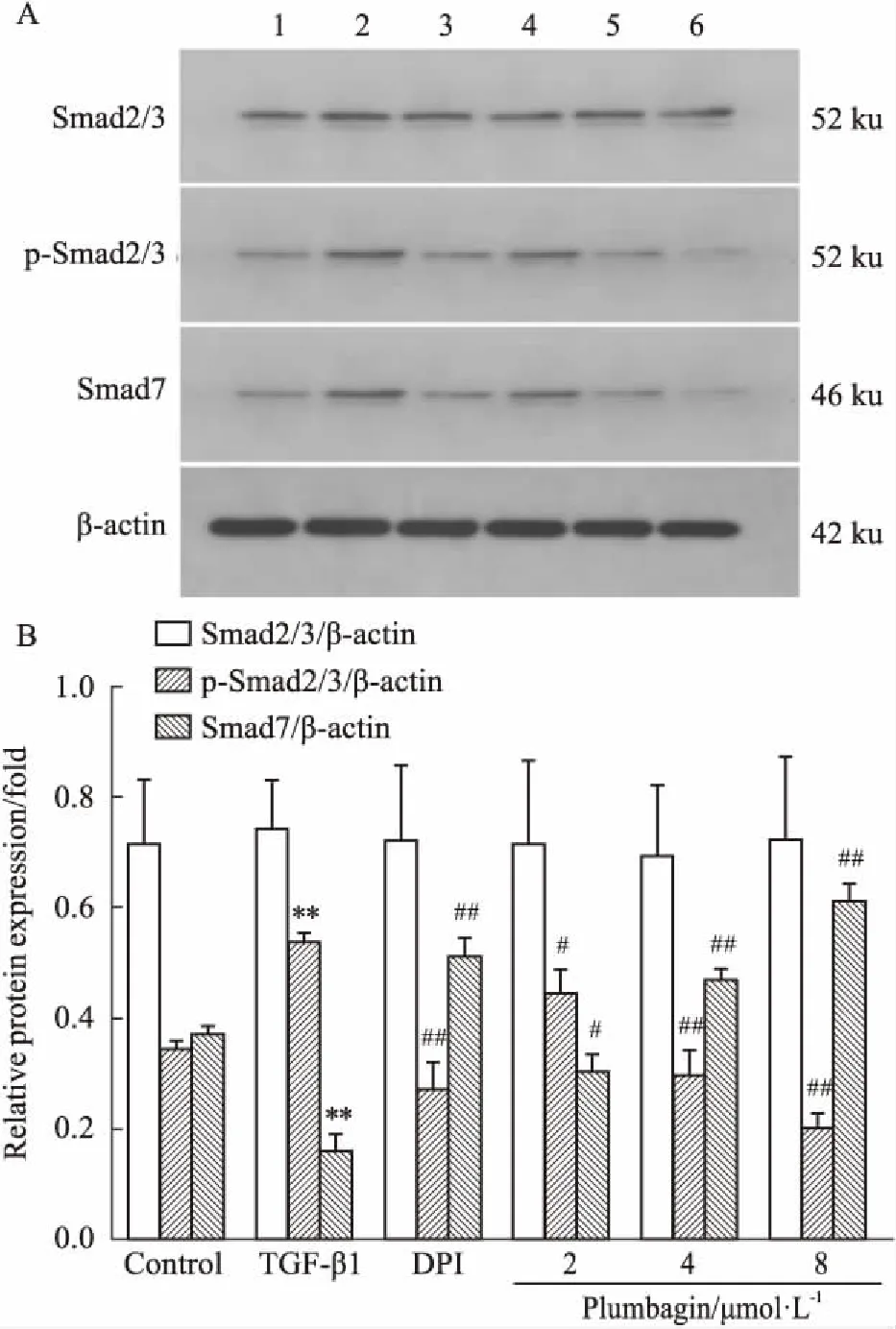
Fig 6 Effect of plumbagin on protein expression of Smad in HSC detected by Western
1:Control; 2:TGF-β1; 3:DPI; 4:Plumbagin 2 μmol·L-1; 5:Plumbagin 4 μmol·L-1; 6:Plumbagin 8 μmol·L-1.**P<0.01vscontrol;#P<0.05,##P<0.01vsTGF-β1.
4 讨论
肝纤维化在多种慢性肝病的发展阶段常见,其特征在于肝脏内ECM的过度沉积导致[10]。现已证明,由NADPH氧化酶4(NADPH oxidase 4,NOX4)产生的ROS是细胞内信号转导的第二信使,介导了各种促肝纤维化因子的细胞内信号转导。研究表明,ROS可直接刺激HSC的增殖与活化,促进肝纤维化的发生[11]。本研究结果显示,HSC经过白花丹醌(2~16 μmol·L-1)处理后,对细胞活力的抑制率高于10%,对TGF-β1刺激的活化型HSC的生长具有明显的抑制作用。TGF-β1刺激的模型复制成功后,给予白花丹醌作用24 h后,HSC由肌纤维状变为星状结构,使细胞由活化状态转为静息状态,对细胞的增殖有抑制作用;荧光探针法检测结果显示,白花丹醌药物组可不同程度下调HSC中ROS水平,提示白花丹醌抑制HSC增殖和活化功能的机制之一可能与下调ROS等抗氧化功能有关。此外,α-SMA是HSC活化的标志之一,白花丹醌可降低HSC中α-SMA蛋白表达,从而使HSC更多的处于静息状态。
TGF-β超家族是一组多功能多肽,包括TGF-β1、骨形态发生蛋白、抑制素和激活素。与肝硬化密切相关的TGF-β由5个成员组成,TGF-β1~TGF-β5,其中只有TGF-β1与肝纤维化相关[12]。TGF-β1广泛存在于动物的正常组织和转化细胞中,骨组织和血小板中含量最丰富[13]。它可以抑制增殖,诱导细胞分化和免疫抑制,促进ECM合成,调节胶原蛋白的产生和组织修复。TGF-β1浓度在正常肝脏中较低,但在肝脏损伤发生时明显增加。当肝纤维化期间由各种致病因子诱导时,肝实质细胞、库普弗细胞、窦状内皮细胞、成纤维细胞、血小板和其他迁移性炎症细胞可释放大量TGF-β1。此外,活化的HSC最终成为TGF-β1产生的主要来源,形成正反馈回路[14]。本研究体外实验也证实,HSC可被TGF-β1激活,白花丹醌可抑制HSC中Smad信号通路的表达,从而抑制细胞活化,减缓肝纤维化进程。
TGF-β1/Smad信号通路由3部分组成:细胞外TGF-β1、膜结合TGF-β1受体和细胞内Smad蛋白。存在至少5种不同类型的TGF-β1受体,其中TβR-I和TβR-II是信号转导受体,其是信号转导所必需的。TβR是包含跨膜丝氨酸/苏氨酸激酶受体,在没有配体的情况下,它们仍然是二聚体。一旦TGF-β1与其受体结合,即TβR-I和TβR-II激活,然后催化下游Smad分子上丝氨酸残基的磷酸化。最后,磷酸化的Smad进入细胞核,并调节与肝纤维化相关的靶基因的转录。Smad是I型受体中唯一已知的细胞内底物。Smad家族蛋白包括至少9种Smad蛋白,即Smad 1~9,其分为受体激活的Smad(R-Smad),共同途径Smad(Co-Smad)和抑制性Smad(I-Smad)。R-Smad蛋白,如Smad2和Smad3,主要可促进肝纤维化,而I-Smad如Smad7,可抑制或调节TGF-β信号转导,并抑制肝纤维化。由于TGF-β1/Smad信号转导途径在肝纤维化中的重要作用,阻断其信号转导是预防和治疗肝纤维化的潜在策略[15]。本研究发现,白花丹醌下调Smad2/3和p-Smad2/3的表达,并上调Smad7的表达,从而抑制TGF-β1/Smad信号通路。
总之,白花丹醌是从白花丹中提取的有效抗纤维化成分。白花丹醌可以调节ROS的表达;在TGF-β1/Smad信号转导途径中,白花丹醌也下调α-SMA、Smad2/3和p-Smad2/3的表达,上调Smad7的表达。提示白花丹醌可能通过降低ROS的产生,从而抑制HSC的活化。因此,白花丹醌是治疗肝纤维化的潜在药物。