氯化锂通过TGFBI促进角膜基质成纤维细胞增殖和自噬
聂丹瑶,黎 明,叶 琳,贺温玲,刘欣华
0引言
颗粒状角膜营养不良(granular corneal dystrophy,GCD)是临床常见的角膜营养不良之一,属于常染色体显性遗传病,其发病率约为5.52/10000。由于5q31染色体上的转化生长因子-β(TGFBI)基因发生突变,使得TGFBI蛋白(TGFBIp)在角膜基质层和弹力层聚集,并发生代谢障碍,导致患者双侧角膜出现混浊,最终造成视力损害[1]。在GCD早期,尚无有效的治疗或缓解方法[2]。随着GCD病情的恶化,可以采用手术方法来切除病变组织,包括板层角膜移植术和准分子激光角膜切削术[3],但由于术后复发甚至加重的原因,其效果并不理想。因此,积极探索新的治疗靶点将会有良好的应用前景。研究表明,TGFBI突变与GCD的发生密切相关。TGFBI在细胞增殖、分化、迁移和粘附等方面具有重要作用[4],但TGFBI在GCD中具体的功能和机制还不完全清楚。氯化锂(lithium chloride,LiCl)作为药物广泛应用于精神和神经系统疾病的治疗[5]。研究表明,LiCl可抑制TGFBI的表达,并增加角膜成纤维细胞和癌细胞中糖原合成酶激酶-3 (Glycogen synthase kinase-3, GSK-3)与微管相关蛋白轻链3(LC3)的比例[6]。本研究进一步探讨LiCl在突变型TGFBI转染的角膜基质成纤维细胞中的功能及相关机制,期待未来可为角膜营养不良患者的药物治疗提供实验依据。
1材料和方法
1.1材料收集2017-01/12就诊于深圳市眼科医院并接受手术治疗的颗粒样角膜营养不良病变患者3例,获取3个角膜组织。所有角膜营养不良患者均经TGFBI基因突变DNA测序分析确诊,且无遗传或全身代谢性疾病史。同时,选取来自三个不同个体捐献的正常角膜组织3个。角膜组织的取材及使用都经过患者知情同意,该研究经深圳市眼科医院医学伦理委员会批准。所有角膜组织在无菌条件下被切成20mg的组织块分装,-80℃保存。实验试剂:DMEM培养基(Sigma,D1152)、胰蛋白酶(Gibco, 15090-046)、胎牛血清(FBS, Gibco, 26140087)、青霉素-链霉素双抗(Gibco,15070-063)、DMSO(Sigma,D8418)、兔源单克隆抗TGFBI抗体(Abcam, Cambridge, UK),兔源多克隆抗LC3抗体(Abcam)、兔源单克隆抗GAPDH抗体(Boster, Wuhan, China)、pcDNA3.0载体(Invitrogen, USA)、Bestar qPCR RT Kit(DBI, USA)、Bestar® SybrGreen qPCR-master Mix(DBI, USA)、RIPA(Beyotime, China)、ECL化学发光试剂(Beyotime, China)。
1.2方法
1.2.1免疫组织化学检测角膜组织中TGFBI和LC3表达分别采用4%多聚甲醛固定GCD患者行板层角膜移植术切除的角膜组织和捐献的正常角膜组织,石蜡包埋后切片,厚度4μm。37℃干燥过夜后,于1%过氧化氢溶液中浸泡20min。3%牛血清白蛋白室温下孵育1h,并于兔源单克隆抗TGFBI抗体和兔源多克隆抗LC3抗体一抗(1∶500)4℃孵育过夜,鼠抗兔HRP标记IgG(1∶1000)二抗孵育后,DAB显色,苏木素染核后脱水封片。显微镜下观察GCD角膜组织和正常角膜组织中TGFBI和LC3的表达。
1.2.2细胞培养根据文献[7]提供方法,取板层角膜移植术切除下来正常角膜组织的基质层组织,生理盐水清洗3次,抗生素液(100μg/mL链霉素+100U/mL青霉素)处理30min。在无菌条件下,去除角膜上皮层,将角膜基质层放入10% FBS的DMEM培养液,置于37℃、5% CO2培养箱中培养。7d后,Hanks液清洗,0.125%胰蛋白酶消化,离心后收集细胞。
1.2.3野生型和突变型TGFBI质粒构建采用PCR法扩增TGFBI。野生型TGFBI引物:正向引物5’-CCC AAG CTT ATG GCG CTC TTC GTG CG -3’, 反向引物: 5’- CCG CTC GAG CTA ATG CTT CAT CCT CTC TAA TAA CTT TT -3’。突变型TGFBI引物:正向引物5’- AGC TGT ACA CGG ACC ACA CGG AGA AGC TGA G -3’,反向引物 5’- CTC AGC TTC TCC GTG TGG TCC GTG TAC AGC T -3’。1%琼脂糖凝胶电泳TGFBI扩增产物。将回收的TGFBI扩增产物和pcDNA3.0质粒酶切后进行电泳回收,T4连接酶连接后,转化并提取重组质粒。
1.2.4细胞转染和处理首先将构建的野生型和突变型TGFBI质粒转染正常角膜基质成纤维细胞,转染空载体作为对照组,转染后留取0、12、24、36、48h的细胞做活性检测并提取转染后24h的细胞蛋白。其次,将LiCl溶于PBS中,并采用0、5、10、20、40mmol/L LiCl处理正常角膜基质成纤维细胞6h,留取处理后24h时的细胞做活性检测。然后,同等浓度梯度的LiCl(KCl作为对照)处理突变型TGFBI转染的角膜基质成纤维细胞6h,留取处理后24h时的细胞提取蛋白。根据正常角膜基质成纤维细胞的浓度梯度处理后的细胞活性结果,后续则采用20mmol/L LiCl处理突变型TGFBI转染的角膜基质成纤维细胞,观察不同时间(0、1、6、12h)后, TGFBI与LC3蛋白表达变化。最后,采用20mmol/L LiCl处理突变型TGFBI过表达载体转染的角膜基质成纤维细胞12h,留取处理后24h时的细胞做活性检测,并提取蛋白备用。
1.2.5 CCK-8法检测细胞活力取上述处理后的角膜基质成纤维细胞,调整为1×103cells/mL浓度并铺于96孔板中,每孔100μL,每组设6个复孔。每组细胞在特定时间加入CCK-8试剂,5% CO2孵箱37℃条件培养3h后,于酶标仪下测定450nm波长处吸光度值(OD值)。
1.2.6 Western-blot法检测TGFBI和LC3表达RIPA提取了角膜营养不良及正常角膜组织及上述不同处理后的细胞总蛋白,按 BCA 蛋白浓度检测试剂盒使用说明书检测各组蛋白浓度。取40μg 各组总蛋白于8% SDS-PAGE 凝胶电泳分离蛋白后转膜。5%脱脂牛奶封闭,兔源单克隆抗TGFBI抗体(1∶2000),兔源多克隆抗LC3抗体(1∶1000)、兔源单克隆抗抗GAPDH抗体(1∶5000)4℃孵育过夜。鼠抗兔HRP标记的IgG二抗(1∶5000)室温孵育1h后,ECL显色。
统计学分析:采用SPSS 20.0进行统计学分析,连续变量采用均数±标准差表示,组间差异检验采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2结果
2.1 TGFBI和LC3角膜组织中的表达免疫组织化学检测结果显示,与正常角膜组织相比,TGFBI和LC3在GCD患者角膜组织中呈强阳性表达(图1A)。Western-blot检测结果显示,与正常角膜组织相比,TGFBI和LC3在GCD患者角膜组织中显著高表达(图1B)。
2.2 TGFBI过表达抑制角膜基质成纤维细胞活性分别构建野生型和突变型TGFBI过表达载体,并转染角膜基质成纤维细胞。Western-blot检测结果显示,经野生型和突变型TGFBI过表达载体转染的角膜基质成纤维细胞中TGFBI表达明显增加,提示细胞转染成功;与空载体转染组相比,LC3在野生型TGFBI组细胞中的表达无明显差异,而在突变型TGFBI组细胞中表达显著增加,提示突变型TGFBI可显著上调LC3表达(图2A)。CCK-8实验结果显示,空载体转染组、野生型TGFBI组、突变型TGFBI组细胞转染后12、24、36h,野生型TGFBI组细胞活性均较空载体转染组明显减弱;突变型TGFBI组细胞活性较野生型TGFBI组显著减弱,差异均有统计学意义(P<0.05,图2B)。
图1TGFBI与LC3蛋白在角膜组织中的表达A:免疫组织化学检测TGFBI与LC3蛋白的表达(×100);B:Western-blot法检测TGFBI与LC3蛋白的表达。C:正常角膜组织;CD:GCD患者角膜组织。
2.3 LiCl对角膜基质成纤维细胞活性的影响分别采用0、5、10、20、40mmol/L LiCl处理正常角膜基质成纤维细胞6h,CCK-8法检测结果显示,LiCl对正常角膜基质成纤维细胞无毒性作用(图3)。
2.4 LiCl对突变型TGFBI转染的角膜基质成纤维细胞中TGFBI表达的影响分别采用5、10、20、40mmol/L LiCl处理突变型TGFBI转染的角膜基质成纤维细胞6h,Western-blot检测结果显示,LiCl可抑制TGFBI蛋白表达水平,且随着LiCl浓度的增加,TGFBI蛋白表达水平降低(图4A)。采用20mmol/L LiCl分别处理突变型TGFBI转染的角膜基质成纤维细胞0、1、6、12h,Western-blot检测结果显示,在20mmol/L LiCl作用下,随着作用时间的延长,TGFBI蛋白表达水平降低(图4B)。
2.5 LiCl对突变型TGFBI转染的角膜基质成纤维细胞自噬和活性的影响采用20mmol/L LiCl处理突变型TGFBI过表达载体转染的角膜基质成纤维细胞12h,Western-blot检测结果显示,与对照组相比,TGFBI和LC3蛋白表达水平在LiCl处理组显著下调(图5A)。CCK-8检测结果显示,与对照组相比,细胞活性在LiCl处理组明显增加,差异有统计学意义(P<0.05,图5B)。
3讨论
自噬(autophagy)在细胞调控中起着重要作用,负责降解细胞内损伤蛋白质及功能失调细胞器。LC3作为自噬体膜上的标志蛋白,具有以LC3-Ⅰ和LC3-Ⅱ两种形式存在[8]。在自噬过程中,LC3-Ⅰ经过一系列过程可转变为LC3-Ⅱ,LC3-Ⅱ可与自噬体特异性结合,被广泛用作自噬泡标记物[9]。近年来,越来越多的研究表明,自噬与角膜营养不良的发生和发展过程密切相关[10]。此外,研究表明,LiCl可通过诱导自噬抑制TGFBI的表达[11]。然而,突变型TGFBI与角膜基质成纤维细胞功能之间的关系尚未被研究。本研究通过TGFBI (G/A 371)的转染,研究突变后角膜基质成纤维细胞对LiCl的敏感性。此外,我们发现,突变型TGFBI可促进自噬,突变型TGFBI的变化与角膜营养不良细胞的自噬增强有关。同时,我们证实,LiCl通过抑制自噬促进突变型TGFBI转染的角膜基质成纤维细胞增殖活性。
TGFBI作为一种分泌蛋白,可被TGF-β诱导[12]。研究表明,TGFBI蛋白在角膜营养不良病变基质细胞中高表达。TGFBI可通过MMP-1、MMP-3和TIMP-1促进细胞外基质的降解,进而参与角膜的生理病理过程[13]。也有研究表明,在角膜成纤维细胞中,LiCl抑制TGF-β介导的TGFBI的表达[11]。研究也发现,角膜细胞在受到损伤刺激时会产生TGFBI,此外,角膜移植术和准分子激光角膜切削术后的GCD患者中也有TGFBI产生[14]。我们的研究进一步证实,与野生型TGFBI相比,突变型TGFBI对角膜基质成纤维细胞增殖活性的抑制作用更加强。同时,我们发现,野生型TGFBI不能诱导角膜基质成纤维细胞自噬,而突变型TGFBI可显著诱导角膜基质成纤维细胞自噬。因此,这些结果表明TGFBI突变促进角膜基质成纤维细胞自噬。
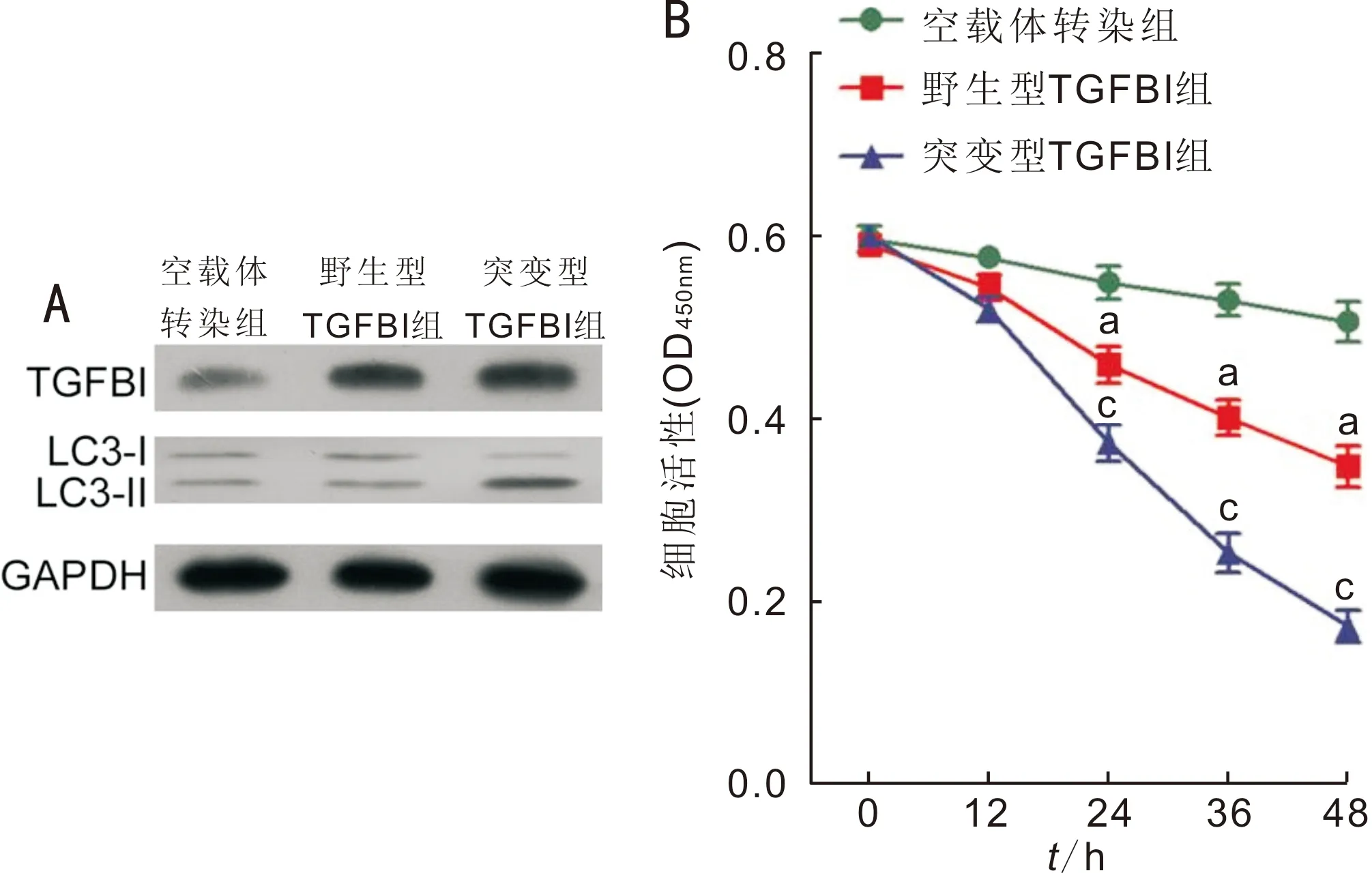
图2TGFBI过表达抑制角膜基质成纤维细胞活性A:Western-blot法检测TGFBI与LC3蛋白的表达;B:CCK-8法检测TGFBI过表达对角膜基质成纤维细胞活性的影响。aP<0.05vs空载体转染组;cP<0.05vs野生型TGFBI组。
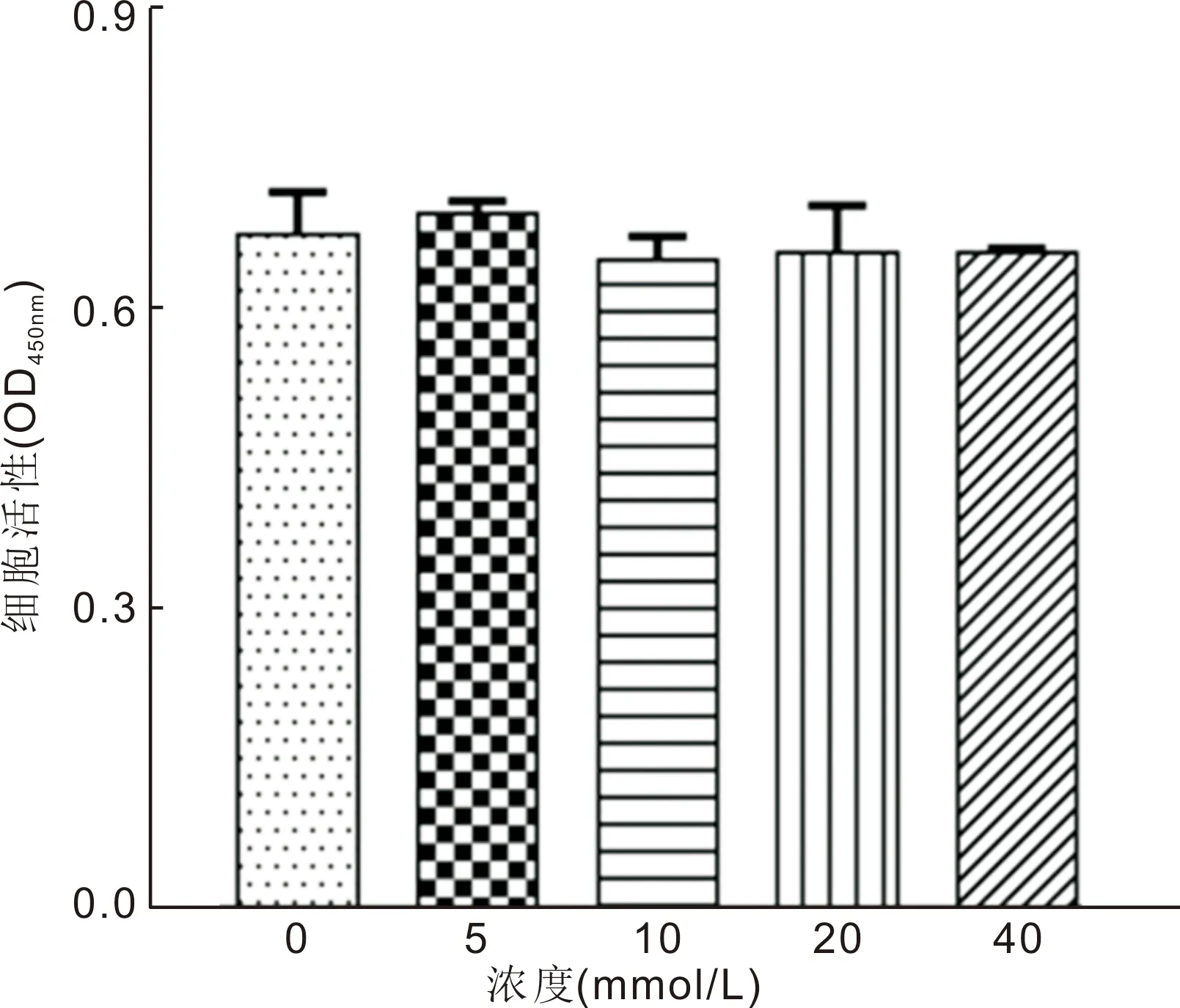
图3LiCl对角膜基质成纤维细胞活性的影响。

图4LiCl对突变型TGFBI转染的角膜基质成纤维细胞中TGFBI表达的影响A: LiCl作用浓度对突变型TGFBI转染的角膜基质成纤维细胞中TGFBI表达的影响;B: LiCl作用时间对突变型TGFBI转染的角膜基质成纤维细胞中TGFBI表达的影响。
图5LiCl对突变型TGFBI转染的角膜基质成纤维细胞自噬和活性的影响A:LiCl对突变型TGFBI转染的角膜基质成纤维细胞LC3表达的影响;B:LiCl对突变型TGFBI转染的角膜基质成纤维细胞活性的影响。NC: 未经LiCl处理的突变型细胞对照组。aP<0.05vs未经LiCl处理的突变型细胞对照组。
LiCl作为GSK-3抑制剂,可抑制GSK-3磷酸化。研究表明,LiCl可参与多种生理调控过程,如基因表达、炎症反应、细胞凋亡及糖原合成等[15]。最近的研究也表明,LiCl下调原发性角膜成纤维细胞中TGFBI的表达水平,并促进自噬[16]。本研究进一步证明,LiCl可抑制突变型TGFBI转染的角膜基质成纤维细胞中TGFBI的表达水平,且呈剂量和时间依赖性。LiCl也可抑制突变型TGFBI转染的角膜基质成纤维细胞自噬,并促进细胞增殖活性。提示LiCl可作为治疗角膜营养不良的潜在治疗靶点。

