规模猪场猪瘟病毒、高致病性猪繁殖与呼吸综合征病毒、伪狂犬病病毒及口蹄疫病毒抗体水平监测及免疫效果评价
柴刚

摘 要:某100头基础母猪的规模猪场,在常规免疫情况下,10余头母猪在妊娠后期出现了流产现象。为调查该猪场免疫效果,分别采集空怀母猪、妊娠前期母猪、妊娠后期及妊娠后期流产母猪血清共20份,进行猪瘟病毒(Classical Swine Fever Virus,CSFV)、高致病性猪繁殖与呼吸障碍综合征病毒(Highly Pathogenic Porcine Reproductive and Respiratory Syndrome Virus, HP-PRRSV)、伪狂犬病病毒(Pseudorabies Virus,PRV)-gE、口蹄疫病毒(Foot and Mouth Disease Virus,FMDV)抗体检测。检测结果表明,PRV-gE抗体和HP-PRRSV抗体阳性率均在95%以上,提示该猪群可能存在PR野毒感染;CSFV抗体阳性率为85%,且阻断率大于0.6的占53.8%,说明该猪群CSFV抗体没有达到理想水平;FMDV抗体阳性率为35%,说明该猪群FMD免疫效果较差,应该及时补免。调查结果提示,PR野毒感染可能是导致该规模场母猪流产的主要原因。
关键词:猪瘟;高致病性猪繁殖与呼吸障碍综合征;伪狂犬病;口蹄疫;抗体监测;免疫效果评价
中图分类号:S858.28 文献标志码:A 文章编号:1001-0769(2019)09-0020-08
随着时代的发展,人民生活水平不断提高,猪肉的需求量不断增大,生猪的养殖量以及养殖密度也不断增加,规模化养猪场生猪的流动和引种也越来越频繁,这在很大程度上增加了疫病的发病风险。而疫苗免疫接种是当前防控重大动物疫病的主要方法,但由免疫失败引发的疫病时有发生,给养殖业带来了巨大的困扰。
猪瘟(Classical Swine Fever,CSF)、高致病性猪繁殖与呼吸障碍综合征(Highly Pathogenic Porcine Reproductive and Respiratory Syndrome, HP-PRRS)、伪狂犬病(Pseudorabies,PR)和口蹄疫(Foot and Mouth Disease,FMD)是常见的危害养猪业的主要动物疫病,被世界动物卫生组织列为必须通报的动物疫病。我国将FMD、CSF和 HP-PRRS列为一类动物疫病,将PR列为二类动物疫病。农业部将CSF和FMD列入国家重大动物疫病强制免疫病种,2007年又将HP-PRRS列为国家强制免疫病种。虽然2017年 1月1日起,国家对CSF和HP-PRRS暂不实施强制免疫政策,但这两种疫病及猪FMD、猪PR的疫苗免疫仍然是当前防控猪场重大动物疫病的重点。由于各规模场免疫程序不同,疫苗免疫失败的案例时有发生,抗体水平达不到国家标准的情况屡见不鲜,严重影响了养猪业的健康持续发展。
甘肃某100头基础母猪的规模猪场,在常规免疫程序下,10头母猪在妊娠后期出现了不同程度的流产现象,为了解该规模场中猪瘟病毒(Classical Swine Fever Virus,CSFV)、口蹄疫病毒(Foot and Mouth Disease Virus,FMDV)、高致病性猪繁殖与呼吸综合征病毒(Highly Pathogenic Porcine Reproductive and Respiratory Syndrome Virus, HP-PRRS)和偽狂犬病病毒(Pseudorabies Virus,PRV)的抗体水平及免疫效果,分别采集空怀母猪、妊娠前期母猪、妊娠后期及妊娠后期流产母猪血清共20份,进行CSFV、HP-PRRSV、 PRV-gE和FMDV抗体检测,为规模猪场制定合理有效的免疫程序以及相应疫病的免疫预防提供参考。
1 材料与方法
1.1 样品的制备
分别采集该规模场各阶段母猪血样20份,每份采集母猪前腔静脉血10 mL置于真空采血管中,室温静置50 min,待血液凝固后,在4 ℃下以1 900 r/min离心10 min,将上层血清转移至新的1.5 mL离心管中,注意枪头不要触碰中间层,将分离出的血清在4 ℃以1 600 r/min离心10 min,取上清液至新的1.5 mL离心管中,-80 ℃保存备用。本试验采集了空怀母猪血样5份、妊娠前期母猪血样5份、妊娠后期母猪血样7份及妊娠后期流产母猪血样3份,分别进行CSFV、HP-PRRSV、PRV-gE和FMDV抗体的酶联免疫吸附试验(Enzyme-Linked Immunosorbent Assay,ELISA)检测。
1.2 检测试剂及检测方法
将采集的20份血清样品分别用武汉科前CSFV、HP-PRRSV和PRV-gE抗体检测试剂盒,以及兰州兽医研究所O型FMDV抗体检测试剂盒对送检样品进行ELISA抗体检测,所有检测均按各自试剂盒说明书进行。
2 结果与免疫效果评价
2.1 CSFV抗体检测结果及效果评价
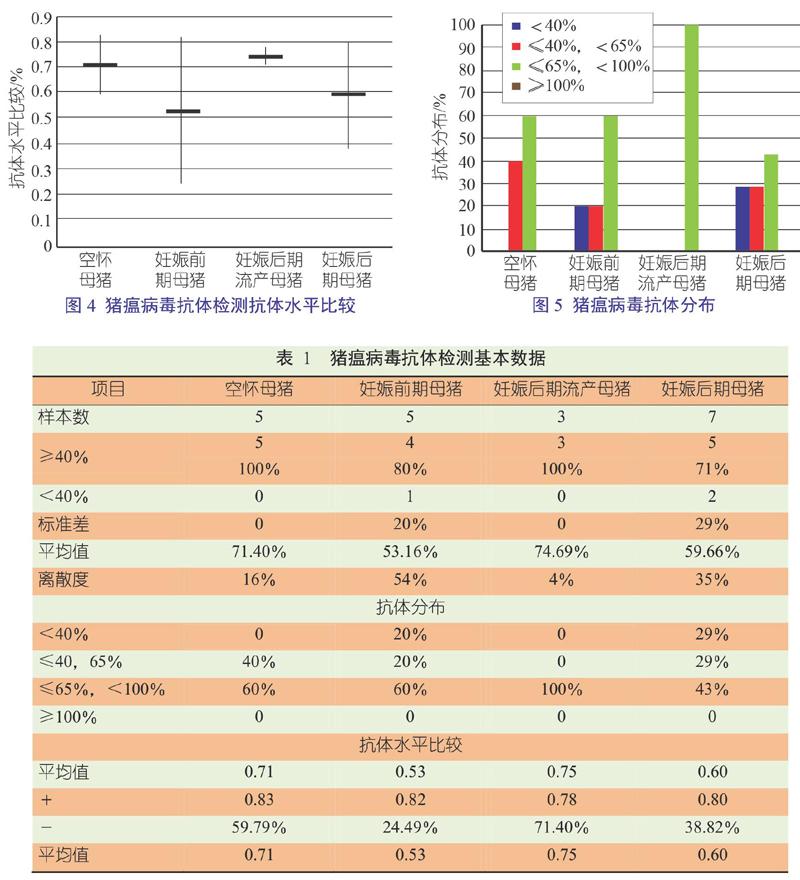
图1、图2、图3、图4、图5及表1显示了CSFV抗体检测的基本数据。结果表明,CSFV抗体检测阻断率低于0.4的有3份,分别是8、14和15号,阳性率为85%;阻断率大于0.6的占53.8%,比例偏低。不同阶段母猪离散度差异较大,说明抗体整齐度较差,通过多次免疫,母猪群CSFV抗体没有达到理想水平。此时,应从环境管理、免疫时间、疫苗剂量、操作以及免疫抑制等方面进行考虑,此外是否有温和型CSF对猪群的干扰,还待进一步检测确认。
2.2 HP-PRRSV抗体检测结果及效果评价
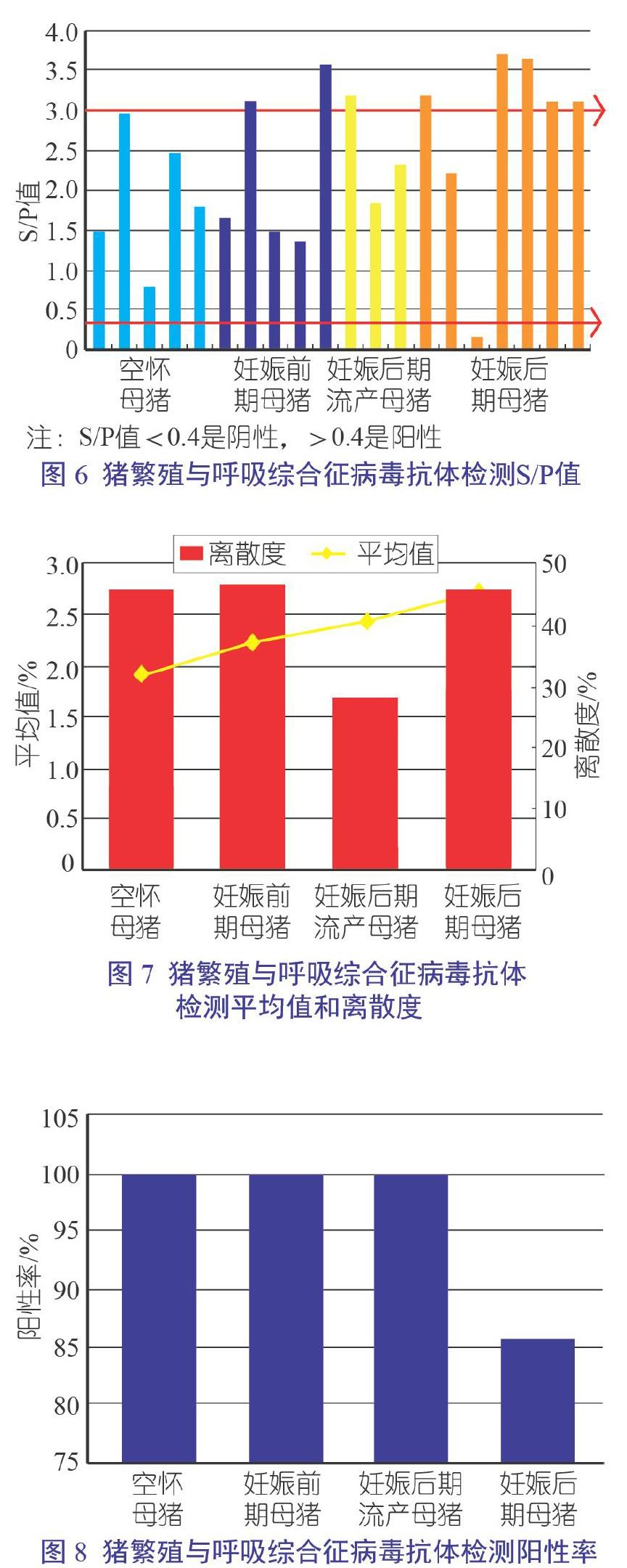
图6、图7、图8、图9、图10及表2显示了HP-PRRSV抗体检测的基本数据,结果表明HP-PRRSV抗体阳性率为95%,抗体离散度较大,HP-PRRSV抗体水平和保护力不是正相关的关系,存在抗体依赖增强作用,母猪群连续免疫S/P值应该在2.5左右较好,但S/P值大于2.5的样品只占45%,说明HP-PRRSV还在猪场复制循环。如果没有免疫疫苗,检测的抗体则为野毒抗体,提示猪群可能存在HP-PRRS野毒感染,为了使猪场生产安全,需根据实际情况,做进一步的病原学检测。
2.3 PRV-gE抗体检测结果及效果评价
图11、图12、图13、图14、图15及表3显示了猪PRV-gE抗体检测的基本数据,该猪场PRV-gE检测只有1例阴性,其余19例为阳性,母猪PRV-gE抗体阳性率高达95%,说明该猪群存在PR野毒感染,感染原因有待进一步溯源。猪群一旦感染PR可终生带毒,因此猪群可能出现不稳定现象。目前,对该母猪群免疫PR疫苗只能减少排毒,不能改善野毒感染状态。要阻断PRV在猪群中的感染,首先要制定合理的免疫程序,如滴鼻免疫与肌肉注射相结合的免疫程序,且只能从仔猪及后备猪开始进行免疫工作,可通过检测育肥猪gE抗体评价疫苗免疫是否到位。
2.4 FMDV抗体检测结果及效果评价
图16显示了猪FMDV抗体检测的基本数据,口蹄疫免疫后阳性率为35%,说明FMDV免疫抗体不佳。由未进行疫苗免疫或者免疫时间过长引起的抗体不足或下降属于正常现象。此时应主动免疫FMD疫苗,否则感染概率较大;如果免疫疫苗时间不长,那么这样的抗体水平须考虑多方面的因素,例如产生抗体的时间不足、免疫抑制、免疫程序不合理或疫苗质量差等。总之母猪群由于疫苗免疫密度较大,这样的免疫抗体水平远远达不到要求。
3 影响疫苗免疫的因素
3.1 疫苗之间的相互影响
不同种类疫苗联合免疫会产生相互干扰,从而影响猪的免疫效果。有学者研究表明,HP-PRRS灭活苗对CSF弱毒苗免疫无明显干扰作用,两者可同时免疫;而PRRS弱毒苗对CSF疫苗的免疫有极显著干扰作用,免疫时CSFV抗体合格率仅为60%,不能达到免疫保护要求;两种疫苗间隔7 d免疫仍有显著干扰作用,但CSF抗体能达到免疫保护要求,PRRS免疫效果较差[1]。这是由于两种病毒受体之间存在竞争作用,其中一种病毒感染机体细胞后产生干扰素,从而影响另一种病毒的复制[2]。此外,PRRS疫苗和O型FMD灭活疫苗不能同时免疫,这可能与检测方法以及母源抗体水平等因素有关。在PRRS对PR疫苗免疫影响的研究中,PRV与PRRSV混合感染占PRV阳性数的94.44%,表明免疫抑制性疾病的存在和流行影响了母猪PRV中和抗体的产生,致使PR疫苗免疫失败或延迟,从而导致混合感染[3]。
3.2 母源抗体的干扰
母源抗体的被动免疫能保护新生仔猪免受病原微生物侵害,但对后期的疫苗免疫会产生一定的干扰作用。多数传染性猪病,仔猪在母源抗体水平较高时进行疫苗免疫,都会受到母源抗体的干扰。CSF母源抗体从28日龄开始加剧下降,半衰期为17 d左右。PRRS母源抗体21日龄开始加剧下降,半衰期为9 d左右[1]。PR母源抗体的半衰期在15 d 左右,在65~75日龄之间下降到最低,保护力也随之消失[4-5]。FMD母源抗体在仔猪10日龄时达到最高水平,45~60日龄时降至不完全保护水平[6]。因此,为避免母源抗体的干擾,确定合适的首免日龄,建立合理的免疫程序尤为重要。首免日龄最好选在仔猪母源抗体不会影响疫苗的免疫效果而又能防御病毒感染的期间,此时接种疫苗效果最佳。
3.3 免疫操作不规范
生产实践中,由于免疫操作不规范造成的免疫失败时有发生,疫苗免疫过程中,注射部位、注射深度、注射剂量以及消毒等因素,都可能导致免疫后抗体水平不整齐或不合格,从而不能起到理想的保护效果。此外,免疫接种前后猪受到环境或其他的应激因素,也可导致猪免疫应答能力减弱,达不到理想免疫效果。
3.4 疫苗质量因素
疫苗质量的好坏直接影响免疫成败。疫苗质量低劣或者在疫苗运输、保存以及使用等过程中操作不规范,都会造成疫苗变质或效价降低,从而导致免疫失败。因此,疫苗选购过程中一定要选择正规企业生产或政府采购疫苗,运输、保存以及使用过程中严格按照说明书进行,保证疫苗免疫的质量和效果,减少免疫失败的发生。
3.5 免疫抑制的影响
免疫抑制是导致免疫失败的主要原因之一,造成机体免疫抑制的因素很多。重金属、放射性辐射、霉菌毒素、应激因素、营养不全以及维生素缺乏等都可引起免疫抑制,从而导致免疫失败。此外,免疫抑制性疾病如PRRS和猪圆环病的感染普遍存在,因此加强疫病监测,消除疫病和应激造成的免疫抑制现象尤为重要。
3.6 饲养管理因素
科学的饲养管理,也会对猪群的免疫造成一定的影响。饲料营养不全价,猪群生产生活环境差,消毒保健等措施不完善等都会使猪的健康水平受到影响,从而导致免疫接种后抗体水平不理想,导致猪群免疫失败。因此科学的饲养管理对提升猪健康水平至关重要。
综上所述,合理的免疫程序、健康的饲养管理环境、优质的疫苗、规范的免疫操作、合理的免疫次数和剂量以及足够的免疫密度是免疫成功的关键。在生产实践中,为达到理想的免疫效果,应该根据该场疫病的发生情况以及当地疫病的流行特点,结合猪群的种类、年龄、饲养管理、母源抗体的干扰以及疫苗的性质、类型和免疫途径等各方面因素,制定适合本场的免疫程序。还应将免疫与监测相结合,通过监测确定合理的首免日龄、免疫次数、免疫剂量以及免疫途径和免疫密度,根据猪群不同时期的跟踪监测评价免疫效果,制定合理的免疫程序,确保免疫的时效性,避免母源抗体的干扰以及疫苗间的相互干扰,科学安排免疫时间,避免盲目免疫。
参考文献:(6篇,略)

