TACE联合小剂量阿帕替尼治疗肝细胞癌合并门静脉癌栓
肖全平,牛焕章,高万勤,杨 海,李东民,杜廷伟,王 彤
(河南科技大学第一附属医院介入科,河南 洛阳 471000)
门静脉癌栓是肝细胞癌(hepatcellular carcinoma, HCC)的严重并发症之一,在HCC患者中发病率约20%~70%[1]。原发性HCC合并门静脉癌栓是目前临床治疗的难点,严重影响患者生存期,如不积极治疗,平均生存期仅6个月左右[2]。现有的治疗方法主要为外科手术切除、射频消融、粒子植入、TACE、放射治疗、门静脉支架置入等,但治疗效果并不理想。控制肿瘤及癌栓进展是延长患者生命的关键。根据巴塞罗那临床肝癌分期(Barcelona clinic liver cancer, BCLC)[3]和2017版原发性肝癌诊疗规范[4],HCC合并门静脉癌栓的推荐治疗方案为TACE、外科手术切除、放射治疗及靶向药物治疗。本研究探讨对临床不可切除的原发性HCC合并门静脉癌栓患者采用TACE联合小剂量阿帕替尼治疗的价值。
1 资料与方法
1.1 一般资料 收集2016年7月—2017年12月90例就诊于我院的临床不可切除原发性HCC合并门静脉癌栓患者,男51例,女39例,年龄78~43岁,平均(55.6±3.1)岁。门静脉癌栓位于门静脉左支28例,右支40例,同时累及左支与右支17例,位于门静脉主干5例。纳入标准:①确诊原发性HCC;②肝功能Child分级为A或B级;③上腹部增强CT证实门静脉癌栓形成(图1A、1B),但有丰富侧支循环;④无法接受外科手术治疗。排除标准:①预计生存期<3个月;②门静脉主干完全阻塞且侧支循环少;③血小板<60×109/L;④近1个月内有脏器出血;⑤凝血功能障碍,国际标准化比值(international normalized ratio,INR)>2.5;⑥心、肺、肾等重要脏器功能不全;⑦碘对比剂过敏。将90例患者随机分为2组,治疗组38例给予TACE联合小剂量阿帕替尼治疗,对照组52例行单纯TACE治疗。2组患者基线资料见表1。
1.2 仪器与方法
1.2.1 对照组 采用Simmens Biplannar Artiz DSA机引导TACE治疗。常规双侧腹股沟区消毒、铺巾,局部麻醉。于右侧腹股沟股动脉搏动最明显处,采用Seldinger技术穿刺,置入5F导管鞘(泰尔茂,日本),经鞘将5F RH导管(Cook公司)置于肠系膜上动脉,行间接门静脉造影,观察门静脉通畅情况及血流方向。而后行腹腔干造影,观察肝总动脉、脾动脉、胃左动脉。再将5F RH导管置于肝总动脉,造影寻找肿瘤供血动脉及其分支血管(图1C)。必要时加行膈动脉、肠系膜上动脉及肾上腺动脉造影。以导管、微导管超选择至肿瘤供血动脉血管后,分别缓慢灌注50 ml稀释的糖化奥沙利铂(0.1 g)及50 ml稀释的水化5-氟尿嘧啶(0.5 g),灌注时间>10 min;而后先采用10 ml碘化油及20 mg表阿霉素混合成的乳化剂进行栓塞,再用栓塞微球进一步栓塞,前向血流停止视为栓塞终点(图1D),结束TACE治疗。

表1 2组患者基线资料比较
1.2.2 治疗组 TACE治疗方法同前。患者于治疗后第3天开始口服阿帕替尼,每日剂量250 mg。
1.3 疗效评价 术后进行随访,随访终点至患者死亡;记录患者术后生存情况。分别于术后1、3、6、12、24个月复查增强CT(图1E),参照改良实体肿瘤疗效评价标准(modified response evaluation criteria in solid tumors, mRECIST)[5]评估疗效:①完全缓解(complete response, CR),肿瘤完全消失;②部分缓解(partial response, PR),肿瘤体积较治疗前缩小>50%;③稳定(stable disease, SD),肿瘤体积较治疗前增大≤25%或缩小≤50%;④进展(progressive disease, PD),肿瘤体积较治疗增大>25%。计算治疗有效率,有效率(%)=CR+PR/(CR+PR+SD+PD)×100%。此后每1、3、6、12、24个月复查一次增强CT。并分别于治疗前及治疗后1、3、6、12个月进行甲胎蛋白检测。随访期间如发现肿瘤复发则再次进行介入治疗。
记录术后并发症情况。并根据美国国家癌症研究所(National Cancer Institute, NCI)癌症常见毒性反应事件评价标准(即NCI CTC v4.0)[6];如有其中未列出的指标,则判断标准如下:1级,仅有不舒服感觉但不影响正常活动;2级,感觉不舒服且影响正常活动;3级,不能正常活动或工作;4级,致残或致死。
1.4 统计学分析 采用SPSS 16.0统计分析软件。计量资料以±s表示,2组间比较采用独立样本t检验;计数资料以百分率表示,采用χ2检验进行比较。采用Kaplan-Meier法进行生存分析,以Log-rank法比较2组间生存率。P<0.05为差异有统计学意义。
2 结果
2组患者TACE治疗的技术成功率均为100%。对治疗组累计介入栓塞75次,每例患者(1.87±0.14)次;对照组累计介入栓塞198次,每例患者(3.81±0.68)次。术后平均随访时间为(18.68±4.02)个月。
2组间治疗前甲胎蛋白水平差异无统计学意义(t=20.15,P=0.08),而治疗后1、3、6、12个月治疗组甲胎蛋白水平均较对照组均明显下降(P均<0.05),见表2。
表2 2组患者治疗前后甲胎蛋白水平比较(±s, μg/L)
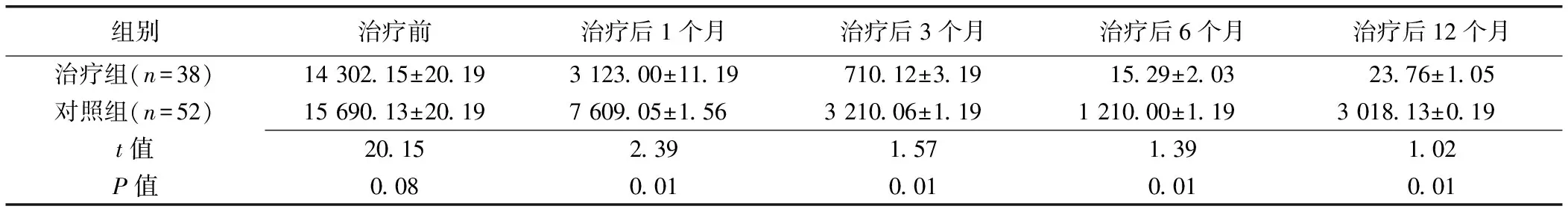
表2 2组患者治疗前后甲胎蛋白水平比较(±s, μg/L)
组别治疗前治疗后1个月治疗后3个月治疗后6个月治疗后12个月治疗组(n=38)14 302.15±20.193 123.00±11.19710.12±3.1915.29±2.0323.76±1.05对照组(n=52)15 690.13±20.197 609.05±1.56 3 210.06±1.191 210.00±1.193 018.13±0.19t值20.152.391.571.391.02P值0.080.010.010.010.01

图1患者男,56岁 HCC合并门静脉癌栓 A.上腹部增强CT动脉期示肝右后叶HCC; B.门静脉期可见门静脉右支癌栓形成(箭); C.TACE术中造影示HCC肿瘤染色明显,血供丰富,血管湖形成(箭),门静脉右支癌栓亦可见染色(箭头); D.以碘化油及表阿霉素乳化剂栓塞后,再用100~300 μm微球栓塞肿瘤供血动脉,造影示碘油沉积良好,肿瘤染色消失; E.TACE联合小剂量阿帕替尼治疗6个月后复查上腹部增强CT示碘化油沉积良好,肿瘤明显缩小2组间术后不同时间疗效差异均有统计学意义(P均<0.05,表3)。治疗组术后1、3、6、12、24个月肿瘤治疗有效率分别为89.47%(34/38)、84.21%(32/38)、78.95%(30/38)、34.21%(13/38)和10.53%(4/38);而对照组仅为75.00%(39/52)、67.31%(35/52)、25.00%(13/52)、3.85%(2/52)和19.23%(10/52)。治疗组生存期为15~30个月,平均(17.12±1.55)个月;对照组生存期为13~25个月,平均 (14.21±2.13)个月;2组患者生存期差异有统计学意义(t=1.85,P=0.01,图2)。
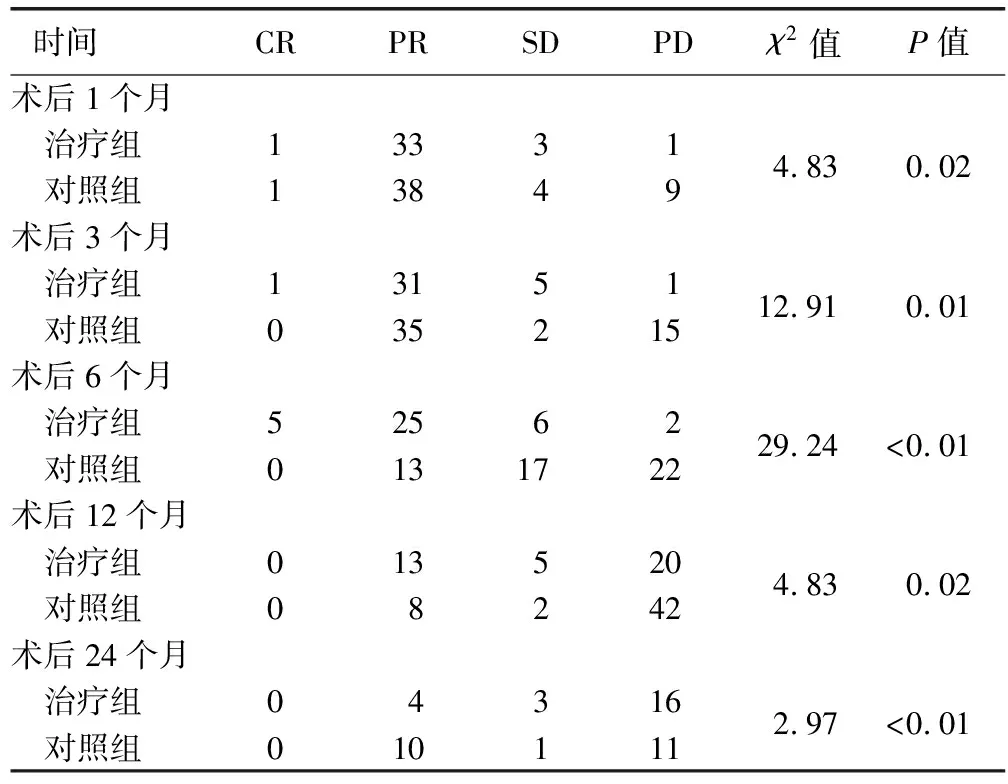
表3 术后随访疗效评价结果(例)
注:治疗组38例中,随访至术后1、3、6、12个月时均无死亡病例,术后24个月死亡15例;对照组52例中,随访至术后1、3、6、12个月时均无死亡病例,术后24个月死亡30例
2组中均无肝脓肿、肝性脑病、肝衰竭等严重术后并发症发生;患者术后不良反应发生情况见表4。腹痛在对照组中发生率最高,为96.15%(50/52);而转氨酶升高在治疗组中最为常见,占92.11%(35/38)。除恶心、呕吐(χ2=9.13,P=0.35)外,治疗组其他不良反应发生率均明显高于对照组(P均<0.01)。
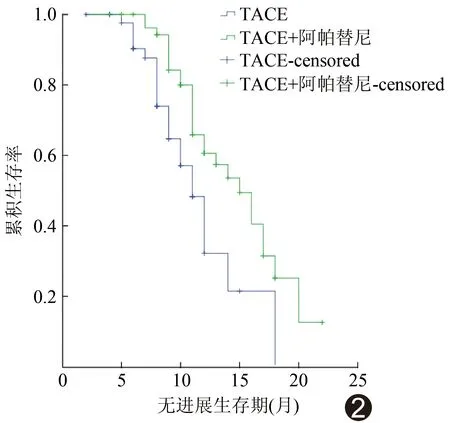
图2 TACE联合小剂量阿帕替尼治疗HCC合并门静脉癌栓患者生存曲线
3 讨论
门静脉癌栓作为HCC的一种严重并发症,如不积极治疗,将严重威胁患者生命[7]。HCC合并门静脉癌栓的治疗是临床难题,总体治疗效果差,外科手术切除是目前首选治疗方法,但多数HCC起病隐匿,发现时已属中晚期,失去手术机会[8]。TACE是治疗中晚期HCC的有效方法,通过栓塞肿瘤及癌栓的供血动脉,达到控制肿瘤生长的目的。但TACE治疗也存在栓塞不彻底或术后肿瘤新生血管形成,从而影响疗效的可能[2]。肿瘤新生血管提供的氧和营养物质可为肿瘤细胞再生、肿瘤复发及转移提供基础[9],血管内皮生长因子-2(vascular endothelial growth factor-2, VEGF-2)与肿瘤复发关系密切[10]。阿帕替尼是一种小分子酪氨酸激酶抑制剂,其主要作用是抑制肿瘤血管生成。阿帕替尼在人体生物利用度高,安全性良好,其对多种类型肿瘤的控制作用已被证实[11]。一项临床Ⅱ期研究[12]表明阿帕替尼对晚期HCC患者具有潜在生存获益,将121例患者随机分配至阿帕替尼每日剂量850 mg组和750 mg组,结果显示中位生存期分别为9.7个月和9.8个月,肿瘤治疗有效率分别为48.57%和37.25%。本研究随访发现治疗组术后1、3、6、12、24个月肿瘤有效控制率为89.47%(34/38)、84.21%(32/38)、78.95%(30/38)、34.21%(13/38)和10.53%(4/38);而同期对照组分别为75.00%(39/52)、67.31%(35/52)、25.00%(13/52)、3.85%(2/52)和19.23%(10/52)。治疗组优于对照组,分析原因为TACE术后口服阿帕替尼抑制肿瘤血管再生、抑制肿瘤复发。
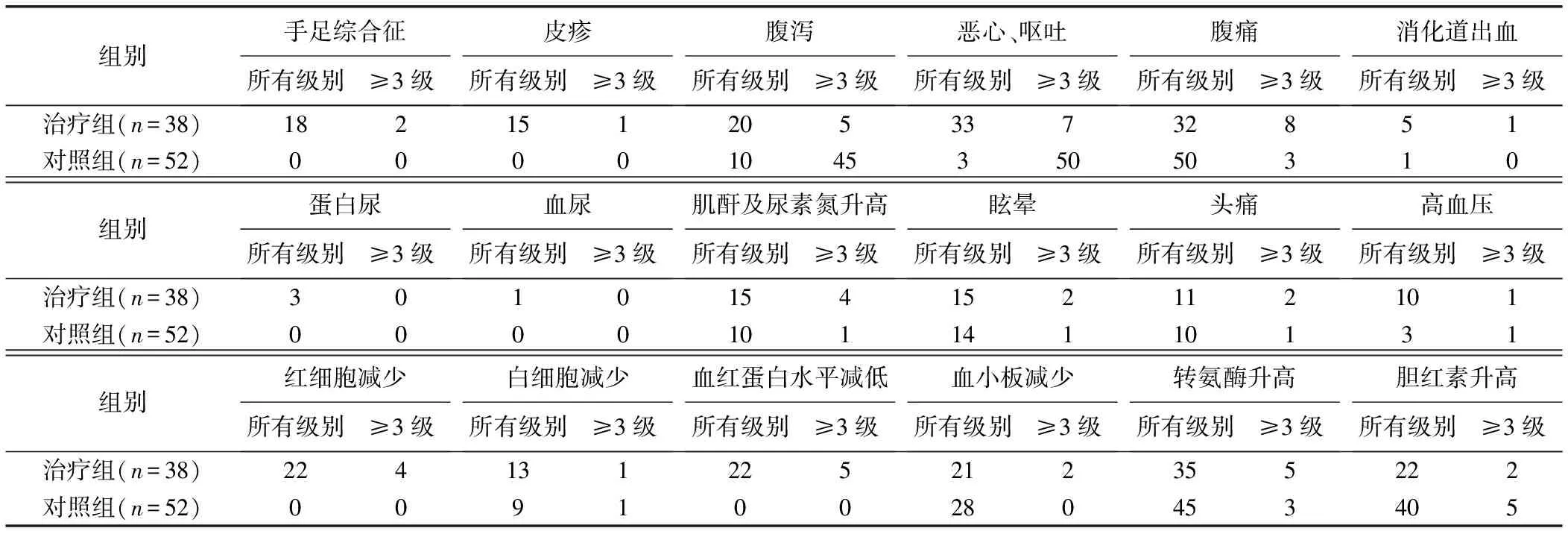
表4 2组患者术后不良反应发生情况(例)
绝大部分HCC肿瘤及其合并门静脉癌栓由动脉血管滋养,通过增强CT扫描可发现这一现象[13],这亦可能是TCAE术后口服阿帕替尼后癌栓趋于稳定的原因之一。本研究口服阿帕替尼后TACE平均治疗次数为(1.87±0.14)次,且肿瘤及门静脉癌栓趋于稳定,而单纯TACE的平均治疗次数为(3.81±0.68)次,且术后肿瘤易复发、门静脉癌栓有进展趋势,其主要原因为术后肿瘤新生血管形成,也可能与频繁TACE治疗刺激肿瘤细胞转移有关。频繁的TACE治疗会引起肝脏储备下降,致使肝功能恶化。因此,在控制肿瘤进展的前提下,应尽量减少TACE治疗次数。甲胎蛋白是HCC较为特异的指标,本研究发现术后1、3、6、12个月,治疗组较对照组甲胎蛋白水平均明显下降,且治疗组患者术后生存期明显长于对照组,表明TACE术后小剂量阿帕替尼治疗较单纯TACE治疗的中远期疗效更好,与金鑫荔等[14]的研究报道相符。
但阿帕替尼为多靶点抗肿瘤靶向药,不良反应较多,其中以高血压、手足综合征、蛋白尿较常见[15-17]。阿帕替尼的常规剂量为每日500 mg,但其不良反应致使部分HCC患者尤其是老年HCC患者无法适应。研究[18]报道,每日分2次口服阿帕替尼500 mg(每次250 mg)的患者中治疗相关3级以上高血压、手足综合征、蛋白尿发生率为4.5%、8.5%、2.3%;本研究中,治疗组患者口服小剂量阿帕替尼(每日250 mg),上述3级以上不良反应发生率为2.63%(1/38)、5.26%(2/38)、0。小剂量阿帕替尼骨髓抑制致使红细胞、白细胞及血小板减少的发生率分别为57.89%(22/38)、34.21%(13/38)、55.26%(21/38),其中3级以上的发生率为10.53%(4/38)、2.63%(1/38)、5.26%(2/38),通常1级或2级的不良反应经对症处理后症状均可缓解,但对发生3级以上不良反应者需暂时停药观察,如症状缓解可继续口服原始剂量,如无缓解则终止用药;对于重度骨髓抑制,尤其血小板低于50×109/L者,应立即停药。
本研究发现小剂量阿帕替尼亦有明显抑制肿瘤作用,且多数术后不良反应较为轻微,3级以上不良反应较少,患者更易耐受;TACE联合小剂量阿帕替尼相对于单纯TACE治疗HCC合并门静脉癌栓,对肿瘤的抑制作用更强且患者生存期更长。但本研究由于样本较小、随访时间有限,2组患者同质性很难做到完全一致,仍需今后大样本、长时间随访研究。

