合作猪 IFN-β基因编码区克隆及生物信息学分析
谢开会,王 伟,杨姣姣,闫尊强,杨巧丽,滚双宝,
(1. 甘肃农业大学 动物科学技术学院,兰州 730070;2. 甘肃省现代养猪工程技术研究中心,兰州 730070)
干扰素(Interferon,IFN)是由宿主细胞对病原体如肿瘤细胞、病毒、细菌等作出反应而产生的一组信号蛋白[1]。根据其结构和来源不同可分为3种:I 型、Ⅱ 型和 Ⅲ 型[2],I型(病毒干扰素)包括IFN-α、IFN-β、IFN-δ、IFN-ω、IFN-κ、IFN-ε、IFN-ζ和IFN-τ;Ⅱ型(免疫干扰素)为IFN-γ;Ⅲ 型为IFN-λ,猪干扰素(Porcine interferon, PoIFN)包括 IFN- α、IFN-β、IFN-ω、IFN-ε、IFN-δ和 IFN- γ。
β型干扰素(Interferon-beta, IFN-β)主要由上皮细胞和成纤维细胞在病毒或其他类型外来核酸的作用下产生[3]。IFN-β具有多种生物学功能:①免疫调节,IFN-β能够增强MHC Ⅰ类分子表达,但抑制MHC Ⅱ类分子表达,而IFN-γ可促进 MHC Ⅱ类分子表达,两种干扰素相互协同,使机体的免疫应答状态达到最佳[4];②抗肿瘤,有研究发现,IFN-β对多发性骨髓瘤[5]、肝细胞癌[6]、人肾上腺皮质癌[7]等多种恶性肿瘤具有明显的抑制和杀伤作用; ③抗病毒,PoIFN-β对猪伪狂犬病病毒(PRV)[8]、水泡性口炎病毒(VSV)、口蹄疫病毒(FMDV)[9]和猪传染性胃肠炎病毒[10]有一定的抑制作用。目前,IFN-β基因已在虎[11]、犬[12]、鸡[13]和水貂[14]等动物上成功克隆,并且在一些猪品种(从江香猪[15]、新兴猪[16]、巴马猪[17]、梅山猪[18]和长白猪[19])上也成功克隆,这些研究表明不同物种的IFN-β性质和结构有所不同,且在不猪种中IFN-β的性质、结构及氨基酸序列有微小差异,这些差异可能与猪的抗病性强弱有关。
合作猪又称蕨麻猪,其特有的基因型是其他猪种所不具备的,是中国重要的遗传多样性基因资源库。目前,关于合作猪的研究主要集中在肉质方面,李富强等[20]成功克隆了合作猪IFN-γ基因,但IFN-β基因在合作猪上鲜有研究。因此,本研究以合作猪耳组织cDNA为模板,克隆IFN-β基因的编码区,通过生物信息学方法,分析IFN-β蛋白的理化性质、二级结构、三级结构及物种间的同源性和进化关系,为深入研究猪IFN-β基因的生物学活性奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 样品 采集合作猪耳组织样本,液氮速冻,-80 ℃超低温冰柜保存。
1.1.2 主要试剂 反转录试剂盒(6210A)和pMD19-T Vector购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒(DP209-02)和2×TaqMaster Mix、DH5α感受态细胞购自天根生化科技(北京)有限公司。
1.2 试验方法
1.2.1 引物设计与合成 在 NCBI/ GenBank中获得猪IFN-β基因(登录号:NM_001003923.1)序列,并用DNAMAN对基因编码区设计引物,F:5′-ATGGCTAACAAGTGCATCCTC-3′;R:5′-CAGTTCCGGAGGTAATCTGTA-3′,由苏州金唯智生物科技有限公司合成。
1.2.2 RNA提取及反转录 利用Trizol/氯仿法提取样本的总RNA,并测定其OD值和质量浓度。参照反转录试剂盒(6210A)说明书将RNA 反转录为cDNA,-20 ℃保存,备用。
1.2.3 PCR扩增 PCR反应体系20 μL:cDNA模板2 μL,上、下游引物各1 μL,2×TaqMaster Mix 10 μL,无菌水6 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性45 s,60 ℃退火45 s, 72 ℃延伸1 min,共30个循环;72 ℃终延伸 10 min,4 ℃保存。
1.2.4 基因克隆及测序 PCR 产物经 10 g/L的琼脂糖凝胶电泳检测(180 V,35 min)。按照 DP209-02 凝胶回收试剂盒操作说明书,对目的片段进行回收纯化。将纯化产物与 pMD19-T载体相连接,连接产物转入DH5α感受态细胞上,反应完成后,将菌液均匀涂抹于含有氨苄青霉素(AMP+)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-Gal)和异丙基-β-D-硫代吡喃半乳糖苷(IPTG)的LB固体培养基上,37 ℃培养过夜。挑取白色单菌落,加入到含有AMP+的100 mL LB液体培养基中,摇菌10 h,吸取 2 μL 用于菌液PCR,将菌液PCR产物送至苏州金唯智生物科技有限公司测序。
1.2.5IFN-β基因生物信息学分析 利用多种在线软件和数据库对克隆测序得到的IFN-β基因编码区序列进行分析(表1);在NCBI/ GenBank中下载一些物种IFN-β的核酸序列:人(NM_002176)、家鼠(NM_010510)、牛(NM_174350)、猕猴(NM_001135795)、黑猩猩(XM_528553)、狗(NM_001135787)马(M14546)、疣猪(JN391529)、梅山猪(AY687281)和巴马猪(KJ147517.1),用MEGA 7.0软件构建系统进 化树。
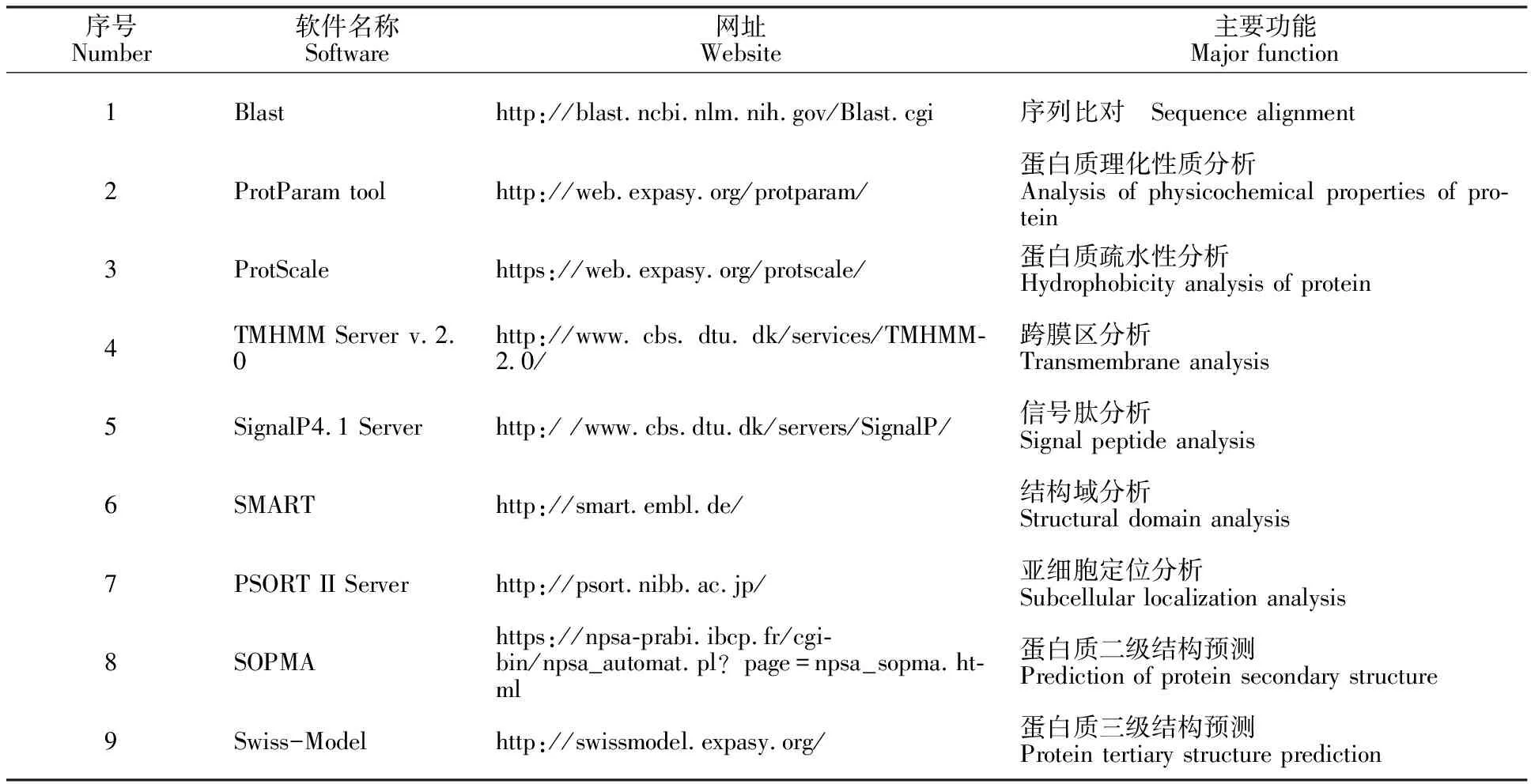
表1 预测蛋白质结构和功能应用的网站及软件Table 1 Websites and softwares for predicting protein structure and function
2 结果与分析
2.1 合作猪 IFN-β基因PCR扩增
以合作猪耳组织cDNA为模板进行PCR扩增,扩增产物经10 g/L的琼脂糖凝胶电泳检测,获得特异性条带约 561 bp (图1),与预期目的片段相符合。

M.DNA分子质量标准(DL2000) DNA molecular mass standard(DL2000); 1.IFN-β基因PCR产物 PCR products ofIFN-βgene
图1 合作猪IFN-β基因PCR扩增结果电泳图
Fig.1 Electrophoretogram ofIFN-β
gene in Hezuo pig by PCR
2.2 测序结果分析
经克隆测序后获得合作猪IFN-β基因完整的CDS 区序列,长度为561 bp,编码186个氨基酸。该序列与参考序列的同源性为99.82%,且CDS区第177位点处的C突变为T(图2),但其编码氨基酸没有发生改变,为同义突变。
2.3 合作猪 IFN-β基因生物信息学分析
2.3.1 合作猪IFN-β基因同源性分析 使用Blast软件分析合作猪IFN-β基因的同源性,结果如表2所示。使用MEGA 7.0软件以合作猪、梅山猪、疣猪、牛和马等的IFN-β核酸序列构建分子进化树。结果显示,合作猪与梅山猪的亲缘关系最近,其次为巴马猪和疣猪(图3)。

图2 合作猪IFN-β核苷酸序列与参考序列比对Fig.2 Comparison of IFN-β nucleotide sequence in Hezuo pig and reference sequence

物 种Species 核酸序列相似性Nucleic acid sequence similarity氨基酸序列相似性Amino acid sequence similarity人 Homo sapiens(NM_002176)77.8864.71家鼠 Mus musculus(NM_010510)-46.24牛 Bos taurus(NM_174350)77.9859.68猕猴 Macaca mulatta(NM_001135795)77.8665.24黑猩猩 Pan troglodytes(XM_528553)77.7064.71狗 Canis lupus(NM_001135787)78.6462.37马 Equus caballus(M14546)80.7166.13疣猪 Phacochoerus africanus(JN391529)98.7599.46梅山猪 Meishan pig(AY687281)99.82100巴马猪 Bama pig(KJ147517.1)99.4798.39

图3 IFN-β系统进化树Fig.3 Phylogenetic tree of IFN-β
2.3.2 合作猪IFN-β基因编码蛋白的理化性质分析 用ProtParam软件预测合作猪IFN-β蛋白的理化性质,结果显示合作猪IFN-β蛋白由186个氨基酸组成,分子式为C980H1551N253O289S14,分子质量为21.95 ku ,理论等电点(PI)为4.93,消光系数(γ=280 nm)为 23 170,不稳定系数为62.91,在哺乳动物网织红细胞中的半衰期为 30 h,平均疏水性为 -0.172,说明该蛋白是不稳定的酸性亲水蛋白。氨基酸残基中亮氨酸 (14.00%)和谷氨酸(9.10%)含量较高(图4),带负电荷的天冬氨酸残基(Asp) 和谷氨酸残基(Glu)为25个,带正电荷的精氨酸残基(Arg)和赖氨酸残基(Lys)为18个。

图4 合作猪IFN-β蛋白中各氨基酸的组成Fig.4 Composition of various amino acids in IFN-β protein of Hezuo pig
2.3.3 合作猪IFN-β基因编码蛋白亲水性/疏水性分析 利用ProtScale软件对合作猪IFN-β的亲/疏水性进行分析,结果显示大部分氨基酸为负值,亲水性氨基酸为62.90%,疏水性氨基酸为37.10%,第9和10位氨基酸分值最高为2.567,第71位氨基酸分值最低为 -2.422(图5)。
2.3.4 合作猪IFN-β基因编码蛋白跨膜结构域分析 使用TMHMM Server v.2.0分析合作猪IFN-β蛋白跨膜区域,结果显示,该蛋白有1个跨膜区域,属于跨膜蛋白(图6)。
2.3.5 合作猪IFN-β基因编码蛋白信号肽分析 利用SignalP 4.1进行信号肽预测,结果显示,信号肽酶切位点分值(C)为0.796,剪切位点分值(Y)为0.838,信号肽(S)分值为0.947,S>0.5,说明该蛋白含有信号肽,前21个氨基酸为信号肽序列(图7)。

图5 合作猪IFN-β蛋白的疏水性Fig.5 Hydrophobicity of IFN-β protein in Hezuo pig
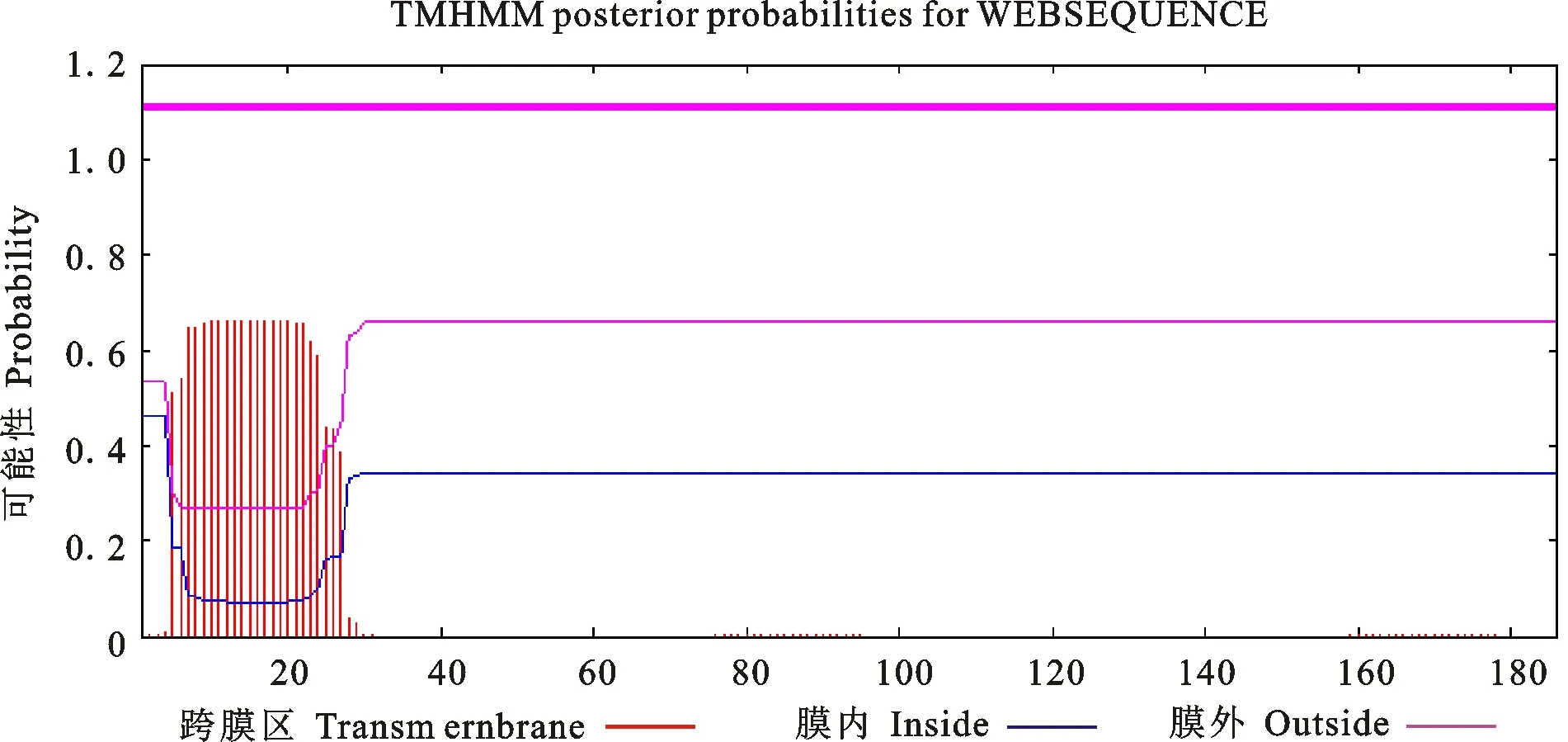
图6 合作猪IFN-β蛋白的跨膜区域Fig.6 Transmembrane domain of IFN-β protein in Hezuo pig

图7 合作猪IFN-β蛋白的信号肽Fig.7 Signal peptide of IFN-β protein in Hezuo pig
2.3.6 合作猪IFN-β基因编码蛋白结构域分析 采用SMART软件对合作猪IFN-β蛋白进行分析。结果表明,该蛋白在58~174位氨基酸处存在一个IFabd结构域(图8)。
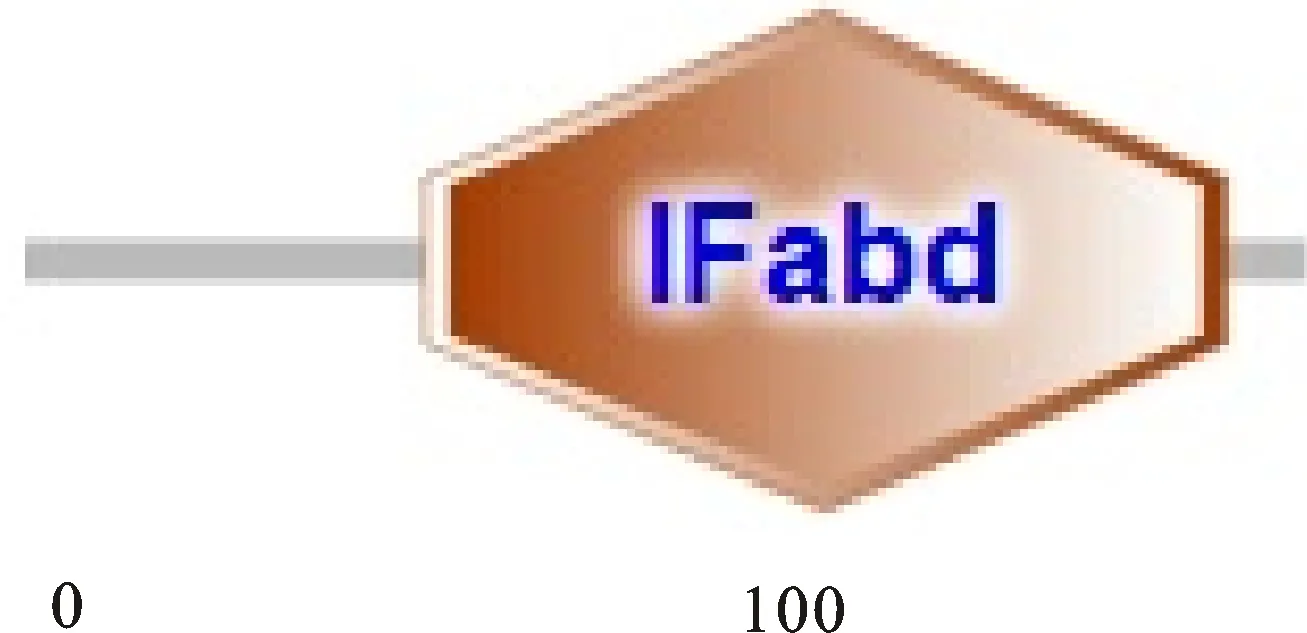
图8 IFN-β 的 SMART 结构预测Fig.8 Structural prediction of IFN-β in SM ART
2.3.7 合作猪IFN-β基因编码蛋白亚细胞定位 采用PSORT II软件对合作猪IFN-β蛋白进行亚细胞定位。结果表明,合作猪IFN-β蛋白分布在细胞外、线粒体、内质网和囊泡的可能性分别为66.70%、11.10%、11.10%和11.10%。
2.3.8 合作猪IFN-β基因编码蛋白二级结构分析 采用SOPMA在线软件对合作猪IFN-β蛋白的二级结构进行预测,结果表明,合作猪IFN-β蛋白的二级结构由75.81%的α-螺旋、1.61%的伸展链、2.69%的β-转角和19.89%的无规则卷曲构成(图9)。

h.α- 螺旋 Alpha helix;e.伸展链V Extend strand;t.β- 转角 Beta bridge;c.无规则卷 Random coil
2.3.9 合作猪IFN-β基因编码蛋白三级结构预测分析 采用在线软件 SWISS-MODEL 对合作猪IFN-β蛋白进行同源建模,预测其三级结构。结果显示,该蛋白的三级结构主要由 α-螺旋、无规则卷曲构成(图10),与二级结构预测基本 一致。
3 讨 论
干扰素是一类能诱导动物细胞产生多种广谱抗病毒蛋白的细胞因子,具有阻止病毒繁殖、调节机体免疫反应等生物学功能[21]。有研究发现,在干扰素中,IFN-β对重症急性呼吸综合征(SARS)病毒抑制效果最强,治疗效果更好[22]。IFN-β还可以抑制甲型流感病毒的增殖,感染细胞的初期使用 IFN-β,能诱导细胞产生 IFN-α,间接地增强细胞抵御病毒进一步感染的能力[23],可以作为一种良好的生物制剂。本研究以合作猪耳组织的cDNA为模板,克隆测序得到其IFN-β基因的CDS区,序列全长为561 bp,编码186个氨基酸,与参考序列(登录号:NM_001003923.1)基本一致,合作猪IFN-β仅在CDS区的第177位点处发生突变(C→T),而其编码氨基酸没有发生改变,属于同义突变,这表明IFN-β的核酸序列和氨基酸序列在不同品系猪中具有高度的保守性。
本研究中,生物信息学分析结果表明,合作猪IFN-β蛋白包括含有21个氨基酸残基的信号肽序列和165个氨基酸残基的成熟多肽序列,这与已经证实的猪IFN-β信息一致[24]。分子质量为21.95 ku,与已克隆巴马猪的分子质量(22 ku)基本一致,但低于人IFN-β的分子质量(23 ku),理论等电点(PI)为4.93,为酸性蛋白。蛋白不稳定系数为62.91,大于40,属于不稳定蛋白。疏水性分析发现,IFN-β蛋白中亲水性氨基酸为 62.90%,疏水性氨基酸为37.10%,在维持蛋白质三级结构中起重要作用。该蛋白在58~174位氨基酸处存在一个结构域:IFabd (Interferon alpha, beta and delta) 结构域,该结构域是IFN家族的特征结构域,为细胞因子受体结合区域,其通过与细胞表面的受体相互作用调节细胞活性,激活各种信号通路,参与抗病毒和免疫调节反应[25]。同源性比对发现,合作猪IFN-β的核酸序列与巴马猪、梅山猪和疣猪的同源性为99.47%、99.82%和98.75%,氨基酸序列的同源性为 98.39%、100%和99.46%,合作猪IFN-β的第13、43和68位氨基酸分别为甲硫氨酸(Met)、谷氨酸(Glu)和脯氨酸(Pro),巴马猪的第13、43和68位氨基酸分别为缬氨酸(Val)、甘氨酸(Gly)和丝氨酸(Ser),说明不同猪种的IFN-β有微小差异,这些差异是否决定猪的抗病性强弱,还需深入研究。有研究发现,人IFN-β第42位或43位谷氨酸发生突变时,使IFN-β 部分或全部功能丧失[26],而且Glu 43 被认为是重要功能抗原表位的一部分。本研究分析发现合作猪IFN-β蛋白序列的第43位为Glu,再次证明IFN-β在免疫反应中发挥重要作用。分子进化树也表明,合作猪与梅山猪亲缘关系最近,与家鼠亲缘最远,说明IFN-β具有种属特异性。IFN-β在蛋白结构上属于螺旋型细胞因子家族成员,这与合作猪IFN-β蛋白三级结构预测结果基本一致,其主要包含5个α-螺旋 (75.81%)。
干扰素是第一个被克隆化,并用与临床疾病治疗的细胞因子[27]。有关研究表明,将细胞因子与保护性抗原基因共表达而研制成的基因工程制剂,是提高机体免疫效果,抑制病毒在机体内表达的有效手段之一[28]。本研究对合作猪IFN-β基因的编码区进行克隆和序列分析,为进一步研究IFN-β基因的生物活性奠定基础,同时对研究IFN-β在猪免疫系统和抗病毒方面的影响具有重要价值。
4 结 论
本研究发现合作猪IFN-β基因CDS区全长为561 bp,编码186个氨基酸,编码蛋白属于干扰素ab超家族,是不稳定的酸性亲水性蛋白,含有信号肽和跨膜区,属于分泌蛋白。

