载柚皮素的牛血清白蛋白修饰PLGA 纳米粒的制备
王建筑,毕研平,李 菲,陈 莹
[山东第一医科大学(山东省医学科学院) 药学院,山东 泰安271016]
柚皮素是二氢黄酮类化合物,具有抗菌、抗炎、抗氧化、抗纤维化、抗癌、抗肿瘤、抗病毒等多种药理活性[1-6],但该成分脂溶性和水溶性均较差,并且在家兔体内的生物利用度以游离柚皮素计算仅为4%[7],体内吸收差、生物利用度低等因素使其临床应用受到一定限制[8]。纳米给药系统因其微小的粒径和特殊的结构而具有一系列独特优势,可通过不同载体来显著增加难溶性药物溶解性,并提高其口服生物利用度,此外还能明显改善释药特性。目前,改善柚皮素溶解度、生物利用度的方法主要有固体脂质纳米粒[9-10]、胶束[11]、纳米乳[12]等。
聚乳酸-羟基乙酸共聚物(PLGA)是一类可降解的共聚物,安全性高,生物相容性良好[13-14],孙雅楠[15]等采用纳米沉淀法结合脂质体挤压法成功制备了红细胞膜包裹PLGA 纳米粒,发现它具有明显的壳-核结构,可使药物具有缓释作用,而且体外毒性显著降低。目前,制备PLGA 纳米粒时需要加入适量稳定剂以防止自我聚集,常用的有聚维酮(PVP)、聚乙烯醇(PVA)等,但这些稳定剂难以彻底清除,而且对人体具有一定毒性。牛血清白蛋白是由疏水性氨基酸残基和亲水性氨基酸残基构成,作为药物载体具有安全无毒、无免疫原性、生物相容性好等优点,在体内具有天然独特的靶向性和缓释性。在采用乳化溶剂挥发法制备PLGA 纳米粒过程中,白蛋白可利用自身多个疏水性结合部位与疏水PLGA 的结合,从而起到“表面活性剂”的作用,同时在纳米粒的表面利用二硫键作用形成交联结构,包裹在纳米粒的表面而形成一层蛋白层[16],此外还可选择其作为稳定剂增加纳米粒稳定性。
本实验将制备载柚皮素的牛血清白蛋白修饰PLGA 纳米粒,既可增加药物溶解性,又能利用微球缓释性来解决药效短、频繁给药的问题,并对该纳米粒进行结构表征以确认其结构,最后探究其体外释药行为,为柚皮素临床应用奠定基础。
1 材料
柚皮素(含有量98%,陕西慧科植物开发有限公司)。聚乳酸-羟基乙酸共聚物(PLGA)(50 ∶50,分子量30 000 Da,济南岱罡生物工程有限公司);牛血清白蛋白(合肥博美生物科技有限责任公司)。PC-2006高效液相色谱仪(大连依利特分析仪器有限公司);激光粒度分析仪(英国Malvern 公司);IR Affinity-15傅立叶变换红外光谱仪(日本岛津公司);JY92-2D 超声波细胞粉碎机(宁波新芝生物科技股份有限公司);超滤管(0.5 mL,3 kD,美国Millipore 公司);透析袋(截留分子量8 000~14 000 Da)。
2 方法
2.1 纳米粒制备 采用乳化溶剂挥发法制备。精密称取4 mg 柚皮素和适量PLGA,溶于2 mL氯仿/乙醇(4 ∶1)中作为油相,在搅拌下将其缓慢滴加到8 mL 20 mg/mL 牛血清白蛋白溶液中,冰水浴探头超声(600 W)4 min 乳化分散,形成O/W 型纳米乳,室温下置于电磁搅拌器上继续搅拌4 h,得到带有蓝色乳光半透明的胶体溶液,再将其置于超速冷冻离心机内离心(18 000×g)30 min,去离子水重新分散后冷冻干燥,即得。
2.2 包封率、载药量测定
2.2.1 色谱条件 Hypersil ODS C18色谱柱(250 mm×4.6 mm,5 μm);流动相0.1% 磷酸-乙腈(55 ∶45);体积流量1.0 mL/min;检测波长288 nm;柱温25 ℃;进样量20 μL。
2.2.2 方法学考察 精密称取柚皮素适量,流动相配制成2、4、8、16、32、64 μg/mL,在“2.2.1”项色谱条件下进样测定,以峰面积(Y)对溶液质量浓度(X)进行线性回归,并测定其精密度和加样回收率。
2.2.3 测定方法 取纳米粒6 mg,加入2 mL 纯水复溶,取0.4 mL 置于超滤管中,3 000×g离心10 min,取100 μL 超滤液加900 μL 甲醇适当稀释,HPLC 法测定未被PLGA 包封的药量。另取复溶后PLGA 纳米粒混悬液100 μL,加900 μL 乙腈溶解破坏纳米粒涡 旋 30 s,超 声 5 min,15 000 r/min高速冷冻离心10 min 沉淀蛋白,取上清液,HPLC 法测定柚皮素总药量。取适量混悬液进行冷冻干燥,称定冻干品质量,按下式计算包封率、载药量。
包封率=[(m总-m包)/m总]×100%,载药量=[(m总-m包)/m]×100%。其中,m包为纳米粒中包裹药物量,m总为总药量,m为纳米粒总质量。
2.2.4 粒径、PDI 测定及形态观察 将复溶后的纳米粒用纯水适当稀释后,马尔文激光粒度分析仪测定其粒径和PDI。再取适量滴在铜网上,纯水清洗,自然晾干后2%磷钼酸钠溶液负染,晾干后置于透射电镜(TEM)下观察纳米粒形态大小,并进行拍照。
2.2.5 稳定性考察 纳米粒冻干样品中加入纯水和磷酸盐缓冲液(pH=7.4)复溶,并稀释至制备时的浓度,冰箱冷藏室(4 ℃)中放置14 d,观察其粒径、PDI、包封率变化。
2.2.6 体外释放行为 取纳米粒冻干粉加纯水复溶、柚皮素乙醇溶液各约2 mL(均含柚皮素约1 mg)加到处理好的透析袋中,两端扎紧,将其完全浸没到37 ℃100 mL 体外释放液[含0.5%吐温-80的磷酸盐缓冲液(pH=7.4)]中搅拌(100 r/min),于0.25、0.5、1、1.5、2、3、4、5、6、7、8、10、12、24 h 各取样1 mL,并补充新鲜释放介质,微孔滤膜过滤,HPLC 法测定柚皮素含有量,计算累积释放度。
3 结果
3.1 方法学考察 柚皮素回归方程为Y=48.39X+2.38(r=0.999 3),在2~64 μg/mL 范围内呈良好的线性关系,而且该方法精密度(RSD<3%)和平均加样回收率(97%~103%,RSD<5%)均符合相关要求。
3.2 制备工艺优化
3.2.1 超声功率 选择15 mg/mL 牛血清白蛋白溶液8 mL 作为水相,25 mg PLGA(50 ∶50)溶于2 mL 氯仿/乙醇(4 ∶1)中作为油相,超声时间4 min,考察超声功率400、500、600、700 W,结果见表1。由表可知,随着超声功率增加粒径、PDI 呈减小趋势,但变化不明显,故选择600 W 作为超声功率。
3.2.2 超声时间 选择“3.2.1”项下水相和油相,超声功率600 W,考察超声时间3、4、5、6 min,结果见表2。由表可知,超声时间4 min 后粒径、PDI 基本稳定,故选择4 min 作为超声时间。
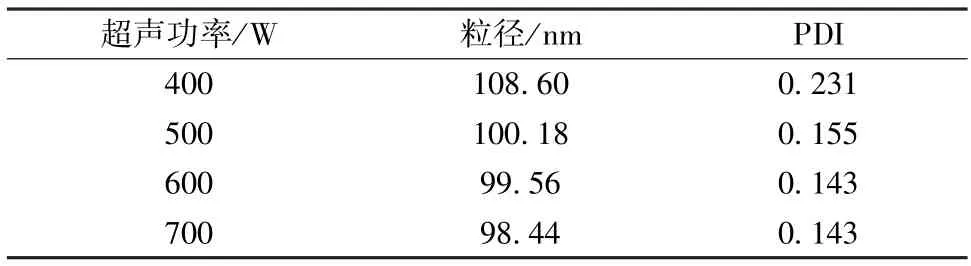
表1 超声功率对粒径、PDI 的影响(n=3)Tab.1 Effects of ultrasonic power on particle size and PDI(n=3)
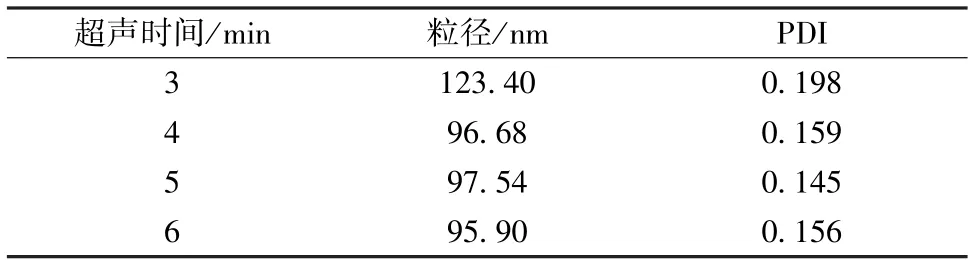
表2 超声时间对粒径、PDI 的影响(n=3)Tab.2 Effects of ultrasonic time on particle size and PDI(n=3)
3.2.3 牛血清白蛋白质量浓度 选择“3.2.1”项下油相,水相体积8 mL,超声功率600 W,超声时间4 min,考察牛血清白蛋白质量浓度10、15、20、25 mg/mL,结果见表3。由表可知,牛血清白蛋白质量浓度对粒径、包封率影响较大,可能是由于它作为表面活性剂,在油水两相乳化时会影响纳米乳形成,从而影响纳米粒质量,故选择20 mg/mL 作为牛血清白蛋白质量浓度。
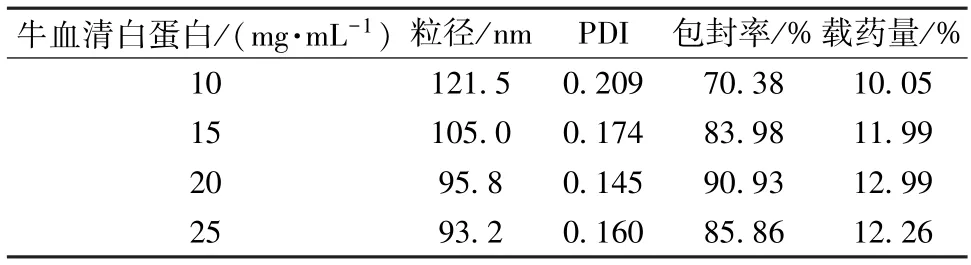
表3 牛血清白蛋白质量浓度对粒径、PDI、包封率、载药量的影响(n=3)Tab.3 Effects of bovine serum albumin concentration on particle size,PDI,encapsulation efficiency and drug loading(n=3)
3.2.4 PLGA 质量浓度 选择“3.2.1”项下水相,PLGA 溶于溶于氯仿/乙醇(4 ∶1)中作为油相,超声功率600 W,超声时间4 min,考察PLGA质量浓度50、25、12.5、6.25 mg/mL,结果见表4。由表可知,低质量浓度(6.25 mg/mL)时粒径、包封率明显小于其他质量浓度;高质量浓度(25、50 mg/mL)时粒径明显大于中质量浓度(12.5 mg/mL),但包封率无明显变化,故选择12.5 mg/mL 作为PLGA 质量浓度。
3.2.5 油水相比例 选择20 mg/mL 牛血清白蛋白溶液作为水相,PLGA(50 ∶50)溶于2 mL 氯仿/乙醇(4 ∶1)中作为油相,超声功率600 W,超声时间3 min,考察油水相比例2 ∶5、2 ∶8、2 ∶11、2 ∶14,结果见表5。由表可知,当油水相比例超过2 ∶8时,粒径明显变小,而包封率在该比例时最高,故选择2 ∶8作为油水相比例。

表4 PLGA 质量浓度对粒径、PDI、包封率、载药量的影响(n=3)Tab.4 Effects of PLGA concentration on particle size,PDI,encapsulation efficiency and drug loading(n=3)
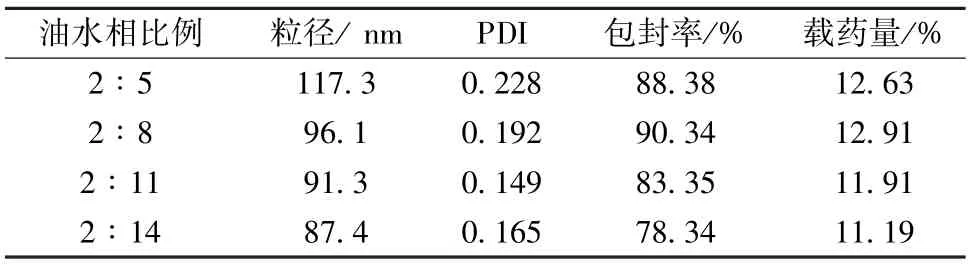
表5 油水相比例对粒径、PDI、包封率、载药量的影响(n=3)Tab.5 Effects of oil-water phase ratio on particle size,PDI,encapsulation efficiency and drug loading(n=3)
3.2.6 投药量 选择选择“3.2.1”项下水相和油相,油水相比例8 ∶2,超声功率600 W,超声时间4 min,考察投药量4、5、6、7 mg,结果见表6。由表可知,投药量4、5 mg 时,粒径小而均匀,包封率高;6 mg 时,包封率明显下降;7 mg时,纳米粒出现明显的浑浊,离心后通过偏光显微镜发现它是由药物结晶造成的,故选择5 mg 作为投药量。
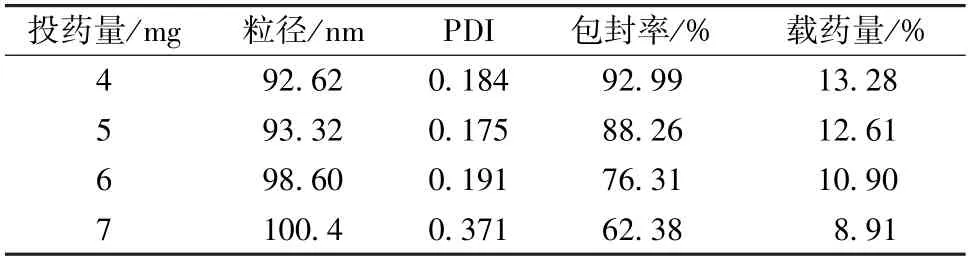
表6 投药量对粒径、PDI、包封率、载药量的影响(n=3)Tab.6 Effects of drug-fed consumption on particle size,PDI,encapsulation efficiency and drug loading(n=3)
3.3 粒径、形态 纳米粒粒径为(98.3±2.34)nm,PDI 为(0.149±0.012)。图1显示,纳米粒呈球形,具有明显的核-壳结构,形态规整,大小均匀,之间无粘连,粒径约为100 nm 左右。
3.4 稳定性 表7显示,无论是在纯水还是在磷酸盐缓冲液(pH=7.4)中,纳米粒粒径、包封率均未发生明显变化,表明其稳定性良好。

图1 纳米粒TEM 图Fig.1 TEM images for nanoparticles

表7 纳米粒稳定性考察结果Tab.7 Results of stability investigation of nanoparticles
3.5 体外释放行为 图2显示,原料药能顺利通过透析袋,在6 h 时已释放完全;纳米粒释药初期附着于其表面的药物快速释放,形成轻微突释效应,而后期释药平缓,在24 h 时累积释放度约为80%,呈现出明显的缓释效应。
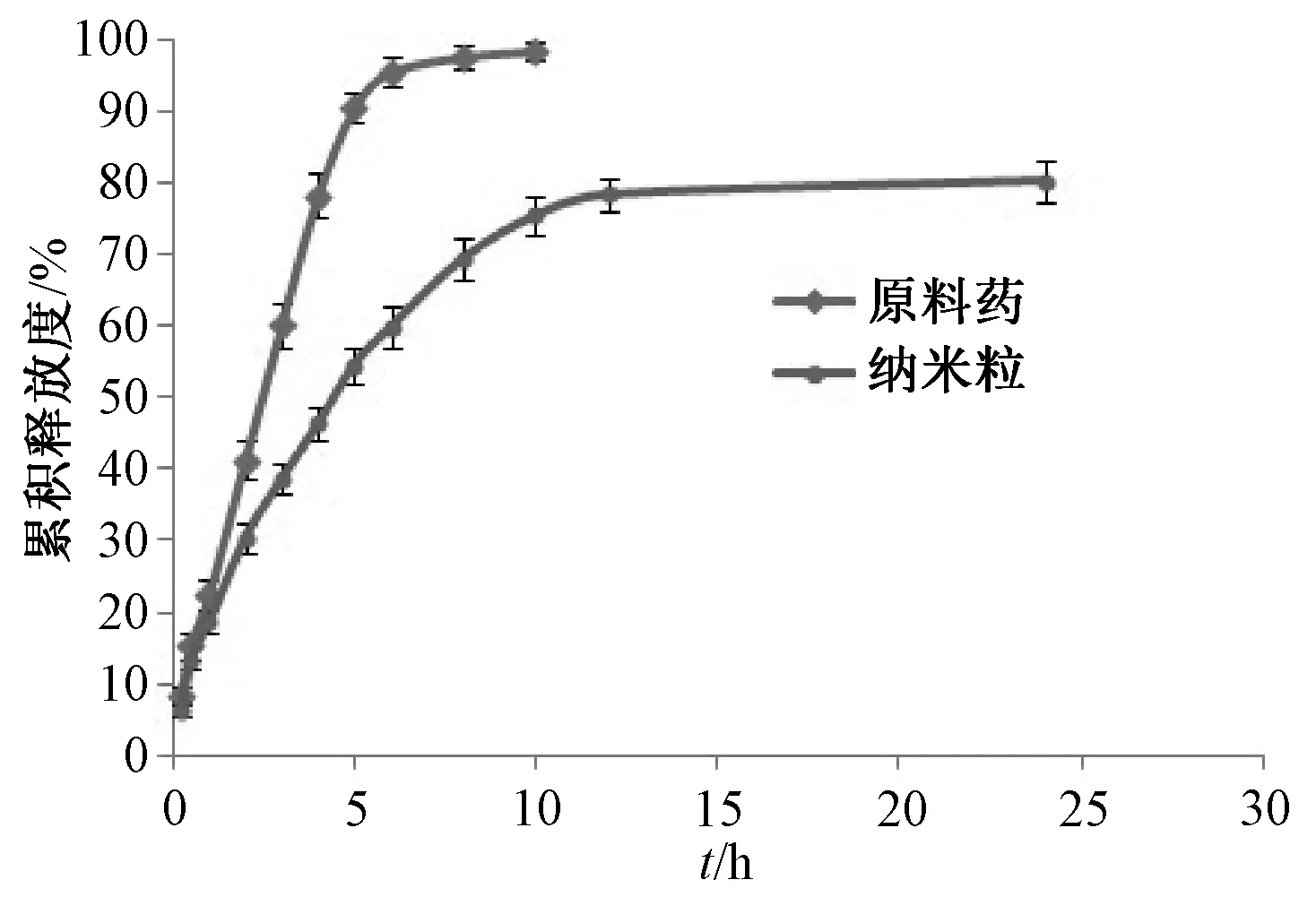
图2 样品体外释药曲线Fig.2 In vitro drug release curves for samples
3.6 红外测定 将柚皮素、牛血清白蛋白、PLGA、纳米粒分别与溴化钾混合研磨后,通过红外可见分光光度计测定,结果见图3。由图可知,纳米粒在~1 300 cm-1处钝而弱的峰可能为N-H,~1 600 cm-1处锐而强的峰可能为C=O,1 500~1 400 cm-1处吸收强度比较小的尖峰可能为C=N;牛血清白蛋白吸收峰和纳米粒基本相似;PLGA 在~2 900 cm-1处2个尖峰可能是乳酸中C-H,~1 700 cm-1处1个强峰可能为C=O,~1 400 cm-1处尖峰可能为-OH;柚皮素杂峰比较多,在1 629 cm-1处出现明显尖峰,吸收强度较强,可能为苯环特征峰,~1 600 cm-1处最强尖峰为C=O,~1 100 cm-1处1个吸收峰初步判断为C-O-C,3 200~3 000 cm-1处扁平峰为羟基。另外,通过峰形可观察到纳米粒与牛血清白蛋白的峰比较接近,表明在前者外层吸附着1层白蛋白。
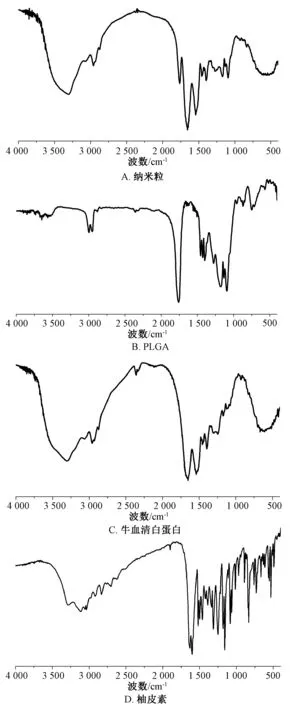
图3 样品红外光谱图Fig.3 Infrared spectra for samples
4 讨论及结论
乳化溶剂挥发法可分为两步,探头超声乳化制备初乳,以及搅拌下挥发有机溶剂,水油两相超声后形成纳米乳,由于溶剂挥发后纳米粒逐渐形成,故超声乳化过程对纳米粒形成及粒径、包封率的影响很大。超声过程中不断增加功率、延长时间并不能明显减少纳米粒粒径,其原因可能是达到一定功率和时间后会降低油水两相的表面张力,并使之达到平衡,形成纳米乳,故不需无限制增加两者。
牛血清白蛋白质量浓度为10、15 mg/mL 时,样品均在1 d 后出现沉淀,表明质量浓度过低不能起到稳定纳米粒胶体体系的作用;质量浓度足够,蛋白充分包围在纳米粒表面,使其均匀分散在悬浮液中;质量浓度过高,会导致纳米乳体系黏度过大,影响超声乳化效果。因此,确定牛血清白蛋白质量浓度为20 mg/mL。
当水相体积为5 mL 时,纳米混悬液于48 h 后出现沉淀,表明水相体积不能过小,其原因可能为油水相混合后超声时可形成水包油(O/W)乳剂,若水相体积减小,有机相形成的微小乳滴就不能较好地分散在水相中,而且水相减少可导致乳滴之间融合趋势增加,溶剂挥去后纳米粒容易形成沉淀。
白蛋白载药体系在延长载体体内循环时间、提高药物稳定性和药效等方面具有其他传统药物载体不可比拟的优势,相较单纯白蛋白载药,白蛋白-PLGA 纳米粒复合型载药体系可实现更多功能,如体内肿瘤靶向性等。本实验制备了载柚皮素的牛血清白蛋白修饰PLGA 纳米粒,并初步探究其优化工艺、结构表征、体外释放等,可为后期进一步体内研究奠定基础。

