凝胶过滤层析一步纯化MC-LR Fab的方法及吸附机制初探
焦文阳,陆 宁,王兰腾,关 甜,雷红涛,沈 兴
(华南农业大学食品学院,广东广州 510642)
免疫球蛋白G(Immunoglobulin G,IgG)是血清主要的抗体成分,结构由抗原结合片段(antigen-binding fragment,Fab)和可结晶片段(fragment crystallized,Fc)组成。其中Fab片段保留了抗体完整的抗原结合部位及互补决定区,在临床诊断治疗[1-2]、免疫分析检测[3-4]和生命科学基础研究等领域,以其结构简单、分子量小、免疫原性低、不与Fc受体结合、组织渗透力高等优点[5]越来越受到重视,被认为有取代完整抗体的潜质。
目前,以天然抗体为原料,制备Fab片段的主要方法为酶解法,通过蛋白酶作用于IgG铰链区附近的肽键,将完整的IgG水解为Fab片段和Fc片段[6],再利用亲和层析、离子交换层析和凝胶过滤层析等一系列的蛋白纯化方法对酶解产物进行纯化,获得单一的Fab片段。由于酶切条件对酶切位点专一性有较大影响、且Fab片段与Fc片段大小相近等原因,给实际的纯化过程造成较大干扰,往往需要多种纯化手段的组合使用才能得到纯度较高的Fab片段。为减少Fab纯化步骤,目前的研究集中于新型纯化介质的开发,如Spooner等[7]开发了新型抗CH1亲和层析树脂,能够一步从轻链二聚体中纯化得到正确组装的Fab片段;Gagnon等[8]使用钙衍生化羟基磷灰石,利用Fab不能与钙衍生形式的羟基磷灰石结合,能够从木瓜蛋白酶消化液纯化获得95%以上的纯度的Fab片段。除此之外,新型金属离子亲和层析介质[9]、固定化抗Fab抗体[10]等介质也被应用于Fab纯化。新型纯化材料虽可提升Fab纯化效率,但与此同时伴随着普及程度低、商业化应用少,成本高,特异性、稳定性较差等问题。如何利用现有的、广泛应用的层析填料进一步改进Fab片段的纯化效率,对研究高效制备Fab片段具有重要意义。
本研究前期获得一株抗水体污染物MC-LR抗体,其Fab片段与凝胶过滤层析(gel filtration chromatography,GFC)介质存在非常强烈的非特异性结合,无法流穿。在此基础上利用凝胶过滤层析柱通过改变流动相条件一步纯化Fab片段,在不同离子强度和pH的流动相中,考察Fab片段在凝胶过滤层析柱上的吸附选择性,结合Fab片段本身性质对二者的吸附机制进行探讨,以期为Fab片段高效纯化方法的开发提供一种新的思路,同时为蛋白纯化提供理论参考。
1 材料与方法
1.1 材料与仪器
微囊藻毒素-LR(MC-LR) 美国Enzo Life Sciences公司;基础培养基及胎牛血清 美国Gibco公司;HiTrap Protein G HP预装柱和Hiload Superdex 75(S-75)16/60层析柱 美国GE Healthcare公司;木瓜蛋白酶(酶比活为16~40 BAEE U/mg) 美国Thermo公司;TGXTMFastCastTM蛋白胶试剂盒(12%)和标准蛋白分子量(Maker) 美国Bio-Rad公司;柠檬酸、磷酸二氢钠、氯化钠等常用试剂(分析纯) 天津大茂公司;甘氨酸、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(纯度均大于90%) 美国Sigma公司;SPF级Balb/c小鼠 广东省动物中心;MC-LR杂交瘤细胞株 由本实验室保存。
AKTA pure蛋白纯化仪 美国GE Healthcare公司;Mulstiskan FC型酶标仪 美国Thermo公司;ChemiDocTMXRS+凝胶成像系统 美国Bio-Rad公司;PowerPacTM通用电泳仪 美国Bio-Rad公司;NanoDrop 2000c微量分光光度计 美国Thermo公司。
1.2 实验方法
1.2.1 MC-LR单克隆抗体的制备及酶解 复苏MC-LR杂交瘤细胞株,使用完全培养基(基础培养基500 mL,胎牛血清50 mL)扩大培养,将细胞悬液(500 μL/只)注射到提前一周注射过500 μL石蜡的Balb/c小鼠腹腔内制备腹水。采用HiTrap Protein G HP预装柱对腹水进行亲和层析,使用PBS缓冲液(20 mmol/L 磷酸缓冲液(PB),100 mmol/L NaCl,pH7.4)结合IgG,pH2.7的0.1 mol/L甘氨酸-盐酸缓冲液洗脱,收集洗脱组分。使用木瓜蛋白酶酶解IgG,酶解条件为酶抗质量比1∶80,半胱氨酸浓度25 mmol/L,pH7.0,反应温度37 ℃,反应时间10 h[6]。
采用SDS-聚丙烯酰胺凝胶(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)对样品进行非还原和还原电泳分析,其中还原样品中添加二硫苏糖醇(DL-dithiothreitol,DTT)并经煮沸(5 min)处理,可以使抗体重链和轻链间的二硫键断裂,从而显示两条链的分子量,而非还原样品不做相应处理,显示本身分子量。使用TGXTMFastCastTM蛋白胶试剂盒配制12%的蛋白胶,0.5 mg/mL的样品每孔上样10 μL,电泳条件为恒流25 mA、30 min。蛋白胶使用考马斯亮蓝染色液染色[11],使用凝胶成像系统记录条带。
1.2.2 凝胶过滤层析纯化酶解液及Fab片段纯度、收率分析 S-75凝胶层析预装柱使用PBS缓冲液(同1.2.1)平衡,酶解液经0.22 μm滤膜过滤后上样,流速为1 mL/min,收集各峰组分,一个柱体积后切换超纯水洗脱,收集洗脱峰组分。各组分经SDS-PAGE电泳分析(同1.2.1),将电泳分析为Fab片段的组分置于PBS缓冲液(同1.2.1)中,4 ℃透析1 d,-80 ℃冰箱中保存。
使用Image Lab软件对Fab片段进行纯度分析。使用NanoDrop 2000c测定Fab片段在280 nm下吸光度,根据公式1算浓度c,再乘以体积便得到Fab片段质量。一个IgG由2个Fab片段及一个Fc片段组成,结合Fc和Fab的理论分子量(55、45 kDa),10 mg IgG理论上可以得到约6.2 mg Fab片段。将实际Fab片段质量除以理论Fab片段质量,便可计算出Fab片段的回收率[12]。
c(mg/mL)=A280 nm×稀释倍数/1.37
式(1)
1.2.3 间接ELISA检测Fab片段效价与抑制 采用间接ELISA法(ic-enzyme-linked immunosorbent assay,ic-ELISA)对Fab片段进行效价与抑制的检测。以MC-LR与载体蛋白OVA偶联制备包被原,1 μg/mL包被酶标板。Fab片段(10 mg/mL)从500倍起倍比稀释,使用1 μg/mL MC-LR检测Fab片段的抑制效果。根据公式2,取OD0值最接近1.0的抗体稀释倍数的数据计算Fab片段对MC-LR的抑制率[13],并与腹水抑制率进行比较。通常抑制率大于50%表明结果为阳性,抑制率越高,表明Fab片段对MC-LR的抑制效果越好。
抑制率(%)=(OD0-OD)/OD0×100
式(2)
式中:OD0为不添加药物的光密度值;OD为添加药物的光密度值。
1.2.4 Fab片段与S-75填料结合机制分析 分别配制0.25%、0.5%、1%、2%、4%和6%的SDS溶液,Fab片段分别在不同浓度SDS溶液下4 ℃孵育过夜,SDS-PAGE电泳验证250 kDa条带组分。采用平板等电聚焦法测定Fab片段等电点pI[14]。分别在含有100 mmol/L NaCl和不含NaCl,pH为7.4和9.0的条件下,相互组合配制4种20 mmol/L Tris缓冲液(表1中缓冲液2~缓冲液5)。将4种缓冲液作为流动相重新纯化Fab片段,考察不同条件下Fab片段在S-75层析柱上不同的保留行为。
2 结果与分析
2.1 IgG纯化和酶解片段的电泳分析
小鼠腹水进行Protein G纯化后的产物及木瓜蛋白酶酶解产物分别进行SDS-PGAE电泳分析。IgG理论分子量约为150 kDa,经还原后获得约50 kDa的重链片段与约25 kDa的轻链片段。根据protein G亲和纯化产物的电泳显示(图1a),洗脱蛋白非还原电泳(泳道1)中除了少量高分子量的杂蛋白(约250 kDa),主要成分为120 kDa(150 kDa附近)处条带,其在还原电泳中(泳道4)表现为50 kDa和25 kDa的条带,分子量对应IgG的轻链和重链,说明该条带为IgG。与流穿蛋白相比较(泳道2、3),未见其余明显杂带,表示从小鼠腹水中经Protein G纯化得到了较纯的IgG。从酶解产物电泳(图1b,泳道1)可以看出,IgG经由木瓜蛋白酶酶解主要生成了37 kDa上下的两条带及少量55 kDa和22 kDa附近条带,120 kDa处的IgG含量极少,表示IgG基本酶解完全。酶解产物在还原泳道中(泳道2)表现为25 kDa附近三条带及少量50 kDa处条带。

图1 Protein G亲和纯化及酶解产物聚丙烯酰胺凝胶电泳分析Fig.1 SDS-PAGE analysis of ascites purifiedby protein G and digestion products注:M为蛋白标准分子量;a:1为洗脱蛋白非还原电泳;2为流穿蛋白非还原电泳;3为流穿蛋白还原电泳;4为洗脱蛋白还原电泳;b:1、2分别为酶解产物非还原及还原电泳。
2.2 Fab片段的纯化
酶解产物经过凝胶过滤层析介质S-75分离,PBS缓冲液作为流动相时展现2个蛋白峰(P1、P2),流动相切换为超纯水后,在电导下降处出现第3个蛋白峰(图2a)。由于P1组分紫外吸收信号值小于10 mAu,样品浓度过低,使用SDS-PAGE分析不足以显示条带,因此选择P2及P3进行SDS-PAGE分析(图2b)。Fc片段理论分子量约55 kDa,由两条相同的部分重链组成,其在还原电泳中表现为约25 kDa的一条带,P2组分中约40 kDa的条带(泳道1、2)在还原电泳中表现为25 kDa上方的一条带(泳道6、7),由此判断为Fc片段,另外还有少量酶解碎片及未酶解的IgG(泳道2中120 kDa条带和泳道7中50 kDa条带及约23 kDa条带);Fab片段由重链和轻链组成,其理论分子量约为45 kDa,但由于两条链分子量不同,在还原电泳中表现为25 kDa附近两条带。P3组分主要有37 kDa附近条带及少量250 kDa处条带,对应还原泳道(泳道8、9)为25 kDa上下两条带,由此初步判断P3为Fab片段。Image Lab软件分析显示,Fab片段纯度达到94.5%。P3组分经浓缩、测定浓度、计算质量,20 mg IgG得到了6.3 mg Fab片段,根据公式1计算其收率为51%。

图2 S-75层析柱分离酶解产物谱图及聚丙烯酰胺凝胶电泳分析Fig.2 S-75 chromatography andSDS-PAGE analysis of digestion products注:M.蛋白标准分子量;1、2为P2非还原电泳;3~5为P3非还原电泳;6、7为P2还原电泳;8、9为P3还原电泳。
2.3 Fab片段效价与抑制测定
使用ic-ELISA方法测定P3组分的效价与抑制,以不同稀释倍数下450 nm的紫外吸光度值绘制效价抑制曲线图(图3),根据公式2计算出P3对MC-LR的抑制率为94%,与腹水活性相似(抑制率90%)。抑制率可以反映待测样品特异性结合抗原的能力,Fab片段由于保留抗原结合区域,因此具有抗原结合能力,而Fc片段无法结合抗原。综合P3组分和电泳分析及对MC-LR抑制率的测定,证明P3组分为Fab片段。此纯化方法制备的Fab片段对MC-LR保持了良好的特异性,可为后续建立MC-LR快速免疫分析方法及结构生物学研究进行抗体性能改造提供材料。
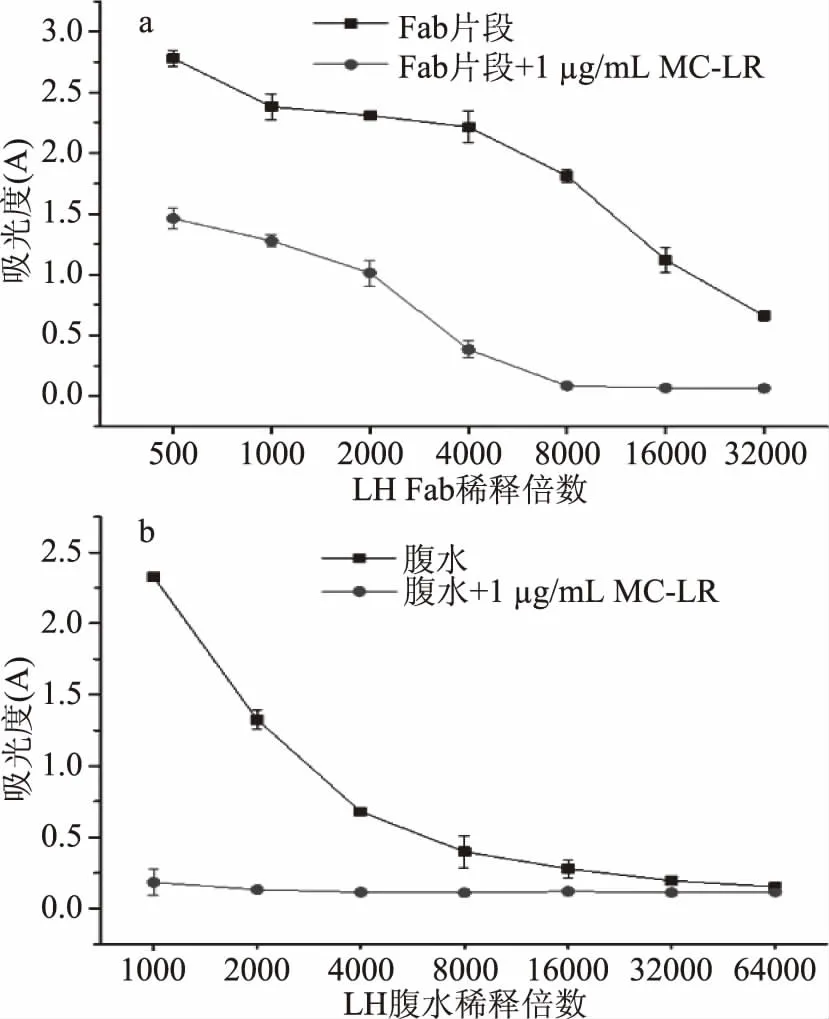
图3 Fab片段(a)和腹水(b)对MC-LR的效价和抑制Fig.3 The titer and inhibition of the Fab fragment(a)and ascites(b)to MC-LR
2.4 Fab片段与S-75填料结合机制研究
为研究Fab片段与S-75间的吸附作用,研究蛋白等电点及聚集行为,改变流动相条件对Fab片段的保留行为进行分析。

表1 S-75色谱柱纯化抗体Fab片段时不同的流动相条件及Fab片段保留行为Table 1 The buffer conditions for S-75 and the retention behaviors of Fab fragment under different conditions
注:-代表不添加。2.4.1 Fab片段聚集研究 由于Fab片段的还原泳道(图2b)仅有很纯净的重链和轻链两条带,因此推测非还原泳道(图2b)中250 kDa的杂带是Fab片段的聚集体。一般来说,蛋白质越疏水,就越有可能形成聚集物[15]。SDS作为一种表面活性剂,能够与蛋白质疏水界面结合破坏疏水作用,从而减少蛋白聚集[16]。因此将Fab样品分别在不同浓度的SDS溶液中孵育研究Fab片段的聚合。电泳结果显示,相比于SDS溶液浓度为0.25%和0.5%的泳道,250 kDa条带在浓度高于1%的SDS溶液中消失(图4),仅存Fab单体条带,证实250 kDa条带为Fab片段的聚集体。随着SDS添加浓度的增加,蛋白质聚集率降低,推测Fab片段表面可能具有较强的疏水性引起其聚集。

图4 Fab片段在不同浓度的SDS溶液中孵育过夜后非还原电泳分析Fig.4 SDS-PAGE analysis of Fab fragmentincubated in SDS solutions with different concentrations
2.4.2 Fab片段pI测定 Fab片段等电点聚焦图谱见图5。由样品的迁移距离计算得到条带1等电点为6.02,条带2等电点为5.66。样品中含有单体和聚集体,根据浓度判断条带对应成分。由于条带1组分浓度高于条带2组分,结合SDS-PAGE凝胶图(图2)Fab片段浓度明显高于聚集体,判断抗体Fab片段等电点为6.02。

图5 标准品和供试品的等电点测试图谱Fig.5 pI analysis of Fab fragment注:M为等电点标准蛋白,1:Fab片段;2:Fab片段聚集体。

图6 四种不同的条件作为流动相纯化Fab片段的凝胶过滤层析谱图Fig.6 S-75 chromatography of Fab fragment under different conditions注:a:缓冲液2;b:缓冲液3;c:缓冲液4;d:缓冲液5。
2.4.3 Fab片段在不同缓冲液下的凝胶过滤层析 结合Fab片段等电点及疏水性,改变流动相不同离子强度与pH,不同条件下Fab片段在柱中保留行为如表1所示。为了排除最初使用的PBS缓冲液(缓冲液1)中缓冲液自身离子强度的干扰,使用Tris-HCl缓冲液进行离子强度与pH的研究。改变pH7.4的Tris-HCl缓冲液中的盐浓度(缓冲液2、缓冲液3),结果显示中性盐浓度引起的离子强度改变不影响Fab片段的结合(图6a、6b),表明pH7.4的条件下,即使离子强度非常低也无法解除Fab片段的吸附。pH增大至9.0,同时保持低离子强度不变(缓冲液4),Fab片段可以在48 mL时正常出峰(图6c),而保持pH9.0,再次增加盐浓度至100 mmol/L(缓冲液5),Fab片段重新与柱填料产生吸附(图6d),表明同时升高pH和降低离子强度能够解除Fab片段吸附。
3 讨论
抗体酶解后产物成分较为复杂,现有纯化方法较难实现Fab片段的一步分离。如唐思远[12]使用蛋白A纯化人源IgG木瓜蛋白酶酶解产物,纯化产物中除Fab片段外还含有其他酶解碎片,需要叠加离子交换进行进一步纯化。多种纯化手段的叠加使其分离操作繁琐并影响产率。Nascimento等[17]使用蛋白A、蛋白L两步纯化酶解产物时,经第二步纯化后的Fab片段与第一步相比有较大损失。本研究可以利用Fab片段与凝胶过滤层析填料S-75非特异性结合的特性一步纯化获得高纯Fab片段。在之前的报道中,Fab片段在此填料中的保留体积为柱体积的40%~50%,如Quintero-Hern’ andez V等[18]使用S-75(10 mm×300 mm,柱体积30 mL)纯化4种Fab片段,保留体积为14.8~15.9 mL;Liebscher等[19]纯化Fab片段,在S-75(柱体积120 mL)中的保留体积约为60 mL。关于蛋白质与凝胶过滤层析相互作用的报道多集中于蛋白提前或延迟出峰,通常影响凝胶过滤层析样品理论出峰时间的因素主要有固定相和样品之间的疏水作用、离子交换和离子排阻作用,如转铁蛋白(Transferrin)在pH4.2时存在的离子交换作用和pH10低离子强度下存在的离子排阻作用使出峰时间推迟或提前[20]。而像本研究中的Fab片段与S-75介质强烈结合导致无法流出的情况目前还未见报道。
二者结合可能与Fab片段本身独特的性质有关,Fab片段在SDS溶液中孵育后的SDS-PAGE(图5)证明SDS能够使其形成的聚集物解聚。SDS参与破坏蛋白间疏水界面[16],提示此Fab片段表面疏水性较强。对于一些疏水性蛋白,缓冲液离子强度的增加会引起蛋白与凝胶过滤层析填料间的疏水作用[21-22]。低离子强度的缓冲液中水分子在蛋白质疏水区域形成水化层,加入中性盐提高离子强度时水化层中水分子被移去以溶剂化盐离子,使蛋白表面疏水性增大[23]。本文在切换为超纯水、离子强度为0的情况下消除了Fab片段与柱填料的吸附,推测该Fab片段的表面疏水性是与柱填料吸附的主要原因。
同时,Superdex系列介质表面存在少量负电荷[22],Fab片段的pI为6.03,在缓冲液pH大于pI时,Fab表面同样携带负电荷,与柱填料之间产生离子排阻作用,可以促进其流出。而在pH7.4的流动相中改变离子强度,Fab片段均被吸附,原因可能为此时离子排阻作用强度较弱,没有超过疏水作用力。当pH升高至9.0时蛋白表面负电荷增加,与填料间离子排阻作用增强,在低离子强度下可以与疏水作用相抵消,Fab片段能够随缓冲液正常流出。pH9.0时增大离子强度使Fab片段与柱填料疏水作用增强,大于离子排阻作用,导致Fab片段重新结合。
4 结论
通过凝胶过滤层析建立了酶解混合物中微囊藻毒素Fab片段的一步纯化方法。所制备的Fab片段纯度大于90%,对MC-LR抑制率达94%,Fab片段回收率为51%。在含有100 mmol/L NaCl和不含NaCl,pH7.4和pH9.0相互组合的四个20 mmol/L Tris缓冲液分别作为流动相时,只有pH9.0、不含NaCl的20 mmol/L Tris可以使Fab片段在48 mL正常流穿。结合Fab片段pI 6.03,易产生聚集且1% SDS溶液可以使其解聚的性质,初步分析是由于Fab片段具有较强的表面疏水性而与S-75填料产生疏水吸附,流动相中低离子强度及远高于蛋白pI的pH可以影响疏水与离子排阻作用,从而使Fab片段消除吸附。Fab片段与S-75结合的现象及纯化方法为疏水性Fab片段今后在凝胶过滤层析上实现新的纯化模式提供参考。

