大豆肽对力竭运动大鼠血流动力学及心肌自噬水平的影响
,*
(1.漯河医学高等专科学校,河南省肿瘤发生与防治创新型科技团队,河南漯河 462002;2.河南省南街村(集团)有限公司,河南临颍 462600)
力竭运动(Exhaustive exercise,EE)是指机体活动超出机体承受能力直至无法再运动,是一种超强度、超负荷运动,因此机体对血、氧及能量的需求急剧增加,还会不断生成自由基,势必会对组织器官造成不同程度的损伤[1]。心脏是机体重要的供血循环动力器官,对缺血缺氧十分敏感,极易诱发病变,这也是引发运动员心律失常、心功能衰竭甚至猝死的主要原因[2]。细胞自噬(Autophagy)是指真核细胞利用溶酶体将胞内受损变性蛋白、有害因子或衰老细胞器进行消化降解的程序化过程[3]。正常水平的自噬是机体维持内环境稳态的正常生理过程,使机体免受损伤刺激的伤害,但若自噬过度亦可损伤正常细胞器或蛋白分子,诱发或加重器官组织损伤[4]。研究报道,力竭运动造成的心肌缺血缺氧损伤可诱导和提高心肌细胞自噬水平,导致心肌损伤或坏死等病理变化,出现心功能障碍[5-6]。
大豆肽(Soybean peptide,SP)是由大豆蛋白粉经微生物发酵或酶解而得到一种短肽混合物,含有人体所需的8种必需氨基酸成分,易于消化和吸收。研究表明,大豆肽具有抗氧化、调血脂、抗疲劳、抗肿瘤及免疫调节等药理作用[7-8]。研究发现,大豆肽对力竭运动大鼠心脏具有一定的保护作用,其机制可能与抗氧化应激和抑制NF-κB信号通路有关[9]。本文将大豆肽灌胃给药力竭运动大鼠,观察其对大鼠心脏血流动力学及病理学改变的影响,同时检测大鼠心肌组织微管相关蛋白轻链3(Microtubule-associated protein 1 light chain 3,LC3)、Beclin-1及自噬相关因子7(Autophagy-related gene 7,Atg7)等自噬因子的表达变化,探讨其抑制自噬相关作用机制,为提升其营养价值提供理论依据。
1 材料与方法
1.1 材料与仪器
健康SD大鼠(动物许可证号:SYXK(湘)2014-0006) SPF级,雄性,8~10 w龄,体重180~220 g,购自湖南斯莱克景达实验动物有限公司,将大鼠置于鼠笼中饲养,每笼4~5只,饲养室温度为22~25 ℃,湿度50%~60%,光照周期12 h:12 h,自由饮食水;大豆肽 分子量为500~3000 Da,临用时用蒸馏水混悬,河南省南街村(集团)有限公司;戊巴比妥钠 美国Sigma公司;肝素钠注射液 江苏万邦生化医药股份有限公司;LC3、Beclin-1、Atg7、β-actin抗体(兔抗鼠)、BCA蛋白浓度测定试剂盒、RIPA(Radio Immunoprecipitation Assay)裂解液(强)、彩色预染蛋白分子量Marker(10~170 kDa)、辣根过氧化物酶标记山羊抗兔IgG二抗、ECL显色液、PVDF膜、SDS-PAGE凝胶配制试剂盒、总RNA提取Trizol试剂、逆转录试剂盒、cDNA第一链合成试剂盒等 上海碧云天生物技术有限公司南通分公司;PCR引物设计与合成 上海捷瑞生物工程有限公司。
DW-86L578J超低温冰箱 海尔生物医疗设备有限公司;FA1004电子分析天平 上海光学仪器厂;H1850高速冷冻离心机 湖南湘仪离心机仪器有限公司;Mini-PROTEAN® Tetra垂直电泳槽、T100TMPCR仪、Sub-Cell GT 水平电泳槽、ChemiDocTMXRS+化学发光凝胶成像系统等 美国Bio-Rad公司;BL-420F生物信号采集与分析系统 成都泰盟生物科技有限公司。
1.2 实验方法
1.2.1 动物分组及给药 大鼠适应性饲养5 d,置于盛有自来水的游泳训练水桶(高60 cm、直径100 cm),水深50 cm,设置水温为(33±2) ℃,将不会游泳或游泳能力较差(游泳时间<5 min)的大鼠去除。将筛选后的大鼠分为正常对照组(Control)、力竭运动模型组(Model)及大豆肽高、中、低剂量组,共5组,每组10只。正常对照组灌胃蒸馏水,不进行强迫运动;力竭运动模型组灌胃蒸馏水,并强迫游泳至力竭;大豆肽高、中、低剂量组分别灌胃大豆肽500、250及125 mg/kg,并强迫游泳至力竭。给药容量均为0.1 mL/100 g,每次于游泳前2 h灌服,连续4 周。
1.2.2 力竭运动大鼠动物模型的制备 将大鼠尾部用铅丝捆绑负重(铅丝重量为体重5%)放入游泳训练水桶中,使其连续游泳直至力竭。大鼠运动至力竭的判断标准:大鼠在水中持续游动直至不能再动,并沉入水中10 s以上不能上浮[9-10]。正常对照组常规饲养,不进行游泳运动;力竭运动模型组及大豆肽组大鼠均进行力竭游泳运动,隔2 d休息1次,持续4 w。末次力竭运动后,进行大鼠血流动力学、心肌组织病理学及相关因子的mRNA和蛋白表达水平测定。
1.2.3 大鼠血流动力学的测定 大鼠麻醉后仰卧固定于手术台上,于距离下颌2 cm至锁骨上1 cm处切开颈部皮肤约1 cm,逐层分离肌肉,游离右颈总动脉约2~4 cm,结扎远心端,用动脉夹夹闭近心端,将充满肝素钠注射液的心导管顺着颈总动脉向心脏方向缓慢推进至预定部位,松开动脉夹,并及时打开BL-420F生物信号采集与分析系统压力传感器上的三通管阀门,在计算机上观察到动脉血压曲线,此时继续推进心导管,直至在计算机屏幕上观察到明显的心室搏动波形,表明心导管已插入左心室,固定心导管,30 min后待波形稳定后记录大鼠LVEDP、LV dp/dt max、LV dp/dt min、LVSP、MABP及HR等参数[11]。
1.2.4 大鼠心肌组织病理学检测 取大鼠心尖组织约100 mg,生理盐水冲洗干净后,放入4%多聚甲醛溶液中固定,然后依次脱水、透明、浸蜡和包埋,切片(4 μm)后用HE染色,于显微镜下观察心肌组织病理学变化。
1.2.5 RT-PCR法检测大鼠心肌组织LC3、Beclin-1及Atg7 mRNA表达水平 取大鼠心肌组织约50 mg,用PBS冲洗干净,用眼科剪快速充分剪碎,置于1.5 mL EP管中,加入1.0 mL Trizol并剧烈震荡使其充分反应,4 ℃12000 r/min离心15 min,按照RNA提取试剂说明书进行操作,提取总RNA,进行逆转录合成cDNA,然后进行PCR扩增实验。

表1 大豆肽对力竭运动大鼠左心室血流动力学参数的影响(n=10)Table 1 Effects of SP on left ventricular hemodynamic parameters in rats with exhaustive exercise(n=10)
注:与正常对照组比较:*表示P<0.05,差异显著,**表示P<0.01,差异极显著;与模型组比较:#表示P<0.05,差异显著,##表示P<0.01,差异极显著;表2~表3同。各基因引物序列为LC3-F:5′-CTCTGTCATGGATGGAACCCAA-3′,LC3-R:5′-TACAGGTGTCACACAACGGAG-3′,产物255 bp;Beclin-1-F:5′-GAATGGAGGGGTCT AAGGCG-3′,Beclin-1-R:5′-CTTCCTCCTGGCTC TCTCCT-3′,产物180 bp;Atg7-F:5′-ACCCCAGG ACTGGTGATCTG-3′,Atg7-R:5′-GACACAGGAAA GGGTGCAACT-3′,产物107 bp;β-actin-F:5′-AACACCCCAGCCATGTACG-3′,β-actin-R:5′-ATGAGGGAGCGCGTAACC-3′,产物138 bp。
PCR反应体系:cDNA 5 μL,上游引物5 μL,下游引物 2 μL,2×PCR MasterMix 1 μL,ddH2O 12 μL。
PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。于2.0%琼脂糖凝胶上将扩增产物电泳,凝胶成像系统下拍照成像,读取条带光密度值并计算LC3、Beclin-1及Atg7 mRNA 相对表达水平。

表2 大豆肽对力竭运动大鼠心肌组织LC3、Beclin-1及Atg7 mRNA表达水平的影响(n=10)Table 2 Effects of SP on expression levels of mRNA of LC3,Beclin-1and Atg7 in myocardial tissue of rats with exhaustive exercise(n=10)
1.2.6 Western blot法检测大鼠心肌组织LC3、Beclin-1及Atg7蛋白表达水平 取大鼠心脏组织约100 mg,用眼科剪充分剪碎,置于2 mL离心管中,加入0.5 mL RIPA裂解液后用电动匀浆器充分匀浆并反应约15 min,移入1.5 mL EP管中,12000 r/min 4 ℃ 离心15 min,取上清即为蛋白提取物,然后进行蛋白定量并调整各样本蛋白至10 μg/μL,按照Western blot 实验步骤进行电泳、转膜、封闭、孵育一抗、二抗、显影及拍照等操作,以β-actin条带灰度值为内参,分析LC3、Beclin-1及Atg7 蛋白相对表达水平。
1.3 数据处理

2 结果与分析
2.1 大豆肽对力竭运动大鼠心脏血流动力学的影响
如表1,与正常对照组比较,力竭运动模型组大鼠LVEDP极显著升高(P<0.01),LV dp/dt max、LV dp/dt min、LVSP及MABP极显著降低(P<0.01)。与力竭运动模型组比较,大豆肽500 mg/kg组大鼠LVEDP极显著降低(P<0.01),LV dp/dt max、LVSP及MABP极显著升高(P<0.01),LV dp/dt min显著升高(P<0.05);大豆肽250 mg/kg组大鼠LVEDP极显著降低(P<0.01),LV dp/dt max、LVSP及MABP极显著显著升高(P<0.01);大豆肽125 mg/kg组大鼠LVEDP显著降低(P<0.05)。
2.2 大豆肽对力竭运动大鼠心肌病理学变化的影响
心肌组织HE染色镜下观察显示,正常对照组心肌结构完整,横纹清晰,未见明显病变(图1A);力竭运动模型组大鼠表现为广泛的心肌肌束紊乱,细胞明显肿胀,可见部分细胞变性、坏死,心肌间质有大量白细胞浸润(图1B);大豆肽500 mg/kg组大鼠心肌组织较模型组明显改变,横纹趋于清晰,可见散在、少量的白细胞浸润(图1C)。

图1 大豆肽对力竭运动大鼠心肌组织病理学变化的影响(200×)Fig.1 Effects of SP on myocardial histopathologicalchanges in rats with exhaustive exercise注:A为正常对照组,B为力竭运动模型组,C为大豆肽500 mg/kg组。
2.3 大豆肽对力竭运动大鼠心肌组织LC3、Beclin-1及Atg7 mRNA表达水平的影响
如图2,模型组中LC3、Beclin-1及Atg7 mRNA条带光密度增加;500 mg/kg大豆肽剂量组与模型组相比条带光密度降低。如表2,与正常对照组比较,力竭运动模型组大鼠心肌组织LC3、Beclin-1及Atg7 mRNA表达水平极显著上调(P<0.01);与模型组比较,大豆肽500 mg组大鼠心肌组织LC3、Beclin-1及Atg7 mRNA表达水平极显著下调(P<0.01)。

表3 大豆肽对力竭运动大鼠心肌组织LC3、Beclin-1及Atg7 蛋白表达水平的影响(n=10)Table 3 Effects of SP on expression levels of LC3,Beclin-1and Atg7 mRNA in myocardial tissue of rats with exhaustive exercise(n=10)
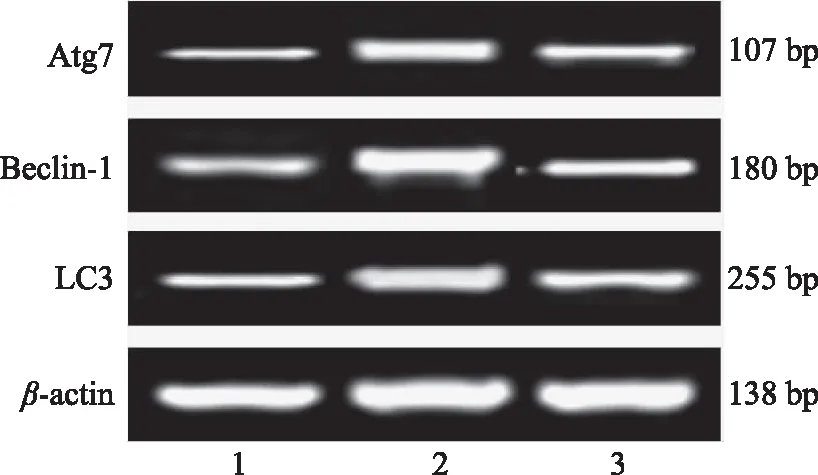
图2 大豆肽对力竭运动大鼠心肌组织LC3、Beclin-1及Atg7 mRNA表达水平的影响Fig.2 Effects of SP on expression levels of LC3,Beclin-1 and Atg7 mRNA in myocardialtissue of rats with exhaustive exercise注:1为正常对照组;2为力竭运动模型组;3为大豆肽 500 mg/kg组;图3同。
2.4 大豆肽对力竭运动大鼠心肌组织LC3、Beclin-1及Atg7蛋白表达水平的影响
如图3,模型组中LC3、Beclin-1及Atg7蛋白条带光密度增加;500 mg/kg大豆肽剂量组与模型组相比条带光密度降低。如表3,与正常对照组比较,力竭运动模型组大鼠心肌组织LC3、Beclin-1及Atg7蛋白表达水平极显著上调(P<0.01);与模型组比较,大豆肽500 mg组大鼠心肌组织LC3、Beclin-1及Atg7蛋白表达水平极显著下调(P<0.01)。
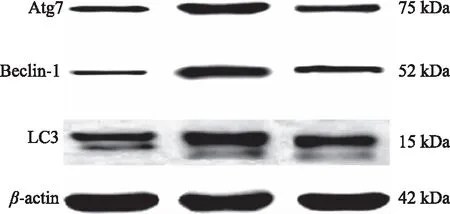
图3 大豆肽对力竭运动大鼠心肌组织LC3、Beclin-1及Atg7蛋白表达水平的影响Fig.3 Effects of SP on expression levels ofLC3,Beclin-1 and Atg7 mRNAin myocardial tissue of rats with exhaustive exercise
3 讨论
心脏血流动力学指标异常是力竭运动心脏病变的重要病理基础,主要是由于心肌缺血缺氧产生大量的自由基、炎症因子等有害物质,从而抑制心脏功能直至衰竭[12]。本研究发现大豆肽500 mg/kg可显著降低力竭运动大鼠LVEDP,升高LV dp/dt max、LV dp/dt min、LVSP及MABP等血流动力学参数;同时大豆肽500 mg/kg可明显改善力竭运动大鼠心肌组织的病理学变化,使心肌结构损伤减少,炎症细胞浸润降低。由此可知大豆肽对力竭运动大鼠心脏血流动力学有一定的改善作用,并能缓解心肌病理性损伤,提示其对心脏具有一定的保护作用,这与参考文献[9]结果一致。
大豆肽500 mg/kg可极显著降低力竭运动大鼠心肌组织LC3、Beclin-1及Atg7 mRNA和蛋白表达水平,提示大豆肽改善力竭运动大鼠心功能和血流动力学的作用机制与其抑制细胞自噬相关。研究报道,力竭运动导致的心肌缺血缺氧损伤可过度激活心肌细胞自噬,而自噬水平升高可诱发或加重心肌细胞损伤,降低心脏的舒缩功能,引发心律失常、心肌坏死及心功能障碍等疾病[13]。自噬是机体细胞为清除胞内衰老、损伤或坏死的蛋白质、代谢物和细胞器等而自发的一种保护性生物学行为,以此实现细胞本身的代谢需求和部分细胞器的更新[14]。但若细胞自噬行为过于激烈,使胞内蛋白质降解过多或使正常细胞器损伤,可诱发细胞自噬性死亡、凋亡或坏死等,从而导致组织器官损伤、功能障碍或疾病的发生[15]。
细胞在静息状态时,LC3以Pro-LC3形式存在,其C末端被Atg4水解暴露甘氨酸形成LC3Ⅰ,主要存在于胞浆中,当细胞被氧化应激等损伤因素刺激时自噬行为被激活,LC3ⅠC末端甘氨酸残基与Atg7、Atg3活性位点形成硫脂键,促进LC3Ⅰ与磷脂结合即形成LC3Ⅱ,LC3Ⅱ稳定结合在自噬体膜上并不断聚集,促进自噬体的形成,可见LC3Ⅱ的表达量与自噬程度或自噬体数量存在正比关系,所以可通过检测LC3(LC3Ⅰ和LC3Ⅱ)的表达水平初步判断细胞的自噬行为[16]。Beclin-1主要与PI3K形成复合体介导其他自噬蛋白(如Atg、LC3等)定位于自噬泡,从而启动自噬,并参与和调控自噬体的形成与转归[17]。由此可见,在自噬发生的过程中,LC3、Beclin-1及Atg7等因子与之密切相关,调控自噬的发生发展。
综上所述,大豆肽对力竭运动大鼠心脏功能、血流动力学及病理性损伤有一定的改善作用,其机制可能与抑制细胞自噬相关。

